задачи. А объясните, на чем основан гипогликемический эффект инсулина
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
ЗАДАЧА 12 У больного с повышенной концентрацией фенилаланина (Фен) в крови установлена нормальная структура фермента фенилаланингидроксилазы. Дальнейшее обследование позволило выявить мутацию по типу замены нуклеотида в гене фермента дигидробиоптеринредуктазы. Объясните, почему мутация по типу замены нуклеотида в гене этого фермента может стать причиной фенилкетонурии. Для этого вспомните, в какой из реакций превращения Фен участвует дигидробиоптерин. Напишите схематично эту реакцию. ОТВЕТ: Фенилкетонурия – наследственное заболевание, связанное с нарушением фермента фенилаланилгидроксилазы (классическая фенилкетонурия) или с нарушением перехода H4БП ↔ H2БП (вариантная фенилкетонурия) Нарушается реакция перехода фениланина в тирозин. сама реакция перехода осуществляется фенилаланин-4-монооксигеназой, коферментом которой является тетрагидробиоптерин. Чтоб он восстановился, нужна NADPH + H+-зависимая дигидроптеринредуктаза, 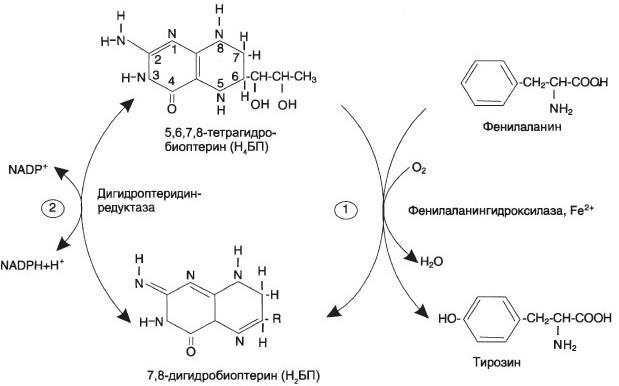 ЗАДАЧА 13 Для изучения аденилатциклазной системы был использован коклюшный токсин, вырабатываемый возбудителем коклюша. Коклюшный токсин в условиях эксперимента повышает активность аденилатциклазы практически в любой клетке эукариотов. Объясните действие коклюшного токсина. Для этого: а) приведите схему трансмембранной передачи сигнала; б) назовите белок аденилатциклазной системы, который подвергается модификации при действии коклюшного токсина на клетку. ОТВЕТ: а) Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так: взаимодействие рецептора с сигнальной молекулой (первичным посредником); активация мембранного фермента, ответственного за образование вторичного посредника; образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+; активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказьюают влияние на активность внутриклеточных процессов. Фермент аденилатциклаза, катализирующий превращение АТФ в цАМФ, - ключевой фермент аденилатциклазной системы передачи сигнала; цитоплазматические домены имеют два каталитических центра, ответственных за образование цАМФ - вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А. Внеклеточные регуляторы (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатциклазу. αs-Субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, α-субъединица (ингибирующая) ингибирует фермент. В свою очередь, аденилатциклаза стимулирует проявление ГТФ-фосфатазной активности α-субъединиц. В результате дефосфорилирования ГТФ образуются субъединицы, не комплементарные аденилатциклазе. б) Субъединица коклюшного токсина, проникая в клетку, катализирует АДФ-рибозилирование α-субъединицы активированного Gs-белка. Модифицированная α,-субъединица сохраняет высокое сродство к βγ-субъединицам, т.е. Gi-белок теряет способность диссоциировать на αi-ГТФ и βγ-субъединицы. Таким образом, ингибирующий сигнал (αi-ГТФ) не достигает аденилатциклазы, значит в этом случае возможна только её активация при связывании с αs-ГТФ. Действие коклюшного токсина на клетки тканей всегда приводит к повышению уровня цАМФ. ЗАДАЧА 14 Для изучения инозитолфосфатной системы использовали мембраны клеток печени. В инкубационную среду добавили активатор рецептора и субстрат фосфолипазы С. Однако концентрация Са2+ не возрастала. Что забыли добавить в инкубационную среду исследователи? Для решения задачи приведите схему инозитолфосфатной системы передачи сигнала. ОТВЕТ: Белок-активатор фосфолипазы С Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Последовательность событий, приводящих к активации фосфолипазы С: связывание сигнальной молекулы, например, гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Gр1с-белку. образование комплекса [Г] [К][Gрlс-ГДФ] приводит к снижению сродства α-протомера Gрlс-белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ. это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С. α-ГТФ взаимодействует с фосфолигазой С и активирует её. Под действием фосфолипазы-С происходит гидролиз липида мембраны фосфатидилинозитол-4,5-бисфосфата (ФИФ2). в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС) инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2+-канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала - Са2+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт. Активация протеинкиназы С Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС) и белком кальмодулином, таким образом сигнал, принятый рецептором клетки, раздваивается. Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами "кислого" фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция. На внутренней стороне мембраны образуется ферментативный комплекс - [ПКС][Са2+] [ДАГ][ФС] - активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину. ЗАДАЧА 15 Несколько лет назад 2,4-динитрофенол пытались использовать для борьбы с ожирением. На чем основывался этот выбор? Однако этот метод не нашел применения в практике, так как в некоторых случаях наступал летальный исход. Как это можно объяснить? ОТВЕТ: 2, 4 – ДНФ является синтетическим аналогом белка UCP1, который находится в мембранах митохондрий бурой жировой ткани и стимулирует в ней теплообразование – мобилизацию триглицеридов - их распад до жирных кислот. Разобщители повышают потребление кислорода и скорость переноса электронов по дыхательной цепи, но разобщают окисление и фосфорилирование. В результате образование АТФ резко снижается, что может вызвать смерть. ЗАДАЧА 16 Промежуточные продукты цитратного цикла могут использоваться для синтеза различных соединений. Какой из метаболитов должен быть в избытке, чтобы восполнить утечку промежуточных продуктов из цитратного цикла? Используя схему реакций цитратного цикла, укажите метаболиты ЦТК, обеспечивающие его пластические функции. ОТВЕТ: а) Пируват, тк убыль метаболитов восполняется за счет синтеза из него оксалоацетата СН3-СО-СООН+ СО2 + АТФ + Н2О = СООН-СО-СН2-СООН + АДФ + Н3РО4. (пируваткарбоксилаза) б) Анаболические функции: 1. Оксалоацетат → аспартат → аспарагин (АСТ, аспарагинсинтаза) Аминокислоты → оксалоацетат (ФЭПкарбоксикиназа) → ФЭП → глюконеогенез → глюкоза. 2. Цитрат → жирные кислоты Цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат (+HS-KoA). Реакция катализируется ферментом цитратсинтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы. В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат (+АДФ). Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата (необходим НАДН+Н). Последний при помощи дикарбоксилаттранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата (НАД), завершая тем самым так называемый челночный цикл. Цитрат → холестерол (из ацетил-КоА в цитозоле) 3. α-кетоглутарат → Глу, Глн, Про Альфа-кетоглутарат является переносчиком аммиака, участвует в реакциях трансаминирования. Из него можно получить глутамат при помощи аминотрансферазы. 4. Сукцинил-КоА → гем Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сукцинил-КоА - идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. ЗАДАЧА 17 У пациента выявлен генетический дефект пируваткарбоксилазы. К каким последствиям может привести такой дефект? Для ответа на этот вопрос: а  ) напишите реакцию, катализируемую указанным ферментом; ) напишите реакцию, катализируемую указанным ферментом;б) назовите метаболические пути, в которых участвует продукт этой реакции, приведите их схемы. ОТВЕТ: к гипогликемии натощак, нарушение глюконеогенеза а) синтез оксалоацетата из пирувата: СН3-СО-СООН+ СО2 + АТФ + Н2О = СООН-СО-СН2-СООН + АДФ + Н3РО4 б) Оксалоацетат → аспартат → аспарагин (АСТ, аспарагинсинтаза) Аминокислоты → оксалоацетат (ФЭПкарбоксикиназа) → ФЭП → глюконеогенез → глюкоза. Оксалоацетат → цикл Кребса → сукцинил-КоА → нарушение синтеза гема ЗАДАЧА 18 На дистанции два бегуна: спринтер завершает стометровку, стайер бежит 10-й километр. Укажите различия в энергетическом обеспечении работы мышц у этих бегунов. Приведите схемы метаболических путей, которые являются источником энергии у стайера и спринтера. ОТВЕТ: У спринтера происходит анаэробный гликолиз, так как невозможно другим путем так быстро обеспечить мышцы необходимым количеством кислорода. У стайера функционирует аэробный гликолиз, гликогенолиз, β-окисление жирных кислот. 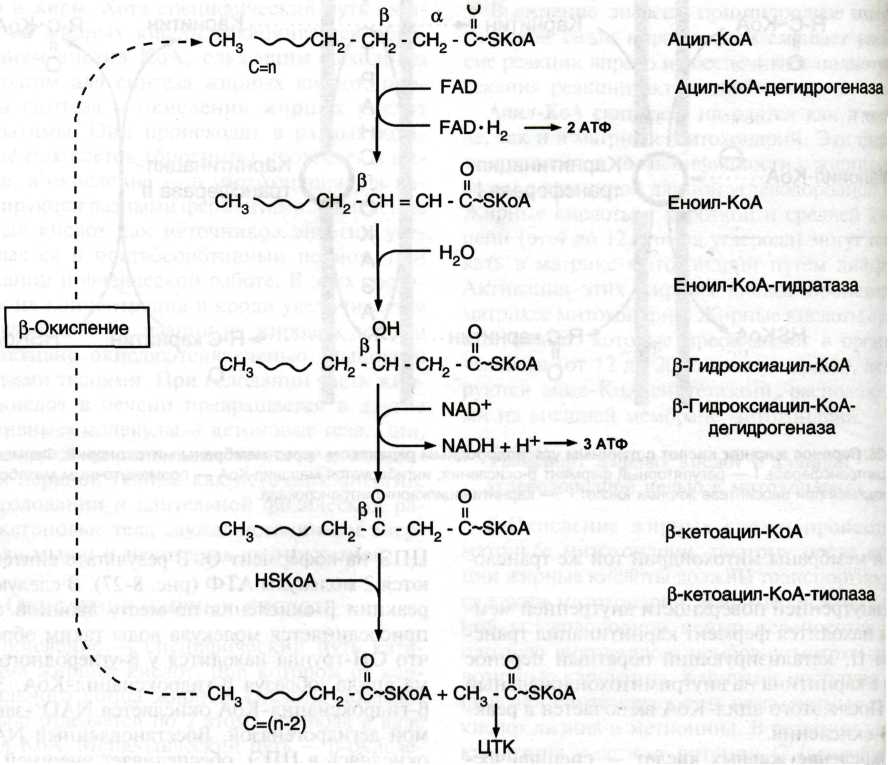 ФОРМУЛЫ НЕ ДИКТУЙ! ТОЛЬКО НАЗВАНИЯ РЯДОМ ЗАДАЧА 19 На экзамене у студента содержания глюкозы в крови оказалось равным 7 ммоль/л. Для объяснения этого результата: а) укажите содержание глюкозы в крови в норме; б) укажите, уровень какого гормона повышается в крови студента в данной ситуации и опишите механизм действия этого гормона; в) напишите схему процесса, повышения скорости которого приводит к изменению концентрации глюкозы в крови. ОТВЕТ: а) Концентрация глюкозы в норме: 3,3-5,5 ммоль/л (60-100 мг/дл) б) Повышается уровень адреналина (в печени через α1 и β2 – адренорецепторы) 1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6 — протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс α-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются. в) Распад гликогена в печени: Важно, что в печени есть фермент глюкозо-6-фосфатаза, который превращает глюкозо-6-фосфат в глюкозу, которая идёт в кровь. В мышцах данного фермента нет, поэтому глюкозо-6-фосфат идёт в гликолиз. 1. Гликогенфосфорилаза расщепляет α-1,4-гликозидные связи. Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. 2. Три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы * на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. 3. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы* в виде свободной глюкозы, после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. ЗАДАЧА 20 У мальчика 4 лет снижена способность к выполнению физической работы. При исследовании биоптата мышц обнаружено, что концентрация карнитина в ткани меньше нормы в 4 раза. В цитозоле клеток мышц обнаружены вакуоли жира. Каковы возможные причины такого состояния? Для ответа на вопрос: а) приведите схему метаболического пути, который нарушен у пациента; б) объясните роль карнитина в этом процессе. ОТВЕТ: У мальчика нарушен перенос жирных кислот через мембрану митохондрий, а следовательно, замедляется. - т.к. у ребенка количество карнитина снижено, то и окисление жирных кислот в мышцах происходит очень медленно, и они накапливаются в вакуолях миоцитов. а) β-окисление жирных кислот активация ВЖК на наружной поверхности мембраны митохондрий при участии АТФ, НS-КоА и ионов магния с образованием активной формы ВЖК (ацил-КоА). транспорт жирных кислот внутрь митохондрий при присоединении активной формы жирной кислоты к карнитину, находящемуся на наружной поверхности внутренней мембраны митохондрий. Образуется ацил-карнитин, обладающий способностью проходить через мембрану. На внутренней поверхности комплекс распадается и карнитин возвращается на наружную поверхность мембраны. внутримитохондриальное окисление жирных кислот из последовательных ферментативных реакций. В результате одного завершенного цикла окисления происходит отщепление от жирной кислоты одной молекулы ацетил-КоА, т.е. укорочение жирнокислотной цепи на два углеродных атома. При этом в результате двух дегидрогеназных реакций восстанавливается ФАД до ФАДН2 и НАД+ до НАДН2. Окисление ВЖК будет происходить циклически одинаково, но только до последней стадии - стадии превращения масляной кислоты (БУТИРИЛ-КОА), которая имеет свои особенности, которые необходимо учитывать при подсчёте суммарного энергетического эффекта окисления ВЖК, когда в результате одного цикла образуется 2 молекулы АЦЕТИЛ-КОА, одна из них проходила бета-окисление с выделением 5АТФ, а другая нет. б) карнитин является переносчиком высших жирных кислот в митохондрии. ЗАДАЧА 21 Некоторые лекарственные препараты – кофеин и теофиллин - угнетают действие фермента фосфодиэстеразы. Как может измениться количество жирных кислот в крови при введении этих препаратов? Для этого ответьте: а) как изменится количество цАМФ в клетке? б) какие гормоны контролируют этот процесс? в) на схеме действия гормонов укажите место действия этих препаратов. ОТВЕТ: а) увеличится (угнетение фермента, катализирующего реакцию превращения цАМФ в обычную АМФ) б) Адреналин и глюкагон стимулируют через аденилатциклазу синтез цАМФ. В свою очередь цАМФ активирует соответствующую протеинкиназу, которая способствует фосфорилированию липазы, т.е. образованию ее активной формы. Если в клетке длительное время повышена концентрация цАМФ (повышена активность протеинкиназы А), может происходить фосфорилирование кальциевых каналов, что приводит к повышению концентрации Са2+ в клетке. Кальций активирует Са2+-зависимую фосфодиэстеразу, катализирующую превращение цАМФ в АМФ. В результате инактивации протеинкиназы А (R2C2) снижается скорость фосфорилирования специфических ферментов. Завершает "выключение" системы фосфопротеинфосфатаза, дефосфорилирующая фосфопротеины. в) Алкалоид кофеин ингибирует фосфодиэстеразу, которая превращает цАМФ в АМФ, следовательно, увеличенная концентрация цАМФ сохраняется, увеличенная активность ПКА сохраняется, повышается скорость мобилизации жирных кислот, повышается концентрация их неэтерифицированных форм в крови. ЗАДАЧА 22 У больных гиперлипопротеинемией I типа сыворотка крови имеет «молочный» вид, при хранении сыворотки при 4С на ее поверхности появляются жирные хлопья. Объясните наблюдаемое явление. Для этого: а) назовите липопротеидную фракцию, увеличение содержания которой приводит к наблюдаемому эффекту. б) укажите дефектный фермент и катализируемую им реакцию; в) перечислите рекомендации по питанию, которые необходимо дать больному. ОТВЕТ: а) На поверхности сыворотки больного гиперлипопротеинемией I типа при стоянии на холоде всплывают белые жирные хлопья, представляющие собой хиломикроны. б) возможные причины: Изменение конформации апо СII (С-II - активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови) Не работает ЛП-липаза (расщепляет тригилицериды хиломикронов и ЛПОНП) Нарушение переноса апо СII с ЛПВП на хиломикроны в) ограничение поступления жиров с пищей, основная калорийность на 1 половину дня, частое питание. ЗАДАЧА 23 У пациента с подозрением на инфаркт миокарда определяли активность аланин- (АЛТ) и аспартатаминотрансферазы (АСТ) в крови. Активность какой аминотрансферазы наиболее увеличится при такой патологии и почему? Назовите другие ферменты, активность которых определяют в крови для подтверждения указанной патологии. ОТВЕТ: Диагностическое значение имеет анализ активности аланинаминотрансферазы АЛТ, аспартатаминотрансферазы АСТ, лактатдегидрогеназы ЛДГ и ее изоферментов (ЛДГ 1-5), креатинфосфокиназы КФК и ее изофермента MB. Коэффициент де Ритиса - отношение ACT/АЛТ, в норме равное 1,33, при заболеваниях печени - ниже этой величины, а при заболеваниях сердца - выше. Нормы АСТ: В крови – 20 ед В печени – 44000 ед В миокарде – 150000 ед При инфаркте миокарда уровень АСТ в крови через 3-5 часов повышается до 300-500 ед Нормы АЛТ: В крови – 15 ед В печени – 140000 ед В миокарде – 7000 ед Увеличение уровня в анализе АЛТ наблюдается при инфаркте миокарда, так как этот фермент содержится и в сердечной мышце, однако его повышение по сравнению с АСТ незначительно, поскольку активность АЛТ в кардиомиоцитах в отличие от АСТ - низкая. При неосложненных инфарктах миокарда уровни в анализе крови АЛТ (АЛАТ) остаются в пределах нормы или наблюдается их слабое увеличение. В норме активность ЛДГ составляет 250 ЕД/л. При инфаркте миокарда наблюдается повышение активности ЛДГ1 и ЛДГ2 Нормы креатинкиназы МВ в крови — 0—24 Ед/л. При инфаркте миокарда наблюдается повышение активности МВ-изоформы |
