1. Аналитическая химия и химический анализ. Основные понятия аналитической химии: метод анализа вещества, качественный химически. Аналитическая химия и химический анализ. Основные понятия аналитической химии метод анализа вещества, качественный химический анализ, количественный химический анализ
 Скачать 413.8 Kb. Скачать 413.8 Kb.
|
|
Аналитическая химия и химический анализ. Основные понятия аналитической химии: метод анализа вещества, качественный химический анализ, количественный химический анализ. Аналитическая химия – наука, целью которой является идентификация, обнаружение, разделение и определение химических элементов и их соединений, а также установление химического состава вещества. Химический анализ – это определение состава материала с помощью методов, основанных на химических реакциях определяемых веществ в растворах. Под методом анализа понимают достаточно универсальный и теоретически обоснованный способ определения состава вещества безосновательно к определяемому компоненту и к анализируемому объекту. По своей природе методы анализа делятся на химические, физико-химические, физические и биологические. К химическим методам относятся классические методы аналитической химии – гравиметрия и титриметрия. К физико-химическим методам обычно относят оптические и электрохимические методы, в то время как к физическим методам причисляют методы, основанные на физических принципах исследования вещества и обычно не требующие предварительной химической пробоподготовки. Биологические методы базируются на фиксации реакции живых организмов, отдельных органов, клеток, клеточных структур и т.п. на присутствие того или иного химического вещества и его количества. Различают качественный и количественный анализ. Качественный анализ решает вопрос о том, какие компоненты включает анализируемый объект, количественный – определяет количественное содержание всех или некоторых компонентов. Основные разделы современной аналитической химии. Применение методов аналитической химии в фармации. Фармацевтический анализ. Фармакопейные методы. Современная аналитическая химия включает три раздела: качественный химический анализ; количественный химический анализ; инструментальные методы анализа. Выделение инструментальных методов в отдельный раздел аналитической химии достаточно условно, так как инструментальные методы служат для решения задач как качественного, так и количественного анализа. Качественный химический анализ – это обнаружение химических элементов, ионов, атомов, функциональных групп, молекул в анализируемом веществе. Количественный химический анализ – это определение количественного состава вещества. Результат количественного анализа обычно представляют в виде концентрации определяемых веществ в виде границ доверительного интервала. Инструментальные методы анализа основаны на использовании зависимости между измеряемым физическим свойством вещества и его качественным и количественным составом. Фармацевтический анализ – направление фармацевтической химии, основной задачей которого является оценка качества лекарственных средств (ЛС) на всех этапах жизненного цикла от создания и регистрации ЛС до их применения и утилизации непригодных по тем или иным причинам к медицинскому использованию. Составной частью фармацевтического анализа является фармакопейный анализ, который представляет собой совокупность способов исследования ЛС и лекарственных форм, изложенных в Государственной фармакопее, фармакопейных статьях и другой нормативной документации, используемых в оценке качества ЛС. Фармакопейный анализ любого ЛС независимо от его происхождения включает два направления экспертизы: применение общих методов исследования, которые присущи подавляющему числу ЛС, например, температура плавления, растворимость, испытания на допустимые пределы или отсутствие так называемых общих примесей, установление спектральных характеристик, в основе которых лежат общие теоретические положения и практические приемы, унифицированные реакции на катионы и анионы, входящие в структуру ЛС, методы определения количественного содержания; другую часть испытаний ЛС при контроле качества составляют специальные приемы и методы, определяемые особенностью их природы и строения. Аналитические признаки веществ и аналитические реакции. Типы аналитических реакций и реагентов. Характеристика чувствительности аналитических реакций (предел обнаружения, показатель чувствительности). При проведении и описании результатов качественного анализа используют аналитические признаки веществ и аналитические реакции. Аналитические признаки – такие свойства анализируемого вещества или продуктов его превращения, которые позволяют судить о наличии в нем тех или иных компонентов. Характерные аналитические признаки – цвет, запах, осадок и т.д. Аналитическая реакция – химическое превращение анализируемого вещества при действии аналитического реагента с образованием продуктов с заметными аналитическими признаками. В качестве аналитических реакций чаще всего используют реакции образования окрашенных соединений, газов, выделение или растворение осадков, образование кристаллов характерной формы, окрашивание пламени газовой горелки и др. Чувствительность аналитических реакций определяет возможность обнаружения вещества (ионов, молекул) в растворе. Она характеризуется предельным разбавлением, предельной концентрацией, минимальным объемом предельно разбавленного раствора, пределом обнаружения (открываемым минимумом), показателем чувствительности. Предельное разбавление – максимальный объем раствора, в котором может быть однозначно (больше чем в 50% опытов) обнаружен один грамм данного вещества при помощи данной аналитической реакции. Предельная концентрация – наименьшая концентрация, при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакцией. Минимальный объем предельно разбавленного раствора – наименьший объем анализируемого раствора, необходимый для обнаружения открываемого вещества данной аналитической реакцией. Предел обнаружения (открываемый минимум) – наименьшее содержание определяемого компонента, которое можно обнаружить в образце с заданной вероятностью. Предел обнаружения характеризует чувствительность метода. Аналитическая реакция тем чувствительнее, чем меньше ее открываемый минимум, минимальный объем предельно разбавленного раствора и чем больше предельное разбавление. Чувствительность аналитической реакции зависит от природы открываемого вещества и аналитического реагента, температуры, рН среды, присутствия других (особенно – мешающих) веществ. Стадии аналитического процесса. Подготовка образца к анализу. Средняя проба. Отбор средней пробы жидкости, твердого тела (однородного и неоднородного вещества). Массы пробы. Основными стадиями аналитического процесса являются: отбор пробы; подготовка пробы; измерение аналитического сигнала; обработка результатов измерений. Перед исследованием вещество предварительно подготавливают к анализу. К числу, таких подготовительных операций относятся: 1) отбор средней пробы; 2) приготовление вещества для взвешивания; 3) взвешивание вещества; 4) приготовление раствора для анализа. Средняя проба – это небольшая представительная часть вещества, состав и свойства которой идентичны составу и свойствам всей массы анализируемого вещества. Отбор средней пробы преследует своей целью получить относительно небольшое количество исходного вещества, в котором количественное содержание всех компонентов должно быть равно количественному содержанию их во всей массе анализируемого вещества. Отбор пробы жидкости. Перед отбором пробы жидкость тщательно перемешивают, после чего отбирают часть ее, необходимую для проведения анализа. Отбор пробы твердого вещества. Перед отбором пробы твердого вещества проводят предварительное визуальное исследование анализируемого материала для определения его цвета, степени однородности, вероятного числа составляющих компонентов, формы и величины частиц и т.д. При этом используют лупу, микроскоп и др. приборы. Отбор пробы однородного твердого вещества. Твердое вещество однородно, если оно состоит из частиц, одинаковых по размеру и химическому составу. В этом случае отбирают часть анализируемого вещества, измельчают его (в ступке или на шаровой мельнице), растирая в однородный порошок, и подвергают анализу. Отбор пробы неоднородного твердого вещества. Твердое вещество неоднородно, если оно состоит из частиц, различных по размерам и химическому составу (типичный пример – почва). В этом случае отбор пробы включает три последовательные операции: измельчение анализируемого материала, просеивание измельченных частиц через сита с определенными размерами отверстий и деление полученного порошка на части, из которых отбирается масса вещества, необходимая для проведения анализа. Масса пробы или аналитической навески определяется природой анализируемого материала и выбранным методом анализа. Подготовка образца к анализу. Растворение пробы (в воде, в водных растворах кислот, в других растворителях). Для проведения анализа твердую пробу обычно растворяют в подходящем растворителе: в воде, в водных растворах кислот, в органических растворителях, в растворах, содержащих комплексообразующие компоненты, и т.д. Вначале проверяют растворимость пробы в дистиллированной воде при комнатной температуре, затем – при нагревании. При этом выясняют, растворяется ли проба в воде полностью или частично. Если проба не растворяется в воде, то испытывают ее растворимость в водных растворах разбавленных и концентрированных кислот: в уксусной СН3СООН, хлористоводородной НСl, азотной НNО3, серной H2SО4 и т.д. Если вещество не растворяется ни в разбавленных, ни в концентрированных кислотах, то испытывают его растворимость в царской водке – смеси концентрированных азотной и хлористоводородной кислот. При необходимости проверяют растворимость пробы в подходящих органических растворителях или в растворах, содержащих различные реагенты. Если твердая проба не растворяется ни в одном из использованных растворителей, то в ряде случаев ее переводят в растворимое состояние обработкой при нагревании насыщенными растворами соды Na2CО3, поташа К2СО3 или же сплавлением части пробы с этими солями, гидросульфатами щелочных металлов (NaHSО4), пиросульфатом калия К2S2О7 с щелочами и другими веществами. Некоторые положения теории растворов электролитов. Сильные и слабые электролиты. Общая концентрация и активность ионов в растворе. По способности к диссоциации электролиты разделяют на сильные и слабые. Сильные электролиты (большинство солей; кислоты – HNO3, HCl, HBr, HI, HSCN, H2SO4, HClO4, HMnO4 и др.; основания – все щелочи, Ca(OH)2, Ba(OH)2) практически полностью распадаются на ионы. Слабые электролиты (кислоты, основания, внутренняя сфера комплексных соединений) в растворах диссоциированы частично. Основной количественной характеристикой раствора является концентрация, которая отражает содержание растворенных веществ в единице массы, единицы объема раствора или растворителя. Общая концентрация ионов в растворе - молярная концентрация растворенного электролита с учетом его степени диссоциации на ионы и числа ионов, на которые диссоциирует молекула электроплита в растворе. Для сильных электролитов α = 1, поэтому общая концентрация ионов определяется молярной концентрацией электролита и числом ионов, на которые распадается молекула сильного электролита в растворе. Чтобы использовать для реальных растворов общие термодинамические уравнения, справедливые для идеальных систем, американский физико-химик Г. Н. Льюис (1875 - 1946) предложил в 1907 г. метод активностей. Согласно указанному методу, в эти уравнения вводят некие числа вместо концентраций (отличающиеся по величине от числового значения концентраций) так, чтобы количественные результаты, полученные после решения этих уравнений, совпадали с экспериментально определяемыми величинами. Такие числа называются «активностью». Активность ионов а в растворе - это величина, подстановка которой вместо общей концентрации в термодинамические уравнения, описывающие свойства идеальных растворов, дает соответствующие опыту значения рассчитываемых величин для реальных растворов. Некоторые положения теории растворов электролитов. Характеристика рН водных растворов электролитов. Водные растворы могут быть нейтральными, кислыми или щелочными. В кислых растворах содержится избыток ионов Н+, а в щелочных – избыток ионов ОН–. В нейтральных растворах количество этих ионов всегда одинаково и при этом чрезвычайно мало – по 10–7 моль/л каждого иона. В водных растворах концентрации ионов Н+ и ОН– взаимосвязаны выражением ионного произведения воды Кв = Кд*[H2O] = 1,8*10–16*55,49 = 10–14 [H+] * [OH–] = 10–14 В чистой воде или нейтральном растворе [H+] = [OH–] = 10–7 моль/л В кислой среде [H+] > 10–7, [OH–] < 10–7 В щелочной среде [H+] < 10–7, [OH–] > 10–7 Для расчета концентрации ионов Н+ или ОН– используют значение отрицательного логарифма, который называется водородным или гидроксильным показателем соответственно рН = –lg[H+] pOH = –lg[OH–] Так как [H+] * [OH–] = 10–14, то для водных растворов выполняется соотношение рН + рОН = 14 Применение закона действующих масс в аналитической химии. Химическое равновесие. Зависимость скорости реакции от концентраций реагирующих веществ получила название закона действующих масс: скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, взятые в степенях, соответствующих коэффициентам каждого вещества в уравнении реакции. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние химического равновесия. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ). При равновесии все количества веществ постоянны, поэтому возникает впечатление, что в системе ничего не происходит. На самом деле и прямая, и обратная реакции протекают одновременно и с одинаковой скоростью: сколько продуктов образуется за счет прямой реакции, столько же их расходуется в обратной реакции. Химическое равновесие имеет динамический характер. Состав равновесной смеси, состоящей из реагентов и продуктов, зависит от условий. Если в смеси продуктов больше, чем исходных веществ, то говорят, что равновесие смещено вправо, в сторону продуктов реакции. Если же в смеси преобладают исходные вещества, а продуктов мало, то считают, что равновесие смещено влево, то есть в сторону исходных веществ. Количественной характеристикой состояния химического равновесия служит константа равновесия. Она определяется через концентрации всех участников реакции в состоянии равновесия, т. е. через равновесные концентрации. Для обратимой реакции, протекающей в растворе или в газовой фазе aA + bB = cC + dD Константа равновесия равна произведению равновесных концентраций продуктов, деленному на произведение равновесных концентраций исходных веществ, при этом концентрация каждого вещества возводится в степень, равную коэффициенту при этом веществе в уравнении реакции. 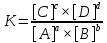 Вычисление значений рН растворов сильных кислот и оснований. Для количественной характеристики реакции среды раствора сильного электролита используется водородный показатель рН = –lga(H+), где а(Н+) – активность ионов водорода, определяется как а(Н+) = y (Н+)·[Н+], где [Н+] – равновесная молярная концентрация ионов Н+, y(Н+) – коэффициент активности ионов водорода, определяемый по правилу ионной силы/ Для расчета рН щелочей используют соотношение рН = 14 – рОН, где рОН = –lga(OH-). Общая характеристика комплексных (координационных) соединений металлов (комплексообразователь, лиганды, координационное число, внутренняя и внешняя сферы). Комплексные (координационные) соединения — соединения сложной структуры, в состав которых входят центральный атом (ком- плексообразователь) и связанные с ним ионы или нейтральные молекулы, называемые лигандами. Согласно координационной теории Вернера молекула комплексного соединения содержит центральный ион (чаще всего ион металла), называемый комплексообразователем. Он удерживает (координирует) в непосредственной близости некоторое число ионов с противоположным зарядом (или полярных молекул), называемых лигандами. Ион-комплексообразователь и лиганды составляют вместе так называемую внутреннюю координационную сферу. Комплекс может быть нейтральным, катионным (иметь положительный заряд) и анионным (иметь отрицательный заряд). Ионы или молекулы (например, вода), окружающие комплекс, составляют внешнюю сферу. В образовании химической связи во внутренней сфере комплексного соединения важнейшую роль играет донорно-акцепторное взаимодействие лигандов (доноры) и комплексообразователя (акцептор). При этом между ними возникает ковалентная и не сильно полярная связь. Именно этим объясняются главные особенности свойств внутренней сферы комплекса: строго определенное пространственное расположение лигандов вокруг комплексообразователя и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем. Число координационных связей, образуемых лигандами с комплексообразователем, называют координационным числом (КЧ). Различают характеристическое (ХКЧ) и максимальное координационное число (МКЧ). Характеристическое координационное число — число связей, образуемых лигандами определенного типа. Оно зависит от природы лиганда. Максимальное координационное число (МКЧ) — максимально возможное для данного комплексообразователя число связей, и оно не зависит от природы лиганда. |
