1. Аналитическая химия и химический анализ. Основные понятия аналитической химии: метод анализа вещества, качественный химически. Аналитическая химия и химический анализ. Основные понятия аналитической химии метод анализа вещества, качественный химический анализ, количественный химический анализ
 Скачать 413.8 Kb. Скачать 413.8 Kb.
|
|
Основные понятия гравиметрического анализа. Классификация методов гравиметрического анализа (метод осаждения, метод отгонки). Гравиметрическим анализом называют метод количественного химического анализа, который базируется на точном измерении массы определяемого вещества или его составных частей, выделенных в химически чистом состоянии или в виде соответствующих соединений (точно известного постоянного состава). Методы осаждения. В методах осаждения определяемый компонент количественно осаждают химическими способами в виде малорастворимого химического соединения строго определенного состава. Осадок, который выделяется, промывают, высушивают или прокаливают. При этом осадок в большинстве случаев превращается в новое вещество точно известного состава, которое и взвешивают на аналитических весах. В анализе различают: осаждаемую форму - форму, в виде которой осаждают определяемое вещество, и весовую форму - форму, в виде которой определяемое вещество взвешивают. Весовая форма (гравиметрическая) может иметь ту же формулу, что и осаждаемая форма. Методы отгонки. В методах отгонки определяемый компонент количественно отгоняют в виде летучего соединения. Определяемую часть отгоняют путем нагревания анализируемого вещества или действием соответствующих реагентов, которое сопровождается выделением летучих продуктов. Методы отгонки бывают прямые и косвенные. Прямые методы отгонки. Определяемый летучий компонент поглощают специфическим поглотителем и по увеличению массы последнего рассчитывают массу определяемого компонента. Косвенные методы отгонки. В косвенных методах определяют массу остатка вещества после полного удаление определяемого вещества. Разность массы до и после отгонки определяемого вещества дает возможность рассчитать количество определяемого компонента. Титриметрический анализ (титриметрия). Основные понятия (аликвота, титрант, титрование, точка эквивалентности, конечная точка титрования, индикатор, кривая титрования, скачок титрования). Титриметрический метод анализа является разделом количественного анализа, в котором содержание вещества определяется путем точного измерения объема раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом. Концентрация раствора титранта должна быть точно известна. Титрование — процесс постепенного порционного прибавления раствора реагента (титранта) к исследуемому раствору. Титрант — раствор с точно известной концентрацией реагента, взаимодействующего с исследуемым веществом. Аликвота — точно известный объем анализируемого раствора, взятый для анализа (часть исследуемого раствора). Точка эквивалентности (ТЭ) — момент титрования, когда прибавляемое растворенное вещество полностью прореагировало с растворенным веществом, находящимся в анализируемом (титруемом) растворе. Индикаторы — вещества, изменяющие окраску в точке эквивалентности или вблизи ее. Конечная точка титрования (КТТ) — момент титрования, в который происходит резкое изменение окраски индикатора, т. е. момент окончания титрования. Конечная точка титрования соответствует ТЭ, но часто с ней не совпадает. Кривые титрования отображают количественный ход титрования. Они позволяют быстро оценивать метод титрования. Скачок титрования – участок кривой титрования, на котором происходит резкое изменение наблюдаемого свойства системы Требования, предъявляемые к реакциям в титриметрии. Реактивы, применяемые в титриметрическом анализе, стандартные вещества, титранты. Первичные и вторичные стандарты. Требования к реакциям в титриметрии: строгая стехиометричность практически полная необратимость достаточно высокая скорость отсутствие побочных реакций наличие надежного способа установления конечной точки титрования Классификация химических реактивов: Технический – низшая категория качества. Содержание основного компонента около 70%. Чистый – вещества общего лабораторного назначения. Содержание основного компонента не менее 98%. Чистый для анализа – содержание основного компонента не менее 98%, а содержание примесей ограничено пределами, позволяющими применять реактив в аналитических целях. Химически чистый – реактивы для научных целей. Содержание основного компонента более 99%. Особо чистый – вещества специального назначения. Содержание основного компонента не менее 99,9%. Для приготовления растворов с точно известной концентрацией, применяемых в титриметрическом анализе, используют стандартные вещества (установочные вещества). Первичное стандартное вещество (первичный стандарт) - вещество высокой чистоты, которое применяется для установления концентрации титранта - для стандартизации титранта, в основе чего лежит стехиометричность их взаимодействия, или которое может быть использовано для приготовления раствора титранта с точно известной концентрацией. Вторичное стандартное вещество (вторичный стандарт) — вещество, содержание активного компонента в котором находят с помощью первичного стандарта. Типовые расчеты в титриметрическом анализе. Способы выражения концентраций в титриметрическом анализе (молярная концентрация, молярная концентрация эквивалента, титр). Молярная концентрация показывает, какое количество вещества (сколько моль) содержится в 1л раствора 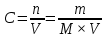 Молярная концентрация эквивалентов показывает, какое количество вещества эквивалентов содержится в 1л раствора 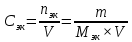 Титр раствора – это масса вещества, содержащегося в 1мл раствора 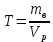 Классификация методов титриметрического анализа: кислотно-основное, окислительно-восстановительное, осадительное, комплексиметрическое и комплексонометрическое титрование. Методом кислотно-основного титрования (нейтрализации) определяют количество кислот (алкалиметрия) или оснований (ацидиметрия) в данном растворе, количество солей слабых кислот и слабых оснований, а также веществ, которые реагируют с этими солями. Методы окисления — восстановления основаны на использовании реакций окисления — восстановления элементов, способных переходить из низших степеней окисления в высшие, и наоборот, а также ионов и молекул, которые реагируют с окислителями или восстановителями, не подвергаясь непосредственному окислению или восстановлению. Метод осаждения. Основу метода составляет реакция с образованием осадка. Метод комплексометрия. В основе метода лежит реакция комплексообразования. Например: Если в качестве титранта используются комплексоны (трилон Б), то такой метод называется комплексонометрия. Определяющие вещества: катионы металлов. Виды (приемы) титрования (прямое, обратное, заместительное). Методы титрования (метод отдельных навесок, метод пипетирования). Методы установления конечной точки титрования (визуальные, инструментальные). Прямое титрование. Аналит непосредственно реагирует с титрантом. В прямом титровании используется один стандартный раствор, который обычно приливают по каплям к анализируемому раствору. Прямое титрование возможно, если между реагентом и аналитом протекает химическая реакция, отвечающая всем требованиям к аналитической реакции для титриметрии. Обратное титрование. Титруется не сам аналит, а остаток прореагировавшего с ним реактива. К раствору добавляют избыток раствора первого реагента, после чего не вступивший в реакцию остаток титруют раствором второго реагента. Таким образом, в обратном титровании требуется два стандартных раствора: основной и вспомогательный. Заместительное титрование. Вместо аналита титруют продукт его стехиометрической реакции со вспомогательным реагентом. К определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию, после чего образовавшийся в эквивалентном количестве продукт оттитровывают. Различают два способа титрования: пипетитрование и титрование отдельных навесок. Способ пипетитрования состоит в том, что навеску исходного или анализируемого вещества растворяют в мерной колбе, разбавляют водой до метки и тщательно перемешивают раствор. Пипеткой отбирают определенный объем раствора, содержащий часть раствора, как говорят аликвотную части навески и титруют. При способе титрования отдельных навесок переносят каждую из них в коническую колбу, растворяют в произвольном объеме воды и титруют целиком. Для установления конечной точки титрования используют различные способы: Инструментальный способ основан на прямом изменении какого-либо свойства раствора, связанного с содержанием аналита или титранта, например рН или электропроводность. Визуальные методы фиксирования КТТ разделяют на безиндикаторные и индикаторные. В безиндикаторных методах КТТ определяют с появлением или исчезновением окраски титранта или раствора. В индикаторных методам к анализируемой жидкой пробы добавляют индикатор, который придает ей определенную окраску, и дальше титруют до резкого изменения этой окраски. Кислотно-основное титрование. Сущность метода. Основные реакции и титранты метода. Типы кислотно-основного титрования (ацидиметрия, алкалиметрия). Применение кислотно-основного титрования в анализе лекарственных веществ. Кислотно-основное титрование – титриметрическое определение содержания кислот, щелочей, гидролизующихся солей в водном растворе, основанное на реакции нейтрализации и фиксировании точки эквивалентности при помощи рН-индикаторов. Н+ + ОН- = Н2О Сущность метода состоит в реакции передачи протона от титранта титруемому веществу или от титруемого вещества титранту. Рабочими растворами являются растворы сильных кислот (HCl, H2SO4, HNO3) и сильных оснований (NaOH, KOH) с концентрацией раствора от 0,05 до 1 нормальности. Принято различать два варианта кислотно-основного титрования: Ацидиметрия – определение содержания аналита путем титрования раствором кислоты. Алкалиметрия - определение содержания аналита путем титрования раствором щелочи. Кислотно-основное титрование нашло широкое применение в анализе лекарственных веществ, обладающих кислотными или основными свойствами. К ним относятся: неорганические и органические кислоты (аскорбиновая, никотиновая, борная, ацетилсалициловая) органические основания, проявляющие в водных или спиртовых средах кислотно-основные свойства натриевые соли слабых органических и неорганических кислот Возможность применения методов кислотно-основного титрования определяется константой диссоциации титруемого вещества или его концентрации в растворе. Индикаторы метода кислотно-основного титрования (одноцветные и двухцветные). Требования, предъявляемые к индикаторам. Интервал перехода окраски индикатора. Примеры типичных индикаторов кислотно-основного титрования. В методе нейтрализации наиболее употребимы следующие индикаторы: двухцветные: метиловый оранжевый, метиловый красный, лакмус одноцветные: фенолфталеин Индикаторы метода нейтрализации характеризуются, так называемым, интервалом перехода. Под этим понимают значение рН раствора, в пределах которых данный индикатор меняет свою окраску. Например, интервал перехода метилоранжевого наблюдается при рН от 3,1до 4,4. Это значит, что в тех растворах, в которых рН равно или меньше 3,1,индикатор имеет розовый цвет. Растворы же, рН которых равен или больше 4,4,окрашиваются индикатором в желтый цвет. Растворы, рН которых меньше 4,4, но больше 3,1,окрашиваются метилоранжевым в оранжевый цвет.
Требования, предъявляемые к индикаторам: Изменение окраски индикатора должно проходить в узком интервале рН. Окраска должна изменяться резко и близи точки стехиометричности. Окраска должна быть интенсивной. Изменение окраски должно быть обратимым. Количество рабочего раствора титранта, изменяющего окраску индикатора, должно быть небольшим, чтобы не искажались результаты анализа. Кривые кислотно-основного титрования. Внешний вид типичных кривых титрования сильной кислоты щелочью (и наоборот). Выбор индикаторов по кривой титрования. Изменение рН в процессе титрования можно изобразить в виде графической зависимости рН от объема добавленного титранта – кривой титрования. 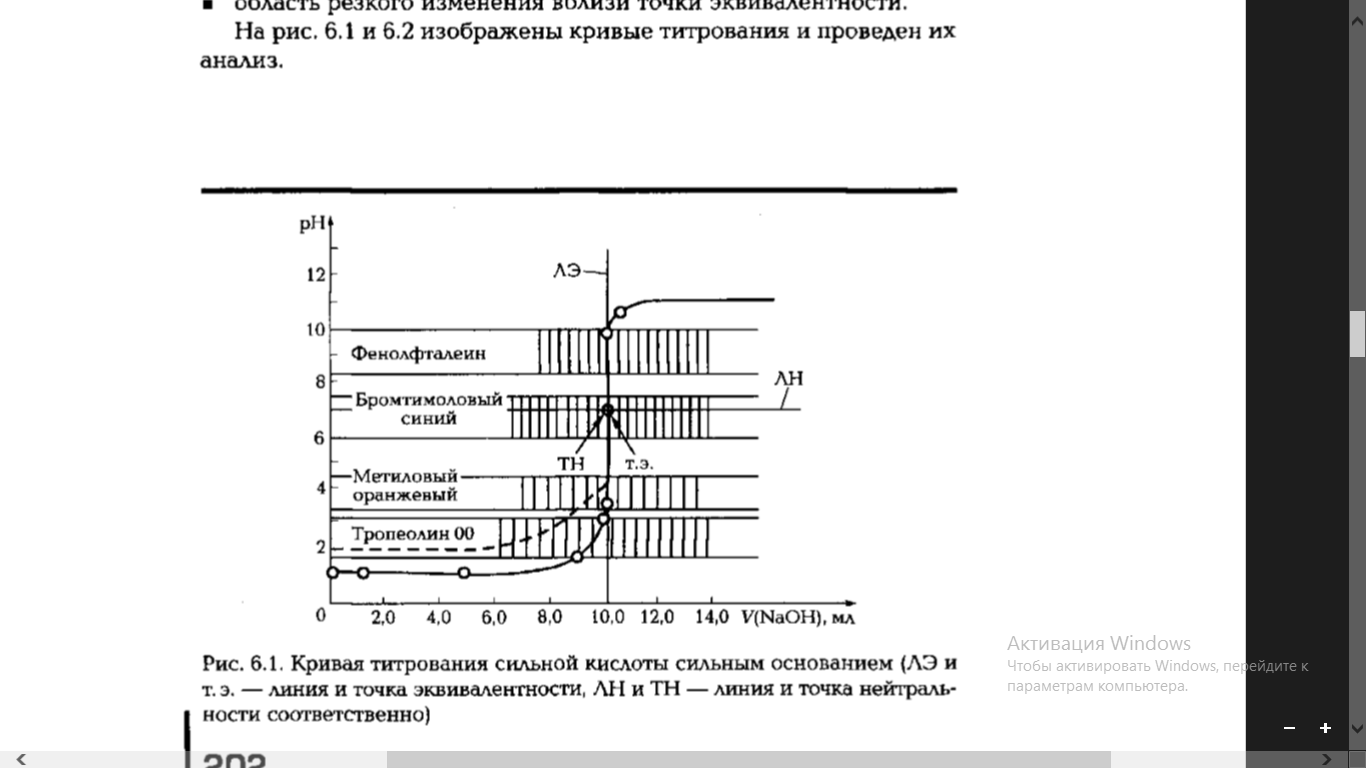 При титровании сильной кислоты сильным основанием начальная точка расположена в кислоты области, её положение определяется концентрацией титруемой сильной кислоты. Верхняя и нижняя ветви кривой достаточно слабо изменяются, пока оттитровано менее 90% кислоты или добавлен избыток основания более чем на 10%. Точка эквивалентности совпадает с точкой нейтральности, рН=7.  При титровании слабой кислоты сильным основанием начальная точка расположена в менее кислой области, чем при титровании сильной кислоты. Положение ветви кривой до точки перегиба не зависит от исходной концентрации слабой кислоты и разбавления при титровании. Точка эквивалентности лежит в щелочной области рН>7. Уменьшение кислоты и повышение ее концентрации приводят к еще большему смещению точки эквивалентности в эту область. С уменьшением силы и концентрации кислоты уменьшается величина скачка рН. При выборе индикаторы сначала вычисляют область рН раствора, в которой наблюдается скачок рН, а затем подбирают такой индикатор, у которого интервал перехода окраски совпадал бы с вычисленным скачком рН. Окислительно-восстановительное титрование. Сущность метода. Классификация редокс-методов. Условия проведения окислительно-восстановительного титрования. Требования, предъявляемые к реакциям. Методы окислительно-восстановительного титрования, или редокс-методы, основаны на использовании окислительно-восстановительных реакций. Редоксометрия – титрование, сопровождаемое переходом электронов от восстановителя (Red1) к окислителю (Ox2): Red1 + Ox2 = Ox1 + Red2 В любой окислительно-восстановительной реакции участвуют две редокс-пары. Чем выше потенциал редокс-пары, окисленная форма которой играет роль окислителя в данной реакции, тем более число восстановителей можно оттитровать. Классификация редокс-методов: По характеру титранта Оксидиметрия - методы определения восстановителей с применением титранта-окислителя. Редуктометрия - методы определения окислителей с применением титранта-восстановителя. По природе титранта Броматометрия (бромат калия KBrO3) Дихроматометрия (дихромат калия К2Сr2O7) Иодатометрия (иодат калия KIO3) Бромометрия (бром Br2) Иодиметрия (иод I2) Иодометия (иодид калия KI, тиосульфат натрия Na2S2O3) Нитритометрия (нитрит натрия NaNO2) Перманганатометрия (перманганат калия KMnO4) Требования, предъявляемые к реакциям: реакция должна протекать до конца и достаточно быстро; реакция должна протекать стехиометрически, побочные процессы должны быть исключены; конечная точка титрования должна определяться точно и однозначно либо с использованием индикаторов, либо без индикаторов. | |||||||||||||||||||||||||||||||||||||
