Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.22________________ ГЛАВА 7_______________________________________________________________________________
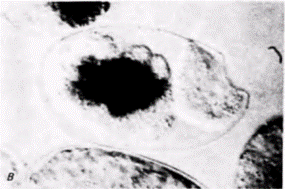
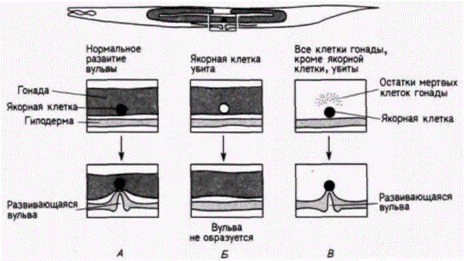
собны к формированию гамет (рис. 7.17). Используя связанные флуоресцирующие антитела к компонентам Р-гранул. Штром и Вуд (Strome. Wood. 1983) показали, что во время миграции пронуклеусов случайно рассеянные в цитоплазме Р-гранулы локализуются в заднем отделе зиготы (двигаясь к месту проникновения спермия) и попадают только в бластомер Р1, формирующийся из цитоплазмы, находящейся в этом отделе (рис. 7.18 и цветная таблица на внутренней стороне обложки книги). При последующем делении дробления Р-гранулы до начала митоза рассеиваются по всей цитоплазме бластомера P1, но во время митоза снова мигрируют к заднему концу клетки. Здесь они оказываются сосредоточенными в бластомере Р2. В конце концов Р-гранулы локализуются в бластомере Р4, потомки которого станут яйцами и спермиями взрослого животного. Для движения Р-гранул необходимы микрофиламенты, но оно может происходить вотсутствие микротрубочек. Обработка зиготы цитохалазином D (ингибитором образования микрофиламентов) предотвращала сегрегацию этих гранул на заднем конце клетки, тогда как демеколцин (сходный с колхицином ингибитор образования микротрубочек) не останавливал их движения (Strome. Wood. 1983). Достигнув заднего участка зиготы, Р-гранулы остаются там, даже если микрофиламенты после этого разрушаются (Hill, Strome. 1987). Механизмы движения Р-гранул и их прикрепления к микрофиламентам до сих пор неизвестны. Характер развития большинства клеток С. elegans является типично мозаичным: их судьба строго детерминирована внутренними цитоплазматическими факторами, а не взаимодействиями между соседними клетками Так, детерминанты для линии клеток, из которых образуется кишка, во время первого деления дробления локализованы в клетке P1, из которой позже образуется клетка предшественник кишки (клетка Е) (рис. 7.19: Laufer et al.. 1980; Edgar. McGhee. 1986). Однако, как и у оболочников, у нематод сохраняется некоторая возможность клеточных взаимодействий. Кимбл (Kimble. 1981) использовал пучок лазерных лучей, чтобы избирательно убить специфические клетки, потомки которых формируют вульву (проход, через который происходит откладка яиц). Одна из клеток в этой области становится якорной клеткой, соединяющей лежащую над ней гонаду с вульвой. Если эту клетку разрушить, то гиподермальные (кожные) клетки не делятся и не образуют вульву. Однако, пока якорная клетка находится вблизи гиподермы, вульва формируется. Это свидетельствует о том. что якорная клетка индуцирует образование вульвы (рис. 7 20). Кроме того, шесть клеток-предшественников вульвы под влиянием якорной клетки формируют эквивалентную группу В процессе нормального развития три центральные клетки этой группы делятся, образуя вульву, тогда как из трех других клеток образуются шесть гиподермальных клеток. (Если якорная клетка разрушена, то все шесть клеток эквивалентной группы делятся один раз. в результате чего возникают 12 гиподермальных клеток.) Если разрушить три центральные клетки, то три другие клетки, которые в норме образуют гиподерму, дадут начало клеткам вульвы. Таким образом, как мы уже видели на примере оболочников и улиток, явления регуляции и индукции до некоторой степени встречаются и у организмов, эмбриональное развитие которых жестко детерминировано. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ________________ 23
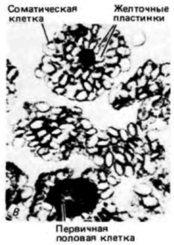
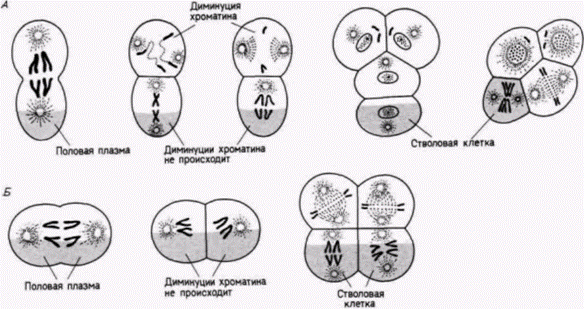
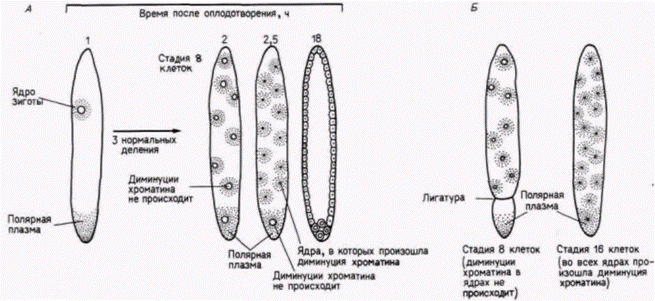
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.24________________ ГЛАВА 7_______________________________________________________________________________ Цитоплазматическая локализация детерминантов половых клетокЛокализованные в цитоплазме детерминанты обнаружены во всем животном царстве. Наиболее часто встречающиеся детерминанты - это те, которые ответственны за детерминацию предшественников половых клеток, т.е. клеток, потомки которых дают начало гаметам. Даже у многих зародышей, раннее развитие которых является в основном регуляционным, клетки, содержащие определенные участки цитоплазмы, предназначены стать предшественниками половых клеток. Детерминация половых клеток у нематодТеодор Бовери (1862-1915) был первым ученым, наблюдавшим поведение хромосом в процессе эмбриогенеза. Изучая развитие аскариды Parascarisaequorum (ее прежнее название Ascaris megalocephala), он обнаружил любопытные особенности. Эта нематода имеет всего две хромосомы в гаплоидной клетке, что позволяет проводить летальные наблюдения над индивидуальными хромосомами. Плоскость первого деления дробления у этого животного необычна тем, что проходит по экватору, разделяя яйцо на два бластомера анимальный и вегетативный (рис. 7.21. А). Однако еще более странным оказалось поведение хромосом во время последующего деления этих двух первых бластомеров. Непосредственно перед следующим делением анимального бластомера концы его хромосом распадаются на десятки фрагментов. Не все фрагменты включаются затем в хромосомы образующихся ядер. В результате клетки утрачивают огромное число генов (Tobler et. al.. 1972). Это явление называется элиминацией хромосом или диминуцией хроматина. Между тем в вегетативном бластомере диминуции хроматина не происходит. Во время второго деления анимальная клетка делится меридионально, тогда как вегетативная клетка опять экваториально. Обе клетки, происходящие из вегетативного бластомера. имеют нормальные хромосомы. Однако перед третьим делением хромосомы одного из двух вегетативных бластомеров. расположенного более анимально, фрагментируются. Таким образом, на 4-клеточной стадии только одна клетка, занимающая наиболее вегетативное положение, содержит полный набор генов. В течение последующих делений вплоть до 16-клеточной стадии происходит разделение линии соматических клеток, в которых произошла диминуция хроматина, и только в двух клетках хроматин не подвергся диминуции. Один из этих двух бластомеров дает начало первич-
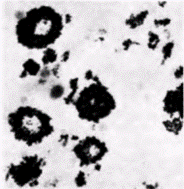
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ 25 ным половым клеткам: в другом в конечном итоге также происходит диминуция хроматина и из него формируются соматические клетки. Хромосомы сохраняются интактными только в тех клетках. которым предназначено формировать линии половых клеток. В противном случае количество генетической информации должно было бы уменьшаться в каждом последующем поколении. Клетки, в которых происходит диминуция хроматина, дают начало соматическим клеткам. Бовери называли последним великим наблюдателем в эмбриологии и первым из великих экспериментаторов (Шпеман и Вильсон посвятили ему свои главные книги) Не довольствуясь одним наблюдением того, что полный набор хромосом сохраняется лишь в половых клетках. Бовери решил проверить, не защищает ли хроматин от диминуции цитоплазма этой специфической области. Если такое предположение правильно, то любое ядро, попавшее в эту область, должно оказаться под ее зашитой. С целью проверки своей гипотезы Бовери (1910) центрифугировал яйца Parascaris незадолго до первого деления дробления. Эта процедура вызывала изменение ориентации митотического веретена. Если веретено формировалось перпендикулярно к его нормальной ориентации, то оба образовавшихся затем бластомера должны были содержать некоторое количество вегетативной цитоплазмы (рис. 7.21. Б). И действительно. Бовери обнаружил, что после первого деления ни в одном из ядер не происходило диминуции хроматина. Однако следующее деление было экваториальным по анимально-вегетативной оси. В двух возникших в результате деления анимальных бластомерах произошла диминуция хроматина, тогда как в двух вегетативных клетках ее не было. Исходя из этого, Бовери пришел к выводу, что вегетативная цитоплазма содержит фактор (или факторы), который защищает ядра от диминуции хроматина и детерминирует судьбу этих клеток, предназначая их для образования половых клеток. Детерминация половых клеток у насекомыхЯйца некоторых насекомых также содержат зародышевую плазму, функция которой, по-видимому, очень сходна с функцией зародышевой плазмы у Parascaris. У галлицы Wuchtiellapersicariaeбольшая часть ядер утрачивает 32 из 40 исходных хромосом! Однако на заднем полюсе яйца находятся два ядра, в которых не происходит диминуции хроматина и которые в течение некоторого времени не делятся (рис. 7.22). Потомки этих двух ядер в конечном счете включаются в первичные половые
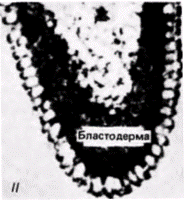
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.26________________ ГЛАВА 7______________________________________________________________________________
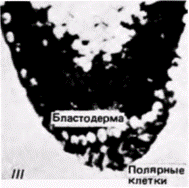
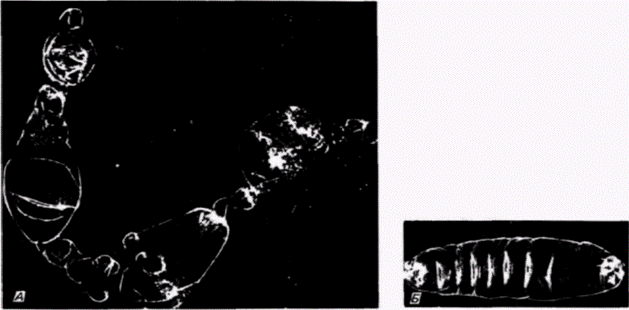
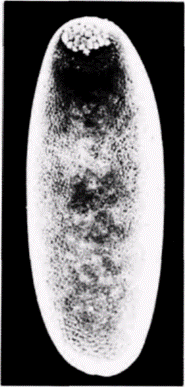
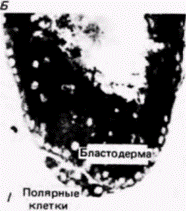
клетки1. Если препятствуют миграции этих ядер в область заднего полюса путем наложения лигатуры, тο в каждом ядре происходит диминуция хроматина и возникающая из такого яйца галлица оказывается стерильной Если ослабить лигатуру и позволить таким ядрам переместиться в область заднего полюса, то первичные половые клетки образуются, но они никогда не становятся функциональными гаметами (Geyer-Duszynska. 1959). Было показано (Kunz et al.. 1970), что элиминированный хроматин содержит гены, являющиеся активными в период образования первичных половых клеток. Герминативная цитоплазма насекомых отличается от любой другой цитоплазмы яйца. Хегнер (Hegner, 1911) обнаружил, что при удалении или разрушении этой области до формирования клеток на заднем полюсе яиц некоторых жуков зародыши, развившиеся из таких яиц, не имеют половых клеток и оказываются стерильными. Очень удачно, что эта задняя полярная плазма маркирована полярными гранулами (рис. 7.23). Роль этих гранул в детерминации половых клеток неизвестна, однако их постоянная связь с полярной плазмой и с происходящими из нее полярными клетками делает полярные гранулы удобными маркерами этой области яйца. Данную область полярных клеток легко идентифицировать с помощью сканирующего электронного микроскопа (рис. 7.24). Современные исследования полярной цитоплазмы проводятся преимущественно на зародышах дрозофилы. В течение первых двух часов после оплодотворения зародыш дрозофилы развивается как синцитий. Иными словами, происходит только деление ядер без соответствующего деления цитоплазмы. В результате формируется слой неклеточной синцитиальной бластодермы, содержащий около 3500 ядер. Каждое ядро окружается клеточной мембраной, и бластодермальный слой становится клеточной бластодермой. Опыты по трансплантации (Zalokar. 1971; Illmensee. 1968. 1972) показали, что все ядра синцития эквивалентны и тотипотентны. Однако клетки в клеточной бластодерме строго детерминированы. К сходному заключению пришли и другие исследователи (Schubiger. Wood. 1977). которые накладывали лигатуры на яйца дрозофилы, находящиеся на разных стадиях развития. В ядрах дрозофилы диминуции хроматина не происходит и ядро синцитиальной стадии может дать начало либо первичным половым, либо соматическим клет- 1 Пример галлицы и Parascarisвыглядит как очень убедительное доказательство в пользу гипотезы Вейсмана о сегрегации ядерных детерминантов (которая обсуждается в гл. 8). Эти случаи диминуции хроматина и элиминации хромосом являются исключениями из общего правила (гл. 9 и 10), поскольку обычно в ядрах дифференцированных клеток сохраняются неиспользуемые гены; мы не располагаем данными о том, что в различных соматических клетках Wachtiella или Parascarisсохраняются разные части их генома. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ___________ 27
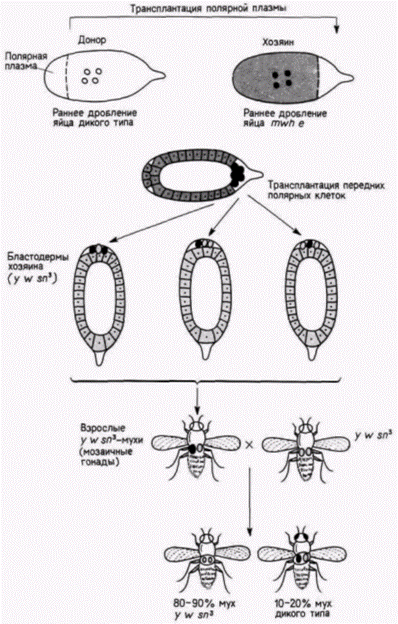
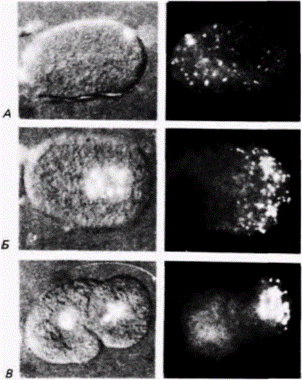
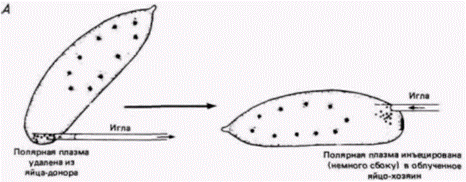
кам. Их детерминация зависит от области яйца. в которую они мигрируют. Одной из этих областей является задняя полярная плазма. Таким образом, полярная плазма, по-видимому, содержит морфогенетические детерминанты для образования половых клеток. Было обнаружено (Geigy, 1931), что облучение полярной плазмы ультрафиолетом приводит к стерильности мух. развившихся из облученных яиц, a Окада и др. (Okada et al.. 1974). продолжившие эту линию исследований, показали, что введение полярной плазмы из необлученных зародышей-доноров в облученные яйца устраняет их стерильность (рис. 7.25). Введение любой другой части цитоплазмы в их опытах не приводило к такому результату. В том же, 1974 г. автономность этой цитоплазматической области и ее способность детерминировать любое ядро дрозофилы была доказана остроумными опытами Илменси и Мэховалда (lllmensee, Mahowald, 1974). В этих опытах (рис. 7.26) неправдоподобно малое количество (5-100 пиколитров) энуклеированной полярной плазмы было перенесено из яиц дрозофилы дикого типа (донор) в область переднего полюса генетически маркированных яиц (хозяин) до их целлюляризации. (Эти яйца хозяина несли хромосомные мутации multiplewinghair (mwhи ebony (e).) После формирования клеточной бластодермы клетки переднего полюса зародыша-хозяина напоминали нормальные полярные клетки заднего полюса, содержали включенные в них полярные гранулы и их морфология была типичной для нормальных полярных клеток. Чтобы проверить, станут ли эти клетки предшественниками функциональных половых клеток, Мэховалд и Илменси трансплантировали модифицированные клетки переднего полюса в заднюю область дробящихся зародышей, содержащих свои собственные генети- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.28 ГЛАВА 7
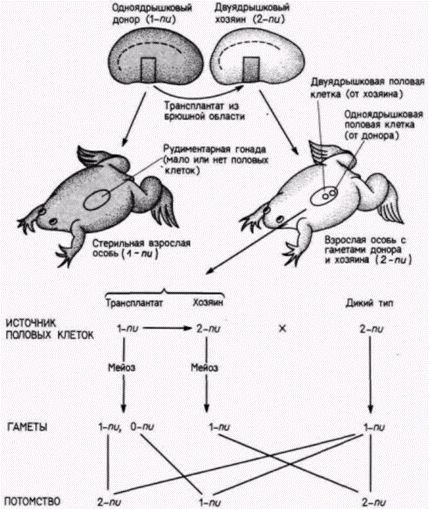
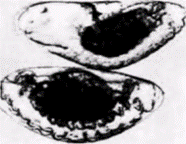
чески маркированные полярные клетки1. Эти новые зародыши-хозяева были маркированы по другим мутациям рецессивным yellow (y), while(w) и sinqed (sn3). Все мухи, развившиеся из таких зародышей, несли мутации yellow, whiteи singed. Этих мух скрестили с другими мухами, несущими такие же мутации. В большинстве случаев (88 из 92 скрещиваний) в потомстве появились особи, идентичные обоим родителям. Однако в четырех случаях возникли потомки дикого типа. Их появление указывало на то. что некоторые половые клетки у этих мух произошли из трансплантированных клеток, следовательно, половая плазма одного зародыша была способна побудить ядра клеток в области переднего полюса другого зародыша детерминировать развитие функциональных половых клеток! Использован- 1 Это было сделано для того, чтобы дать им возможность включиться в развивающуюся гонаду. Имеются данные, полученные на других организмах, о том. что полярная плазма содержит также детерминанты для соответствующей миграции половых клеток в гонады (Züst, Dixon, 1977; Ikenishi, Kotani, 1979). Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ_________________ 29 ная методика оказалась также полезной для установления времени локализации этого детерминанта. Илменси и др (Illmensee et al.. 1976) обнаружили, что детерминант первичных половых клеток способен функционировать до оплодотворения и локализуется в развивающемся ооците примерно в то же самое время, когда желток достигает его заднего конца. Сама природа предоставляет в наше распоряжение свидетельства о значении полярной плазмы и полярных гранул для развития половых клеток. Самка дрозофилы, гомозиготная по мутации qrand-childless, продуцирует фенотипически нормальное, но стерильное потомство [GG (самец) х дд (самка) Gg(стерильны)]. Мэховалд и др. (Mahowald et al., 1979) показали, что если таких самок спарить с нормальными самцами, то ядра зародышей, получившихся в результате скрещивания, никогда не мигрируют в полярную плазму яйца. У этих зародышей полярные клетки не образуются, а у получившихся взрослых особей нет первичных половых клеток, из которых развиваются гаметы. Другая мутация с материнским эффектом – agametic - вызывает отсутствие первичных половых клеток примерно у половины потомков, полученных от гомозиготных самок. В этом случае у потомков формируется нормальное число полярных клеток, но полярные гранулы разрушаются вскоре после оплодотворения (Engstrom et al.. 1982). Опыты по трансплантации показали, что дефект заключается в самой полярной плазме, а не в яичнике. Таким образом, теперь получены очень четкие доказательства того, что полярные гранулы имеют прямое отношение к образованию половых клеток. Эти полярные гранулы были выделены из зародышей дрозофилы (Waring et al.. 1978): оказалось, что они содержат белок и РНК. Молекулярная масса этого белка ( в гранулах, по-видимому, преобладает один белок) равна 95000: он обладает основными свойствами и синтезируется заново в период оогенеза, так что полярные гранулы не наследуются непосредственно через цитоплазму яйца. РНК присутствует в полярных гранулах ооцита. но не обнаруживается после того, как сформировались полярные клетки (Mahowald. 1971a. b). Возможно, что эта РНК чрезвычайно важна для формирования половых клеток. Окада и Кобаяси (Okada. Kobayashi. 1987) инъецировали РНК из яиц и ранних дробящихся зародышей дрозофилы зародышам, у которых полярные клетки были убиты ультрафиолетом. Эти зародыши-хозяева формировали полярные клетки и развивались в мух, имевших половые клетки. Полярные гранулы изменяются в процессе развития. До оплодотворения плотные гранулы, содержащие мембраны, группируются вокруг митохондрий, а затем диспергируются, прежде чем ядра достигнут полюса. Впоследствии полярные клетки включают в себя эти гранулы. Когда полярные клетки мигрируют в половой валик, полярные гранулы деконденсируются на филаменты. называемые nuage. Этот материал скапливается около оболочки ядра. Такое поведение полярных гранул обнаружено у всех изученных представителей животного царства (Eddy. 1975) и, вероятно, имеет важное значение для гаметогенеза. Детерминация половых клеток у амфибийЦитоплазматическая локализация детерминантов половых клеток установлена также у зародышей позвоночных животных. Бунур (Bounoure. 1934) показал, что вегетативная область оплодотворенного яйца лягушки содержит материал, окрашивающийся так же, как полярная плазма у дрозофилы (рис. 7.27). Этот автор проследил судьбу кортикальной цитоплазмы до тех немногих клеток в презумптивной энтодерме, которые в норме будут мигрировать в половую складку. Блэклер (Black1er. 1962) получил убедительные данные о том. что эти клетки являются предшественниками первичных половых клеток. Он удалял определенную область энтодермы у зародыша лягушки на стадии нейрулы и пересаживал ее в такую же область другому зародышу лягушки, находящемуся на той же стадии развития (рис. 7.28). Зародышей-доноров было легко отличить от хозяев, так как их клетки содержали только одно ядрышко вместо обычных двух. Лягушки-хозяева относились к дикому типу (т.е. имели по два ядрышка в одном ядре). После операции из нейрул доноров развивались стерильные лягушки. Отсюда следовало, что зародыш на стадии нейрулы неспособен к регуляции дефекта и что удаленная область была выбрана правильно. Однако из нейрул-хозяев развивались фертильные особи. Более того, если этих лягушек спаривали с нормальными самцами, то потомство было смешанным – получались лягушки, в клетках которых содержалось по одному или по два ядрышка. Таким образом, некоторые из гамет хозяина происходили из энтодермальной области зародыша-донора. Если бы ни одна гамета не развивалась из ткани донора, то у 100% лягушек в клетках содержалось бы по два ядрышка. Если бы каждая половая клетка вела свое происхождение от тканей донора, то соотношение одно- и двуядрышковых особей в потомстве составляло бы 1:1. как это показано на рис. 7.28. В некоторых опытах именно последний результат и был получен. Бунур и др. (Bounoure et аl, 1939) показали, что если вегетативный полюс оплодотворенных яиц лягушки облучить ультрафиолетовым светом, то из Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.30 ГЛАВА 7______________________________________________________________________________
таких яиц развивались стерильные взрослые лягушки, хотя во всех других отношениях они были нормальными. В 1966 г. Л. Деннис Смит (Smith, 1966) продолжил эти исследования, облучая ультрафиолетом разные области зародыша лягушки. Он обнаружил, что облучение анимального полушария не влияет на нормальное развитие, тогда как облучение вегетативного полюса приводит к образованию головастиков, в половой складке которых не было видно крупных первичных половых клеток. Смит выявил значение этой области цитоплазмы путем инъекции цитоплазмы из разных областей нормальных зигот в вегетативную (презумптивную вентральную) область облученным зиготам. Если вводили цитоплазму из области анимального полюса, то эффекта не обнаруживалось и у головастиков, развившихся из таких яиц, отсутствовали половые клетки. Если же инъецировали цитоплазму из области вегетативного полюса, то у головастиков в половой складке были видны первичные половые клетки. Позже было показано (Züst. Dixon, 1977). что первичные половые клетки действительно достигают половой складки у головастиков, зародышевая плазма которых была облучена на стадии 2 или 4 бластомеров. Однако в гонаде содержалось значительно меньше клеток, чем в норме, и по размерам они были не больше 1 10 величины нормальных первичных половых клеток. Их ядра были неправильной формы, и клетки достигали гонад значительно позже, чем их двойники из необлученных яиц. Итак, подобно полярной плазме у дрозофилы, цитоплазма вентральной области зиготы у лягушки содержит детерминанту, которая определяет образование половых клеток и их миграцию, чувствительна к облучению ультрафиолетом и может быть перенесена в другую область вместе с частью жидкой цитоплазмы. Генетика цитоплазматических детерминантов у дрозофилыВ 1936 г. эмбриолог Джаст (Just, 1936) критиковал тех генетиков, которые полагали, что объяснить процессы развития можно, изучая мутации, влияющие на окраску глаза, число щетинок и форму крыла. Он говорил, что не интересуется развитием щетинок на спине мухи, а хочет знать, как у зародыша мухи образуется сама спина. Спустя 50 лет эмбриологи и генетики, наконец, ответили на этот вопрос. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ___________ 31
В настоящее время мы располагаем данными о существовании в яйцах двукрылых насекомых трех групп детерминантов. Одну группу составляют факторы, детерминирующие образование полярных и первичных половых клеток, которые уже обсуждались в этой главе. Вторая группа цитоплазматических детерминантов контролирует дорсовентральную полярность, разграничивающую спинную и брюшную области у личинки мухи. Третья группа детерминантов устанавливает переднезаднюю полярность (голова хвост) развивающегося насекомого. Дорсовентральная полярность. Дорсовентральная полярность у дрозофилы определяется (специфицируется) по меньшей мере 11 продуктами деятельности генома матери, накапливающимися в ооците по мере его развития. Андерсон и Нюсслейн-Вольгард (Anderson, Nüsslein-Volhard, 1984) изолировали 10 генов с материнским эффектом, отсутствие каждого из которых связано с отсутствием вентральных Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.32________________ ГЛАВА 7_______________________________________________________________________________
структур. В некоторых случаях материнским продуктом является, по-видимому, белок, тогда как в других случаях самка мухи снабжает яйцо специфической мРНК. Одна из мутаций, связанных с материнским эффектом, называется snake. Самки, гомозиготные по этой мутации, продуцируют яйца, которые развиваются в полностью дорсализованных зародышей. У них отсутствуют кутикула и структуры, типичные для брюшка личинки. Такие зародыши могут быть «исправлены» инъекцией небольшого количества цитоплазмы из яиц дикого типа. Показано, что активный компонент цитоплазмы яйца дикого типа представляет собой накопленную в оогенезе мРНК. поскольку если мРНК экстрагировали из яиц дикого типа и затем инъецировали мутантным зародышам на стадиях раннего дробления, то вентральные структуры и кутикула развивались нормально (рис. 7.29). Таким образом, здесь мы встречаемся с ситуацией, когда в материнском гене закодирована мРНК, необходимая для дорсовентральной спецификации. В отсутствие этого продукта все клетки развиваются в дорсальные структуры, но когда этой мРНК снабжают дефектных зародышей, их нормальное развитие восстанавливается. Рецессивная мутация Tollимеет сходный дорсализованный фенотип, и инъекция мРНК из яиц дикого типа восстанавливает дорсовентральную полярность яиц, отложенных матерями Toll–/ Toll–. Но в отличие от случая snakeв данной ситуации имеет значение место инъекции. В какую бы часть яйца ни инъецировали мРНК, эта часть становится вентральной областью «излеченного» зародыша (Anderson et al.. 1985). Это позволяет предположить, что в яйцах Toll–/ Toll–отсутствует дорсовентральная полярность (тогда как в случае мутации snakeпри инъекции мРНК дикого типа вентральная область занимает свое нормальное место). Поэтому представляется вероятным, что продукт дикого типа Tollучаствует в установлении этой полярности и действует раньше продукта гена snake(рис. 7.30). При клонировании аллеля дикого типа snake(DeLotto, Spierer, 1986) было обнаружено, что он кодирует аминокислотную последовательность, сходную с последовательностью протеаз трипсина и фактора свертывания крови. Такие ферменты часто принимают участие в активации неактивных предшественников посредством отщепления аминокислотной последовательности, подавляющей их активность. Этот факт поддерживает предположение Андерсона и Нюсслейн-Вольгард о том, что продукт гена Tollявляется неактивным белком, который активируется продуктами нормальных аллелей гена snakeи других локусов. По крайней мере один продукт гена, необходимый для установления и поддержания дорсовен- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ___________ 33
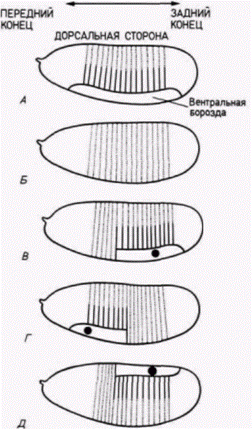
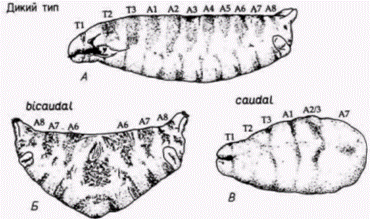
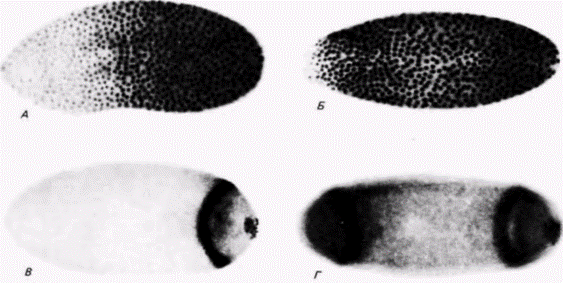
тральной полярности, должен быть белком. Инъекция цитоплазмы яйца дикого типа корректирует (исправляет) в яйцах дефект, обусловленный материнскими генами, но изолированная из нее мРНК не восстанавливает дорсовентральную полярность. Что же контролируют эти продукты генов с материнским эффектом? Полагают, что они участвуют в образовании репрессора. который подавляет активацию единичного гена в геноме дрозофилы. Этот ген zerknullt (zen) обычно экспрессируется только в дорсальных структурах, составляющих 40% зародыша, и не бывает активным в вентральных областях. У тех 10 мутантов с материнским эффектом, которые характеризуются дорсализацией зародыша. ген zen экспрессируется и в дорсальных, и в вентральных областях зародыша. У одного мутант с материнским эффектом (cactus), характеризующегося вентрализацией зародыша, ген zen репрессируется во всем зародыше (рис. 7.31; Rushlow et al.. 1987). Возможно, что нормальные аллели десяти мутантов с материнским эффектом вентрализации включены в процесс образования ингибитора гена zen, тогда как нормальный аллель гена cactus продуцирует репрессор этого ингибитора, способствуя активации гена zen в этой части зародыша. ПЕРЕДНЕЗАДНЯЯ ПОЛЯРНОСТЬ. Другая группа мутаций с материнским эффектом ответственна за спецификацию переднезадней полярности у личинок насекомых. Один такой аллель носит название bicoid (bcd). У зародышей, происходящих от самок, гомозиготных по гену bicoid. отсутствуют голова и грудные сегменты. Цитоплазма яиц дикого типа (примерно 3% всего объема яйца) может излечить этих дефектных зародышей, но только при том условии, что цитоплазма взята из передней четверти яйца. Более того, место, в которое инъецировали эту цитоплазму, станет затем передним участком тела. Фенотип мутанта bicoidможно получить (фенокопировать), проколов передний конец раннего зародыша дикого типа и позволив вытечь около 5% цитоплазмы (Frohnhöfer. Nüsslein-Volhard. 1986). Аналогом мутации bicoid в заднем конце, по-видимому, является мутация oskar. У зародышей, развившихся из яиц. отложенных гомозиготными самками oskar, не образуются структуры брюшка или полярные клетки. Результаты опытов по трансплантации (Lehmann. Nüsslein-Volhard. 1986), сходных с теми, которые проведены на мутантах bicoid. показали, что детерминант для oskar находится только в заднем конце яйца дрозофилы дикого типа. Если цитоплазму, взятую из заднего конца зародыша, инъецировать в переднюю область зародыша дикого типа, то формируется вторая задняя область. Мутации с материнским эффектом caudal (cad) и bicaudal (bic). по-видимому, отвечают на сигналы переднезадней полярности, даваемые мутациями oskarи bicoid. У зародышей, имеющих фенотип caudal, отсутствуют задние абдоминальные структуры, тогда как зародыши bicaudalимеют фенотип «двойного брюшка», выражающийся в том, что два задних зеркально отраженных отдела соединяются по средней линии (рис. 7.32). Таким образом, у зародышей bicaudalбольшая часть передних сегментов утрачена и замещена дубликатами задних сегментов. У дикого типа caudalмРНК в зародыше на стадии синцитиальной бластодермы распределена по заднепереднему градиенту концентрации. Она транслируется в ядерный белок со сходным градиентом концентрации (рис. 7.33, А ). По мере цел- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.34________________ ГЛАВА 7_____________________________________________________________________
люляризации бластодермы градиент поляризуется, т.е. белок обнаруживается в виде единичного кольца шириной в 3 4 клетки и в полярных клетках (рис. 7.33.5). Следовательно, характер распределения белка в зародыше меняется от градиентного до локализованного в определенной области. Однако эффект мутации bicaudal предшествует действию гена caudal. При окрашивании на присутствие белка caudal в зародышах bicaudal обнаруживаются два феномена. Во-первых, отсутствует градиентное распределение этого белка в синцитиальной бластодерме (рис. 7.33. В), и, во-вторых, локализация белка caudal происходит в двух областях вблизи переднего полюса и вблизи заднего полюса (рис. 7.33. Г). По-видимому, вещество bicaudal ответственно за считывание информации о переднезадней полярности и необходимо для правильного размещения продуктов гена caudal. Продукты этого
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ__________ 35
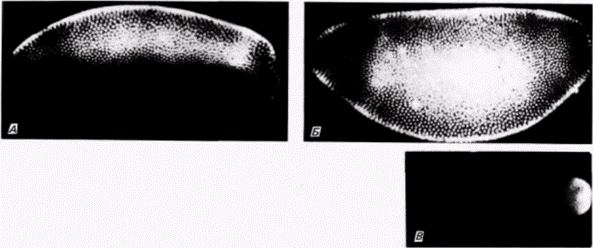
гена, по всей вероятности, необходимы для активации генов, специфичных для задних сегментов (Macdonald, Struhl, 1986; Mlodzik, Gehring, 1987). Сходные мутации были обнаружены у других видов мух (таких, как Smittia), a фенокопии этих мутантов могут быть получены облучением передней области яйца лазерным микролучом или микроинъекцией рибонуклеазы в переднюю область яйца (рис. 7.34; Kandler-Singer. Kalthoff. 1976). Такие облученные яйца можно «излечивать» микроинъекцией мРНК из зародышей дикого типа (Kaltho Elbetiehn. 1986). Спецификация дорсовентральной и переднезадней полярности осуществляется двумя действующими независимо одна от другой группами детерминантов. Эти морфогенетические детерминанты представляют собой мРНК и белки, запасенные в ооците, а установление и поддержание каждой из осей зародыша осуществляются в результате взаимодействия этих факторов в цитоплазме яйца Эти факторы распределяются по специфическим клеткам и влияют на транскрипцию генов в их ядрах. Процессы, благодаря которым разные сегменты приобретают свою специфику (например, то, что на грудных сегментах образуются ноги, а на брюшных - нет) в соответствии с локализацией их клеток по этим осям, будут подробно рассмотрены в гл. 18. Изучение генетики формирования признаков у дрозофилы может стать «Золотым копьем» генетики развития. В течение десятилетий существовали два больших пробела, препятствующие попыткам объединить генетику и развитие. Первый – отсутствие
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.36________________ ГЛАВА 7_______________________________________________________________________________ знаний о молекулах, которые участвуют в спецификации первичных эмбриональных осей. Каким образом задняя часть зародыша становится отличной от его передней части? Второй пробел в наших знаниях касается взаимодействия цитоплазматических детерминантов с ядрами клеток, содержащих эти детерминанты. Гены, ответственные за эти процессы, теперь известны, а некоторые из генных продуктов идентифицированы. В течение короткого времени мы сумеем объяснить, каким образом цитоплазматические детерминанты определяют судьбу клеток зародыша. РЕЗЮМЕВ настоящее время мы распознаем данными о том, что у некоторых организмов судьба любой клетки определяется той частью цитоплазмы, которую она приобретает в процессе дробления. Такая клетка дифференцируется независимо от других клеток, а организмы, использующие этот механизм. имеют тенденцию идти по пути мозаичного, или детерминированного, развития. Этот тип развития характерен для зародышей моллюсков, оболочников и нематод. Локализация морфогенов в цитоплазме яйца, их перераспределение в процессе развития яйца и оплодотворения, а также характер дробления имеют важное значение для детерминации судьбы каждой клетки. Любое из этих событий является функцией яйца. Развитие этих организмов в основном протекает по мозаичному типу, однако у них обнаруживаются и некоторые детерминирующие взаимодействия. У оболочников нервная система и некоторые из мышц формируются в результате индукционных взаимодействий между бластомерами: таким же способом образуются некоторые органы у улиток и нематод В следующей главе мы рассмотрим развитие организмов, у которых индукционные взаимодействия составляют основной механизм детерминации судьбы клеток. ЛИТЕРАТУРА  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ_____________ 37  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.38 ГЛАВА 7  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. | ||||||||||||||||||||||||||||||||||||||


 1
1