Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.________________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ_____________________________ 149
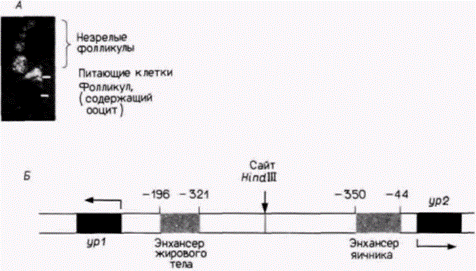
Если добавляли целую 5'-фланкирующую область гена ур1, то жировые тела, но не яичник, окрашивались в черный цвет (только у самок). Эта специфическая транскрипция сохранялась, когда использовали фрагмент от –321-го до –196-го положения. Следовательно, специфичная для жирового тела транскрипция регулируется участком ДНК, длиной 125 пар оснований, который расположен между –196-м и –321-м положениями. Сходным образом последовательность энхансера, отвечающего за спе-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.150_______________ ГЛАВА 12_____________________________________________________________________________ цифическую для яичника транскрипцию, была локализована в области 44-350 пар оснований выше гена ур2 (рис. 12.12). Энхансеры, реагирующие на гормоныВ ходе развития нередко приходится наблюдать координированную регуляцию экспрессии генов. Это явление имеет место, когда в клетках одного типа одновременно синтезируются несколько специфичных для них белков или когда какой-либо гормон индуцирует экспрессию нескольких генов в клетках различного типа. Накапливающиеся данные свидетельствуют о том, что по крайней мере в некоторых случаях координированная регуляция генов осуществляется, когда различные структурные гены
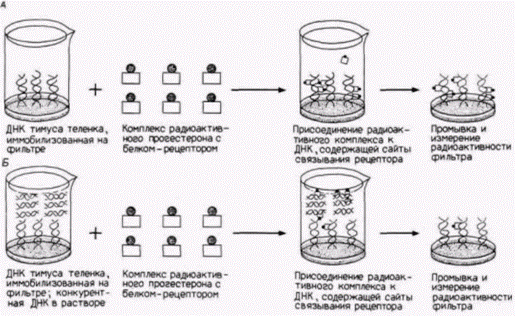
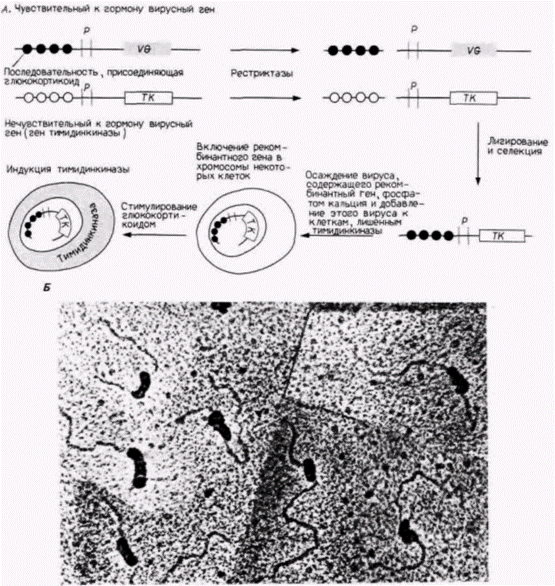
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.____________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ_____________________________ 151 присоединены к одинаковым или похожим энхансерам. В поджелудочной железе энхансеры для десяти эндокринных белков имеют консенсусную последовательность из 20 пар оснований. Это позволяет предположить, что похожие последовательности участвуют в активации данных генов в экзокринных клетках поджелудочной железы (Boulet et al., 1986). Известно, что стероидные гормоны увеличивают транскрипцию многих генов. Полагают, что эти гормоны связываются белковым рецептором, который в такой форме способен специфически присоединяться к определенным последовательностям ДНК (Miesfeld et al., 1986). Одну из групп стероидных гормонов составляют глюкокортикоиды (кортизон, гидрокортизон и синтетический гормон дексаметазон), которые регулируют метаболизм белков и подавляют воспалительные процессы в тканях. Они, по-видимому, функционируют во всех типах клеток. Несколько генов, среди которых гены металлотионеина млекопитающих и некоторые гены опухолеродных вирусов, активируются глюкокортикоидами, поэтому было естественно предположить, что последовательность ДНК, связывающая рецептор с присоединенным гормоном, лежит рядом с этими генами. Один из способов определения глюкокортикоидного энхансера гена заключается в проведении конкурентного связывания, как показано на рис. 12.13. Вначале двухцепочечную ДНК из тимуса теленка (которая, как полагают, имеет много сайтов связывания прогестерона) фиксируют на целлюлозных фильтрах и затем добавляют комплекс радиоактивного глюкокортикоида с рецептором. Этому комплексу позволяют связаться с ДНК и определяют связавшуюся радиоактивность. Затем проводится тот же опыт в присутствии избытка какой-либо другой ДНК в растворе. Если в этой конкурирующей ДНК имеется сайт связывания комплекса глюкокортикоид-рецептор, то она будет конкурировать за радиоактивный комплекс и к ДНК тимуса теленка будет присоединяться меньшее количество радиоактивности (Pfahl, 1982). Использовав различные фрагменты ДНК, полученные с помощью рестриктаз, исследователи постулировали, что последовательность ТГГТАЦАААТГТТЦТ способна выполнять роль глюкокортикоидного энхансера (Karin et al., 1984). Было показано, что эти последовательности, связывающие глюкокортикоид, функционируют как энхансеры после их присоединения к генам, активность которых в обычных условиях не зависит от гормона (рис. 12.14; Chandler et al., 1983). В результате эти гены приобретают чувствительность к глюкокортикоиду. Энхансерные элементы, специфичные к стероидам, очень похожи друг на друга и узнаются близкородственными белками. Каждый стероидный рецептор имеет два функциональных домена: домен, связывающий гормон, и домен прочного связывания ДНК энхансера. Присоединение гормона к первому домену, по-видимому, необходимо для того, чтобы второй домен связался со специфической последовательностью ДНК (Kumar et al., 1986, 1987). ДНК-связывающие домены этих белков очень похожи, но могут различать незначительные изменения в последовательности ДНК. Например, последовательность (палиндромная) 5’-ГГТЦАЦТГТГАЦЦ-3' является сильным эстроген-чувствительным энхансерным элементом, который будет связывать рецептор с присоединенным эстрогеном. Две симметричные мутации в этой последовательности, приводящие к 5'-ГГАЦАЦТГТГТЦЦ-3', будут превращать эту ДНК в глюкокортикоид-чувствительный энхансер (Martinez et al., 1987; Klock et al., 1987). Весьма вероятно, что все стероидные гормоны осуществляют активацию транскрипции по одному общему механизму. Транскрипция генов легких цепей иммуноглобулиновОдин из наиболее хорошо изученных случаев регуляции генов на уровне транскрипции относится к иммуноглобулиновым генам мыши. За последние пять лет были идентифицированы цис· и транс-регуляторные элементы, необходимые для специфической транскрипции этих генов в В-клетках. Делеционное картирование клонированных генов показало, что промотор легкой цепи иммуноглобулина имеет два критических участка – ТАТА-бокс и передний элемент, называемый «окта»-боксом (Bergman et al., 1984; Parslow et al., 1984). Окта-бокс, названный так потому, что состоит из 8 пар оснований, прочитывается как ΑТТТГЦAT. Он был обнаружен во всех изученных промоторах легких цепей иммуноглобулинов и в очень незначительном числе других сайтов. Промоторы генов тяжелых цепей иммуноглобулинов имеют «инвертированный» окта-бокс, АТГЦАААТ (рис. 12.15). Если окта-бокс помещают с 5'-стороны от глобинового гена, то транскрипция этого гена в клетке миеломы увеличивается в 11-18 раз. Это увеличение наблюдалось только в лимфоидных клетках и не наблюдалось в фибробластах (Wirth et al., 1987). Последовательность энхансера генов легких цепей иммуноглобулинов расположена внутри первого интрона между последовательностью VJ и последовательностью константной области (Queen, Baltimore, 1983; Bergman et al., 1984). Если эту последовательность транслировать на клонированные глобиновые гены, то эти гены также приобретают способность специфически транскрибироваться в лимфоцитах (Picard, Schaffner, 1984). |