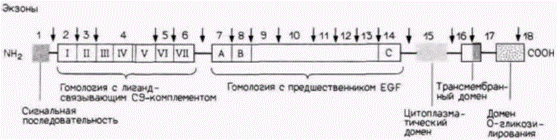
Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ 155
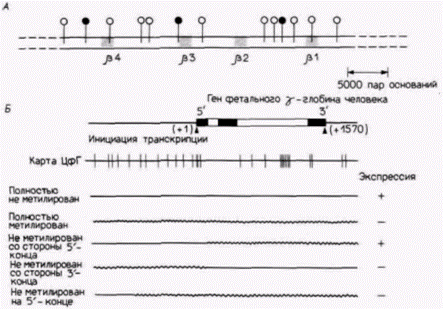
прессия определялась транс-регуляторными элементами, то оба гена были бы либо включены, либо выключены.) Это наблюдение свидетельствует о том, что энхансеры могут меняться в ходе эволюции, благодаря чему в различных тканях будут синтезироваться различные продукты. Метилирование ДНКНередко полагают, что ген состоит из одних и тех же нуклеотидов, когда он активен и когда он неактивен. Ген ß-цепи глобина в предшественнике эритроцитов должен иметь те же нуклеотиды, что и ген ß-цепи глобина в фибробласте того же организма. В 1948 г. в ДНК было открыто «пятое основание» 5-метилцитозин (Hotchkiss, 1948). Это основание образуется ферментативным путем после репликации ДНК, и около 5% цитозинов в ДНК млекопитающих переводится в 5-метилцитозин. Эта конверсия может происходить только в том случае, когда за цитидиновым остатком следует гуанозин (ЦфГ). Недавние исследования показали, что степень метилирования цитозинов в гене может контролировать его транскрипцию. Другими словами, метилирование ДНК может менять структуру гена и благодаря этому регулировать его активность. Первые данные о том, что метилирование ДНК помогает регулировать активность генов, были получены в исследованиях, показавших корреляцию между активностью гена и его неметилированием (гипометилированием), особенно в области промотора гена. В развивающихся эритроцитах человека и курицы ДНК, участвующая в синтезе глобинов, полностью или почти полностью неметилирована, тогда как те же гены в клетках, которые не синтезируют глобины, метилированы в высокой степени (рис. 12.19. А). Клетки печени плода, которые синтезируют гемоглобин на ранних стадиях развития. имеют неметилированные гены для фетального гемоглобина. Эти гены становятся метилированными в тканях взрослого организма (van der Ploeg, Flavell, 1980; Groudine, Weintraub, 1981). Специфическое для органа метилирование наблюдается также в гене овальбумина курицы, этот ген не метилирован в клетках яйцевода, но метилирован в других тканях курицы (Mandel, Chamhon, 1979). Деметилирование сопровождает переключение классов при синтезе иммуноглобулинов (Rogers, Wall, 1981) и коррелирует со способностью грызунов продуцировать металлсвязывающий белок металлотионеин 1 (Compere, Palmiter, 1981). Таким образом, отсутствие метилирования ДНК хорошо коррелирует с тканеспецифической экспрессией определенных генов. Вторая группа данных, свидетельствующих о том, что метилирование ДНК является регуляторным процессом, получена в опытах, где экспрессию клонированных генов изменяли с помощью введения или удаления метильных групп из остатков цитозина. Один из таких опытов еще раз подтвердил, что гипометилирование необходимо для транскрипции β-глобинового гена человека (Busslinger et al., 1983). Когда глобиновые гены клонировали и добавили к клеткам с помощью переосаждения с фосфатом кальция, клетки захватывали ДНК и нередко включали эту ДНК в ядра. В таких случаях клонированный глобиновый ген транскрибировался. С помощью защиты от метилирования определенных участков клонированных генов перед их добавлением к клеткам можно получить клоны, в которых глобиновые гены имеют идентичные последовательности, но разный характер метилирования (рис. 12.19.Б). Полностью неметилированный ген транскрибировался, тогда как полностью метилированный ген (метильная группа на каждом подходящем остатке Ц) не транскрибировался. С использованием частично метилированных клонов было показано, что метилирование в 5’-области глобинового гена (нуклеотиды от –760 до +100) предотвращает транскрипцию. Таким образом, метилирова- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.156_______________ ГЛАВА 12_______________________________________________________________________
ние на 5’-конце гена играет, по-видимому, главную роль в регуляции экспрессии генов. Третья группа данных получена в экспериментах, в которых изначально неактивные гены активировались при их деметилировании непосредственно внутри ядер. Была получена корреляция между активацией молчащих генов и утратой метильных групп из их цитозинов. Из гл. 10 мы узнали, что неактивные гены, специфичные для печени, могут быть активированы в фибробластах мыши после слияния этих фибробластов с клетками печени. Эта активация сопровождается деметилированием генов, специфических для печени особенно в их 5'-областях (Sellem et al., 1985). Когда 5'-области этих генов деметилированы, они похожи на активные гены, специфические для печени, и активно транскрибируют РНК. Другой метод деметилирования генов заключается в обработке клеток препаратом 5-азацитидином. Полагают, что это соединение ингибирует метилтрансферазу, что приводит к деметилированию той ДНК, которая обычно является метилированной (Razin et al., 1984). Когда 5-азацитидин добавляли к колониям мышиных фибробластов С3Н10Τ1/2, эти клетки с высокой частотой превращались в миоциты, адипоциты или хондроциты (Taylor, Jones, 1982; Konieczny, Emerson, 1984). Полученные фенотипы были стабильны, на основании чего можно предположить, что характер метилирования передается через многие циклы клеточных делений. Было показано, что ДНК из миобластов, полученных из обработанных 5-азацитидином клеток C3H10T1/2, способна превращать другие клетки C3H10T1/2в миобласты, тогда как ДНК из необработанных клеток С3Н10Т1/2 не обладает этой способностью (Lassar et al., 1986). Четвертая группа данных, свидетельствующих о регуляции транскрипции с помощью метилирования ДНК, получена в исследованиях инактивации Х-хромосомы у млекопитающих. В этом случае метилирование ДНК играет главную роль в поддержании неактивного состояния одной из двух Х-хромосом в каждой клетке. Предположение о существовании определенных различий в ДНК хромосом впервые возникло на основе данных, полученных в опытах по трансфекции гена гипоксантинфосфорибозилтрансферазы (ГФРТ), связанного с Х-хромосомой, в мышиные клетки фенотипа ГФРТ– (Liskay, Evans, 1980). Когда использовали клон клеток, в которых ген находился на неактивной Х-хромосоме, получен- |