Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.158_______________ ГЛАВА 12__________________________________________________________ ментарной цепи (рис. 12.20). Это объясняет также, почему за метилированными цитидинами всегда следуют гуанозины. В развивающихся спермиях не наблюдается ни одно из распределений гипометилирования, характерных для соматических клеток. Все специфические для клеток гены (глобинов, овальбумина, иммуноглобулинов и т.д.) являются высокометилированными. Большая часть гипометилированных сайтов, обнаруженных до сих пор в сперматозоидах (предшественниках спермиев), оказываются метилированными в зрелых спермиях. По разнице в метилировании генов спермия и яйца можно определить, получен ли ген от отца или от матери. Если ядра первичных половых клеток и у самцов, и у самок резко гипометилированы (Monk et al., 1987), то гены спермия и яйца интенсивно метилированы. Кроме того, характер метилирования данного гена в яйце и спермии может различаться (Reik et al., 1987; Sapienza et al., 1987). Этот материнский и отцовский импринтинг добавляет информацию к наследуемым геномам – информацию, которая может регулировать активность генов и поведение хромосом в пространстве и во времени. В эксперименте была получена линия трансгенных мышей, у которых в геном был встроен ген, индуцирующий образование опухоли (этот процесс будет рассмотрен в гл. 20) (Swain et al., 1987). Если этот ген был унаследован от самца, то он транскрибировался исключительно в сердце, но ни в какой другой ткани. В случае если этот ген наследовался от самки, он не экспрессировался вовсе. Этот характер экспрессии коррелировал со степенью метилирования. Рассматриваемый ген метилировался в ходе созревания яйца и деметилировался при образовании спермия. Такая специфичная для гамет разница в метилировании дает правдоподобное объяснение неспособности к развитию партеногенетических млекопитающих и необходимости присутствия в зиготе обоих пронуклеусов отцовского и материнского. Очевидно, что метилирование является важным механизмом регуляции активности генов, но оно не может применяться для всех генов. По-видимому, этот процесс широко распространен среди позвоночных, но даже у них некоторые гены сохраняют способность к транскрипции, хотя и являются метилированными (Gerber-Huber et al., 1983). Кроме того, метилирования ДНК не происходит, очевидно, у дрозофилы, где тканеспецифическая транскрипция генов хорошо документирована. Дополнительные сведения и гипотезы: Определение сайтов метилированияКогда происходит метилирование ДНК, оно практически всегда идет по цитидину из ЦфГ-пары. Распределение этих метилированных и неметилированных ЦГ-дуплетов определяется с помощью разрезания ДНК двумя рестриктазами. HpaIIи MspI(McGhee, Ginder, 1979). Оба этих фермента разрезают в одном сайте, ЦЦГГ, но НраIIне будет разрезать ДНК, если метилирован центральный Ц, тогда как MspIбудет разрезать эту последовательность независимо от того, метилирована она или нет. Следовательно, ДНК из клеток определенного типа может быть гидролизована HpaIIи отдельно MspI;затем фрагменты расщепленной ДНК могут быть разделены с помощью электрофореза в геле, перенесены на нитроцеллюлозный фильтр и гибридизованы с радиоактивным зондом, специфичным для исследуемого гена. Разницу в распределении зон на радиоавтографах для фрагментов, полученных с MspIи с HpaII, можно объяснить разницей в метилировании. На рис. 12.21 показан результат одного из экспериментов с выделением ДНК спермиев и ее обработкой HpaIIи MspI. Зондом являлась радиоактивная ДНК из второго экзона ß-глобинового гена. Радиоавтограф фрагментов MspI-гидролизата
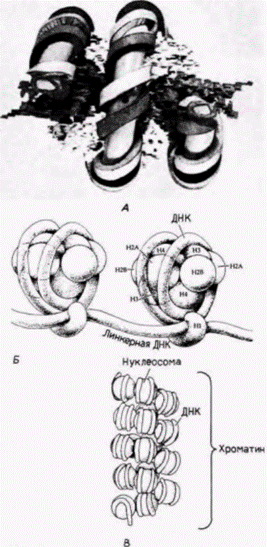
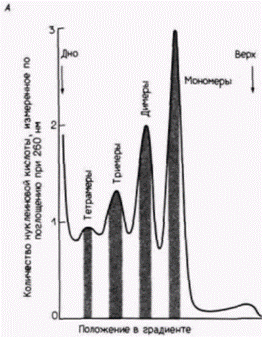
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ___________________________ 159 показывает, что этот зонд присоединяется к фрагментам ДНК, у которой ЦЦГГ-сайты лежат друг от друга на расстоянии 1400 пар оснований. Радиоавтограф с HpaII-гидролизатом показывает, что в ДНК спермиев эти сайты метилированы и что исследуемая последовательность ДНК лежит на отрезке ДНК длиной 25 000 пар оснований, на котором все ЦЦГГ-сайты метилированы (Groudine, Conklin, 1985). ХРОМАТИН ЭУКАРИОТНуклеосомыДо сих пор при рассмотрении транскрипции мРНК мы ограничивались структурой самих генов. Но внутри ядра гены не существуют в «голом» виде, легко доступные для РНК-полимеразы или какого-либо другого белка, связывающегося с энхансером или промотором. Напротив, эукариотические хромосомы содержат столько же белка (по массе), сколько нуклеиновой кислоты, и этот ДНК-белковый комплекс называют хроматином. Доминирующими белками хроматина являются гистоны. Эти пять белков – HI, Н2А, Н2В, Н3 и Н4 представляют собой сильноосновные полипептиды с высоким содержанием положительно заряженных аминокислот лизина и аргинина. Другой гистон, Η5, обнаружен в клетках немногих типов (а именно в эритроцитах птиц и амфибий), в которых ДНК упакована предельно плотно. В этих клетках Н5 заменяет HI. Пять перечисленных главных гистонов имеются у всех представителей царств животных, растений и простейших, и в ходе эволюции изменились очень мало. Обычно такой консерватизм означает, что белки должны играть исключительно важную роль во всех изученных клетках. Ключевая функция гистонов заключается в упаковке ДНК в специфические спиральные структуры, называемые нуклеосомами Нуклеосома это основная единица структуры хроматина; она состоит из гистонового октамера (H2A, Н2В, Н3, H4)2. вокруг которого намотано два витка ДНК, составляющих примерно 140 пар оснований (рис. 12.22). Между нуклеосомами лежат другие 60 (или около того) пар оснований ДНК; эти «линкерные» нуклеотиды могут быть покрыты гистоном ΗI. Такая структура предполагается на основе опытов по расщеплению хроматина, когда он подвергается гидролизу небольшими количествами дезоксирибонуклеазы (ДНКазы) из определенных бактерий (Micrococcus). Эта обработка приводит к расщеплению ДНК по некоторым сайтам, и полученные фрагменты хроматина могут быть отделены друг от друга с помощью центрифугирования в градиенте плотности сахарозы (рис. 12.23). Когда ДНК экстрагируют из обработанного хроматина и разделяют в гелях, получается четкая картина. Вместо кусков случайного размера ДНК предстает расщепленной на фрагменты, кратные по длине 200
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.160_______________ ГЛАВА 12__________________________________________________________
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ______________________________ 161
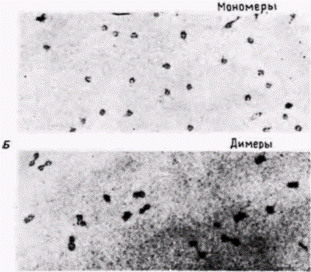
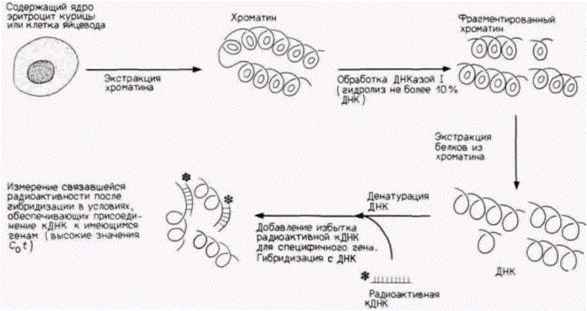
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.162_______________ ГЛАВА 12________________________________________________________________________ парам оснований (Hewish, Burgoyne, 1973; Noll, 1974). Если эти фрагменты хроматина, обработанного ДНКазой, рассматривать в электронный микроскоп, то фрагмент, содержащий 200 пар оснований, виден как сферическое тело (глобула) с небольшим хвостом. Последовательность из 400 пар оснований представляется в виде двух связанных глобул, а последовательность из 600 пар оснований содержит три сферические тела, связанные друг с другом (Finch et al., 1975). На основе этих наблюдений был сделан вывод, что главная субъединица хроматина содержит около 200 пар оснований ДНК и что микрококковая ДНКаза расщепляет ДНК преимущественно между нуклеосомами. Роль гистонов в образовании этой структуры была продемонстрирована в опытах, в которых удалось реконструировать субъединицы хроматина в пробирке (Kornberg, Thomas, 1974). Смешивание гистонов H2А, H2В, H3 и H4 приводит к образованию только тетрамеров из H2А и H2В, а также тетрамеров из H3 и H4. Однако если к этой смеси гистонов добавить ДНК, то нуклеиновые кислоты и гистоны агрегируют с образованием нуклеосомной структуры с теми же самыми физическими и химическими свойствами, что и обычный хроматин. Таким образом, хроматин можно представить себе как нитку нуклеосомных бус, связанных между собой 10–100 парами оснований ДНК. Гистоновый октамер состоит из двух молекул каждого из гистонов H2А, H2В, H3 и H4 и приблизительно 140 пар оснований ДНК, которая намотана на белковую глобулу. Гистон H1 не представлен в нуклеосомах, но в зависимости от физиологического состояния клетки может быть связан с линкерной ДНК между нуклеосомами. Эти нуклеосомы в свою очередь упаковываются в плотные структуры, а H1, по-видимому, участвует в наматывании нуклеосом друг на друга, особенно при подготовке к клеточному делению (рис. 12.24) (Weintraub, 1984). Кроме того, по крайней мере в одном случае, показано, что определяемая H1 конформация нуклеосом ингибирует транскрипцию специфических генов в соматических клетках (Schlissel, Brown, 1984). Активация репрессированного хроматинаДоступность для транс-регупяторных факторовЭксперименты по гибридизации в растворах свидетельствуют, что в геноме большинства позвоночных имеется по меньшей мере 10 000 тканеспецифических генов: и в клетках любого конкретного типа активность почти всех этих генов репрессирована. Обычно считают, что «молчащее» состояние хроматина является репрессированным и что тканеспецифические гены активируются локальным удалением ингибирующих факторов (Weintraub, 1985). Как отмечено выше, главным механизмом общей репрессии генов является, вероятно, компактизация ДНК в кластеры нуклеосом. Если ДНК оказывается закрученной в эти плотные структуры, транс-регуляторные факторы инициации транскрипции не в состоянии найти последовательности ДНК. с которыми они могли бы связаться (Schlissel, Brown, 1984). Когда ДНК, содержащая промотор, входит в состав нуклеосом, соответствующие гены не могут транскрибироваться (Workman, Roeder, 1987). Однако, если к этим генам перед сборкой нуклеосом или во время сборки добавлен белок, связывающийся с ТАТА-боксом (TFIID), то реконструированный хроматин оказывается транскрипционно активным. Специфическая для клеточного типа активация генов может проходить поэтому в два этапа. Во-первых, участок хроматина должен развернуться так, чтобы ген и его промотор стали доступными для транскрипционных факторов и РНК-полимеразы. Во-вторых, чтобы связаться с экспонированной ДНК, эти транскрипционные факторы должны присутствовать в ядрах. Имеются данные, что в любой конкретной клетке транскрибируемые гены более доступны для РНК-полимеразы и транс-регуляторных факторов, чем нетранскрибируемые. (Иными словами, репрессирующая система отменена локально в этих участках.) Основные данные в пользу этого положения получены в работах по определению чувствительности специфических генов различных клеток к ДНКазе. Доступность гена к ядерным белкам может быть оценена при обработке хроматина ткани небольшими количествами ДНКазы I (ДНКаза, отличающаяся по специфичности от микрококковой ДНКазы). Из обработанного хроматина экстрагируют ДНК и смешивают с радиоактивной кДНК для конкретного гена (рис. 12.25). Если кДНК находит последовательности для связывания, значит, соответствующий ген был защищен белками хроматина от переваривания ДНКазой (он был для нее недоступен), и этот ген будет, вероятно, недоступен также для РНК-полимеразы. Однако если зонд кДНК не находит последовательности для связывания, значит, этот ген был экспонирован для ДНКазы и будет, вероятно, доступен для РНК-полимеразы и транс-регуляторных факторов. Было обнаружено, что чувствительность определенного гена к ДНКазе I зависит от типа клеток, в которых он находится (табл. 12.2) (Weintraub, Groudine, 1976). Когда хроматин из развивающихся эритроцитов курицы был обработан ДНКазой I, Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с._________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ__________________________________ 163
затем из него была экстрагирована ДНК и смешана с радиоактивной глобиновой кДНК, глобиновой кДНК практически не было с чем связываться. Глобиновые гены в хроматине оказались гидролизованными небольшими количествами ДНКазы I. Однако обработка теми же количествами ДНКазы I хроматина из клеток мозга не приводила к деградации глобиновых генов. Поэтому глобиновые гены доступны для экзогенных ферментов в хроматине развивающихся эритроцитов, но не в хроматине клеток мозга. Сходным образом ген овальбумина доступен для переваривания ДНКазой I в хроматине яйцевода и недоступен в хроматине эритроцитов. Когда хроматин обрабатывают ДНКазой I и экстрагируют ДНК, овальбуминовая кДНК способна найти комплементарные последовательности в препаратах из эритроцитов, но не в ДНК из хроматина яйцевода. Таким образом, здесь мы имеем четкую корреляцию между дифференциальной регуляцией генов и структурой хроматина. Сайты, гиперчувствительные к ДНКазеПомимо сайтов, чувствительных к ДНКазе I, существуют сайты, гиперчувствительные к ДНКазе I. Эти сайты, идентифицированные с помощью небольших радиоактивных фрагментов ДНК, гидролизуются крайне низкими количествами ДНКазы I, что свидетельствует об их чрезвычайной доступности для внешних молекул. Почти все гиперчувствительные участки, связанные с генами, активность которых регулируется в развитии, тканеспецифичны (Ligin, 1981; Conklin, Groudine, 1984). Сайты, гиперчувствительные к ДНКазе I, содержатся в глобиновых генах эритроцитов и их непосредственных пред- Таблица 12.2 Опыты по связыванию кДНК-зондов с хроматином, обработанным ДНКазой I
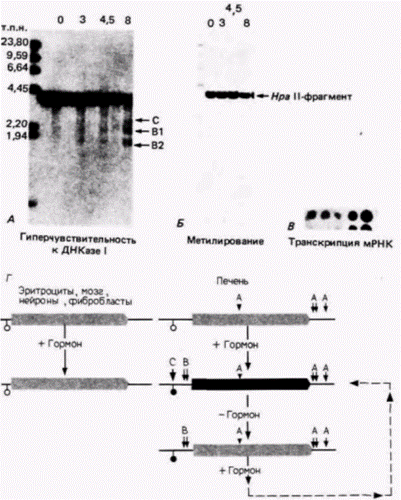
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.164_______________ ГЛАВА 12_____________________________________________________________________________ шественников, но не содержатся в глобиновых генах других клеток (Stalder et al., 1980). В предшественниках эритроцитов из печени плода сайты, гиперчувствительные к ДНКазе 1, лежат в пределах 200 пар оснований с 5'-стороны от кэп-сайтов в генах β-, γи δ-цепей глобина. Если хроматин экстрагируют из клеток костного мозга взрослых особей, то только δ- и β(взрослые)-глобиновые гены обнаруживают гиперчувствительность к ДНКазе I (Groudine et al., 1983). 5’-Фланкирующая область гена вителлогенина курицы содержит несколько гиперчувствительных сайтов в хроматине из печени кур-несушек, но эти сайты отсутствуют в хроматине печени петухов, хроматине эмбриональной печени, хроматине лимфоцитов и клеток мозга (Burch, Weintraub, 1983). Когда сайт, гиперчувствительный к ДНКазе I, был делетирован из 5'-области регулируемого в развитии гена белка из клеток слюнных желез дрозофилы, транскрипты этого гена не обнаруживались, а молекулы РНК-полимеразы не связывались с промотором этого гена (Shermoen, Beckendorf, 1982; Steiner et al., 1984). Такие гиперчувствительные сайты располагаются обычно внутри или поблизости от сайтов, которые выполняют функции энхансеров. При исследовании энхансера, отвечающего на глюкокортикоид в вирусе рака молочной железы мыши, было обнаружено, что перед добавлением гормона к клеткам, несущим вирус, эта энхансерная последовательность не обладает повышенной чувствительностью к ДНКазе I (Zaret, Yamamoto, 1984). После введения гормона в этом участке появляется дискретный сайт, гиперчувствительный к ДНКазе I. Образование гиперчувствительного сайта совпадает с инициацией транскрипции вирусных генов; когда гормон удаляют, гиперчувствительный сайт исчезает и транскрипция вирусных генов прекращается. Исследователи полагают, что взаимодействие между комплексом глюкокортикоид–рецептор и ДНК энхансера изменяет конфигурацию хроматина, способствуя транскрипции с ближайшего промотора. Внутри гиперчувствительного участка овальбуминового гена курицы картирован сайт связывания прогестерона (Mulvihill et al., 1982). Введение эстрогена способно индуцировать образование четырех сайтов, чувствительных к ДНКазе I, в 5'-фланкирующей области этого гена (Кaye et al., 1986), однако после удаления эстрогена три из этих сайтов исчезают. Энхансеры для гена инсулина крысы и β-глобинового гена курицы также лежат внутри участков, гиперчувствительных к ДНКазе I (Emerson et al., 1985; Ohlsson, Edlund, 1986). Гиперчувствительность к ДНКазе и характер метилированияВо взаимоотношениях между сайтами, гиперчувствительными к ДНКазе, энхансерными элементами и сайтами метилирования легко запутаться. У курицы активность гена главного желточного белка вителлогенина II регулируется эстрогеном, и синтезируется этот белок только в печени кур-несушек. В генах вителлогенина, находящихся в хроматине печени, уже до стимуляции гормоном имеются четыре сайта, гиперчувствительные к ДНКазе I. Следовательно, они существуют прежде, чем в этом локусе начинается транскрипция (Burch, Weintraub, 1983). Эти гиперчувствительные сайты (указаны стрелками «А» на рис. 12.26. Г) находятся в середине и в 3'-фланкирующей области гена в хроматине печени, но отсутствуют в хроматине эритроцитов, фибробластов и нейронов. После стимуляции эстрогеном возникают три новых сайта, гиперчувствительных к ДНКазе I. Они лежат в 5'-фланкирующей области гена и связаны с энхансерными элементами, которые присоединяют рецептор эстрогена (Burch, Weintraub, 1983). Кроме того, расположенный в этой области ЦГ-сайт, который обычно метилирован у зародышей и у петухов, при добавлении эстрогена становится неметилированным (указан кружком на рис. 12.26). После удаления эстрогена один из 5'-чувствительных сайтов исчезает, хотя другие сайты (и характер деметилирования) сохраняются. Ни деметилирования, ни возникновения новых гиперчувствительных сайтов в гене вителлогенина в клетках других типов не наблюдается. Высказано предположение, что деметилирование необходимо для появления сайтов, гиперчувствительных к ДНКазе I (Keshet et al., 1986). Если неметилированные глобиновые гены трансфицировали в ядра фибробластов мыши, то в них обнаруживались сайты, чувствительные к ДНКазе (независимо от способности генов к транскрипции). Если же эти гены были метилированы по каждому ЦфГ-сайту, то чувствительные к ДНКазе участки не возникали. Регуляция активности геновКак могут существовать участки, гиперчувствительные к ДНКазе I, если ДНК единообразно упакована в нуклеосомы? На этот вопрос возможны два ответа. Первый в хроматине существуют области, свободные от нуклеосом, и второй – существуют факторы, которые присоединяются к нуклеосомам и заставляют их ослаблять связь с ДНК. Отсутствие нуклеосом обеспечивает доступность всей ДНК в этой области для РНК-полимеразы и возможность осуществления эффективной транс- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.___________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ___________________________ 165
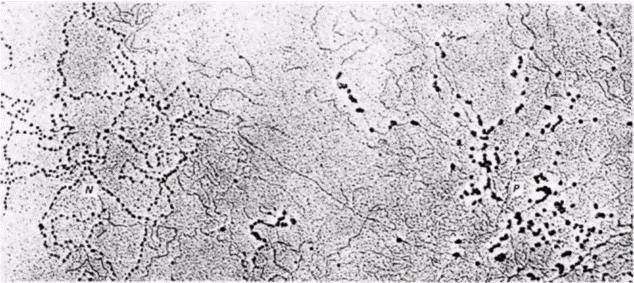
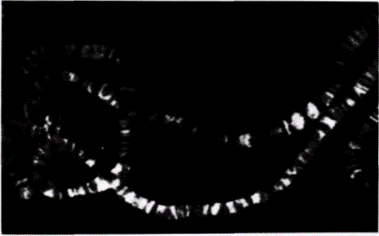
крипции. У клопа-наземника Oncopeltusfasciatusчасть генома, содержащая гены рибосомной РНК, практически полностью свободна от нуклеосом и ДНК в этой области транскрибируется очень активно (Foe et al., 1976). Результаты электронно-микроскопических исследований подтвердили это наблюдение для Oncopeltusи некоторых других видов (рис. 12.27) (Labhart, Koller, 1982). Транскрипция глобиновых генов мыши тоже может происходить с нарушениями в распределении Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.166_______________ ГЛАВА 12______________________________________________________________________________
нуклеосом. В клетках, которые не относятся к эритроидному ряду, нуклеосомы на всем протяжении глобиновых генов располагаются регулярно. Однако в предшественниках эритроцитов регулярное расположение нуклеосом нарушается, так что 5'-конец гена (от -200 до +500) оказывается свободным от этих структур. Когда клетки индуцируются к синтезу гемоглобина, может происходить дальнейшее разрушение нуклеосом (Cohen, Sheffery, 1985; Benezra et al., 1986). Данные, полученные в других исследованиях, также свидетельствуют о том, что большинство участков, гиперчувствительных к ДНКазе I (а возможно, и все такие участки), лишены нуклеосом. Гены легких цепей иммуноглобулинов становятся гипометилированными и чувствительными к ДНКазе I в ходе развития пре-В-клеток в В-клетки (Rose, Garrard, 1984). Кроме того, в это время меняется распределение нуклеосом, так что большие области иммуноглобулинового гена становятся относительно свободными от них. Остающиеся нуклеосомы оказываются без гистона H1 и содержат вместо него белки HMG 14 и HMG 17 (см. ниже). Не исключено, что способ взаимодействия метильных групп с гистонами позволяет образовывать нуклеосомы только на метилированной ДНК, но не на неметилированной (Keshet et al., 1986). Это ограничение будет приводить к появлению участков гиперчувствительности к ДНКазе. После образования таких участков другим транс-регуляторным фактором станет проще находить эти свободные от нуклеосом области. Такая последовательность событий могла бы объяснить, почему ген вителлогенина в печени курицы содержит ряд сайтов, гиперчувствительных к ДНКазе, уже перед добавлением гормона. Присоединение транс-регуляторного рецептора гормона будет создавать впоследствии новые гиперчувствительные сайты, связанные с активной транскрипцией. Формирование активного участка хроматина не требует полного удаления нуклеосом. Многие активно транскрибируемые гены лежат внутри районов с обычным распределением нуклеосом. Тем не менее нуклеосомы могут быть модифицированы в определенных специфических локусах. Одна из таких наиболее важных модификаций включает присоединение двух пептидов, называемых белками группы высокой подвижности: HMG 14 и HMG 17. Когда хроматин гилролизуется ДНКазой I, происходит преимущественное высвобождение двух негистоновых белков хроматина: HMG 14 и HMG 17. Эти два низкомолекулярных белка могут быть экстрагированы из хроматина с помощью 0.35 M NaCl Они, по-видимому, обеспечивают чувствительность, но не гиперчувствительность генов к ДНКазе I, когда связываются поблизости от нуклеосом. Если Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.____________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ___________________________ 167
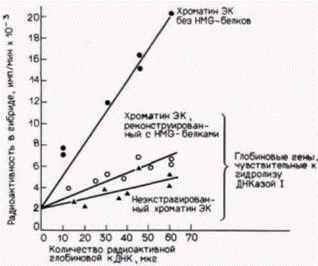
белки H MG 14 и H MG 17 удаляют из хроматина, то одновременно исчезает дифференциальная чувствительность специфических генов к ДНКазе I. Таким образом, когда белки HMG экстрагированы из хроматина эритроцитов, глобиновые гены утрачивают чувствительность к перевариванию ДНКазой I (рис. 12.28). Однако, когда эти белки добавляют к такому обедненному хроматину, дифференциальная чувствительность глобиновых генов восстанавливается (Weisbrod, Weintraub, 1979; Weisbrod et al., 1980; Gazit et al., 1980). Способность этих белков восстанавливать чувствительность по-прежнему определяется хроматином. HMG 14 и HMG 17, выделенные из мозга, восстанавливают чувствительность к ДНКазе I глобиновых генов из эритроцитов, но не из клеток мозга. Таким образом, два негистоновых белка хроматина оказываются необходимыми (но не достаточными) для осуществления транскрипции специфических генов в разных тканях. Связь активной ДНК с ядерным матриксомПрисоединение активного хроматина к ядерному матриксуВнутри ядра репликативные ферменты должны каким-то образом найти сайты для инициации синтеза ДНК: транскрипционные факторы и полимеразы должны найти свои промоторы и энхансеры; факторы процессинга РНК должны найти сайты для сплайсинга РНК, а мРНК должна успешно найти поры, через которые она уйдет из ядра. Это слишком сложная задача для молекул в растворе. Нам пришлось бы предположить, что различные факторы, участвующие в транскрипции, плавают в ядерном соке, сталкиваясь случайно с ДНК. Молекулы РНК, образованные таким образом, будут затем подвергаться сплайсингу и сталкиваться в ядре до тех пор, пока не найдут ядерные поры, через которые покинут ядро. Альтернативная модель предполагает, что РНК транскрибируется на твердом субстрате, где собраны вместе все ферменты, необходимые для транскрипции, процессинга и транспорта. Для таких представлений имеются прецеденты. Подобным упорядоченным агрегатом является цепь транспорта электронов в митохондриях, и давно известно, что ДНК-синтезирующие ферменты бактерий собраны на внутренней поверхности клеточной мембраны. В таком случае можно поставить следующие вопросы: существует ли ядерный ретикулум, где могли бы находиться подобные ферменты? Если такой матрикс существует, локализованы ли на нем активно
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.168_______________ ГЛАВА 12_____________________________________________________________________________
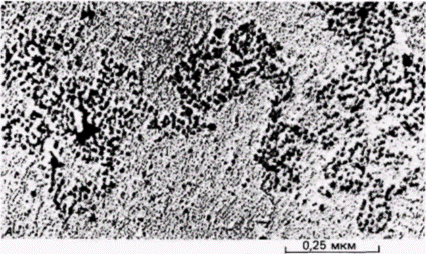
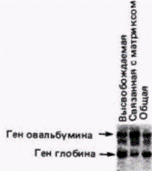
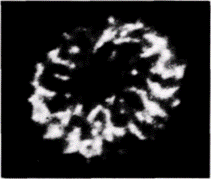
транскрибируемые гены? Если такой матрикс существует, находятся ли на нем РНК-синтезирующие ферменты? Ядерный матрикс можно выделить путем суспендирования ядер в детергентах и гидролиза большей части ДНК с помощью ДНКаз (Berezney, Coffey, 1977; Сарсо et al., 1982). На электронной микрофотографии подобных комплексов выявляется сеть белков, которая пронизывает ядро и присоединяется на ядерной оболочке к цитоскелету (рис. 12.29). Такой матрикс наблюдали во всех эукариотических ядрах, исследованных до настоящего времени (Nelson et al., 1986). При выделении матрикса данным методом ДНКаза удаляет до 98% ДНК. Содержит ли ДНК, которая остается связанной с матриксом (и, вероятно, защищенная от ДНКаз благодаря прочной связи с ним), активно транскрибируемые гены? Мы располагаем данными, что это и в самом деле так, по крайней мере для некоторых генов. Было показано, что ген овальбумина связан предпочтительно с ядерным матриксом в клетках яйцевода, но не в клетках печени или эритроцитах курицы (Robinson et al., 1982). При этом с ядерным матриксом клеток яйцевода, не были ассоциированы глобиновые гены. Другая группа исследователей подтвердила и развила эти наблюдения (Ciejek et al., 1983), показав, что вся индуцируемая гормоном единица транскрипции
(включающая ген овальбумина и два соседних гена X и Y) связана с ядерным матриксом (рис. 12.30). Других генов, ассоциированных с матриксом, не было среди исследованных 100 000 пар оснований ДНК. Когда у животных удаляли эстгроген, исчезало специфическое присоединение этих генов к ядерному матриксу. Оказалось, что эти гены связаны с ядерным матриксом, только когда они активированы. В 1985 г. Хатчинсон и Вайнтрауб (Hutchinson, Weintraub, 1985) обнаружили, что сайты, чувствительные к ДНКазе I, распределяются по ядру неравномерно. Эти авторы обрабатывали ядра ДНКазой I и затем, не разрушая ядер, проводили в них реакцию ник-трансляции. При этом меченая ДНК должна представлять только активно транскрибируемые (т.е. чувствительные к ДНКазе I) гены. Результаты этого опыта (рис. 12.31) показали, что ДНК, чувствительная к ДНКазе I, располагается на периферии ядер и вдоль каналов или волокон, которые присоединены к ядерной оболочке. В этом случае активные гены, вероятно, специфически ассоциированы с ядерным матриксом. Третья группа данных, свидетельствующих об участии ядерного матрикса в транскрипции, включает наблюдения, что большая часть (в некоторых сообщениях 95%) новосинтезированной РНК оказывается присоединенной к ядерному матриксу (Miller et al., 1976; Herman et al., 1978; Mariman et al., 1982; van Eekelen, van Venrooij, 1981). Эта связь, по-видимому, осуществляется при участии особого белка ядерного матрикса. С учетом того, что активные Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ________________________ 169
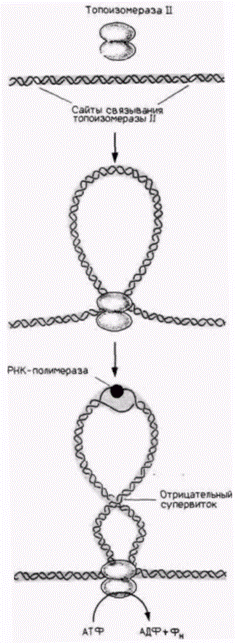
гены, РНК-полимераза и новосинтезированные транскрипты оказываются связанными с ядерным матриксом, было высказано предположение (Jackson, Cook, 1985), что транскрипция не осуществляется мобильной полимеразой, передвигающейся вдоль гена. По представлениям этих исследователей, вероятнее, что РНК-полимераза прикреплена к ядерному матриксу, а ДНК протягивается через нее. Топоизомеразы и транскрипция геновПолагают, что репликация ДНК происходит на ядерном матриксе и один из связанных с матриксом ферментов обеспечивает раскручивание спирали ДНК. Нужен ли подобный фермент для транскрипции РНК? Недавние исследования показали, что раскручивание спирали ДНК играет важную роль, способствуя транскрипции РНК. Чтобы цепи ДНК разошлись, транскрипционно активный хроматин должен быть закручен (Ryoji, Worcel, 1984), и это закручивание осуществляется с помощью суперспирализации ДНК (рис. 12.32). Если суперспирализованные кольцевые плазмиды инъецировали в ядра ооцитов Xenopus, то эти плазмиды транскрибировались. Если же эти плазмиды линеаризовали (раскрывая их с помощью рестриктазы), то после инъекции в клетки они не транскрибировались (Harland et al., 1983; Pruitt, Reeder, 1984). Показано, что чувствительные к ДНКазе I сайты в активных генах возникают только в тех случаях, когда эти гены находятся под торзионным напряжением (Villeponteau et al., 1984). Ферментом, который ответствен за скручивание ДНК, позволяющее цепям ДНК разделиться, является топоизомераза II. С помощью антител к этому белку продемонстрировано, что топоизомераза II расположена в комплексе внутреннего ядерного матрикса с ядерной оболочкой (Berrios et al., 1985). Когда к ядерным препаратам добавляется ингибитор топоизомеразы II новобиоцин, напряжение с генов снимается, сайты, чувствительные к ДНКазе, исчезают, и транскрипция прекращается (Han et al., 1985; Glikin et al., 1984). Прикрепление ДНК к матриксу может быть необходимо также для предотвращения свободного вращения ДНК, что позволяет связанным с матриксом топоизомеразам скручивать хроматин (Cockerill, Garrard, 1986). Ζ-ДНК и петлевые структурыОдним из результатов суперспирализации может быть переход ДНК в альтернативную конформацию, отличающуюся от стандартной B-формы двойной спирали Уотсона–Крика. Суперспирализация Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.170_______________ ГЛАВА 12________________________________________________________________________
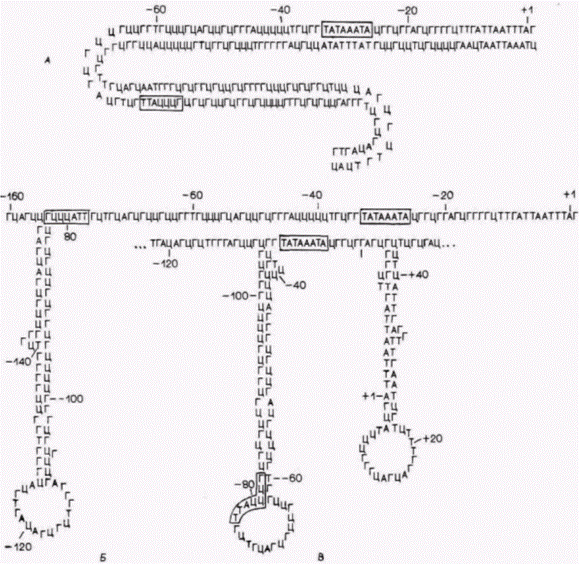
ДНК может привести к образованию «левозакрученной» Z-ДНК или петлевых структур. Образование петель постулируется в тех случаях, когда по термодинамическим причинам может происходить спаривание двух комплементарных участков одной цепи ДНК с большей вероятностью, чем спаривание двух цепей. На рис. 12.33 показано возможное спаривание оснований внутри одной цепи на 5'-конце гена коллагена 22 курицы. Высказано предположение (Larsen, Weintraub, 1982), что такие петлевые структуры являются сайтами узнавания для транс-регуляторных белков, и эти белки, будучи связанными, предотвращают образование нуклеосом в этой области ДНК. Другой конформационный переход, который может происходить под действием скручивания, это переход в Z-ДНК (Johnston, Rich, 1985; Kohwi-Shigematsu, Kohwi, 1985). Большая часть ядерной ДНК представлена правозакрученной двойной спиралью в B-форме, описанной Уотсоном и Криком. Одна- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ_____________________________ 171
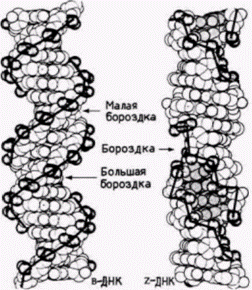
ко Рич и его коллеги обнаружили, что определенные ЦГ-богатые последовательности, такие как ЦГЦГЦГ, образуют предпочтительно левозакрученные двойные спирали (Wang et al., 1979). Физические свойства этой левозакрученной структуры отличаются от свойств стандартной ДНК. Левозакрученная спираль содержит 12 пар оснований на 1 виток (а не 10) и принимает конформацию «зиг-заг» (от· сюда название «Z-ДНК»). Помимо этого в Z-ДНК нет большой бороздки, которая обеспечивает присоединение ряда молекул к B-ДНК (рис. 12.34). Такая левозакрученная Z-ДНК обнаружена в геномах млекопитающих и дрозофилы. С помощью антител к Z-ДНК было показано, что Z-ДНК имеется на всем протяжении политенных хромосом дрозофилы (рис. 12.35). При этом она локализована в зонах между дисками. Считают, что эти междисковые зоны контролируют экспрессию генов, лежащих внутри дисков (Nordheim et al., 1981). Вначале полагали, что переход из B-ДНК в Z-ДНК может происходить только в условиях высокой концентрации солей. Однако позже было показано (Behe, Felsenfeld, 1981), что Z-ДНК формируется естественным образом при физиологических концентрациях солей, если остатки цитидинов в чередующихся ГЦ-полимерах метилированы. Таким образом, метилирование цитидина может позволить B-ДНК перейти в Z-конформацию. Кроме того, в отличие от В-ДНК, которая ускоряет формирование нуклеосом из гистонов. Z-ДНК эффективно подавляет формирование нуклеосом (Nickol et al., 1982). На самом деле гистоны будут связываться с Z-ДНК, но они не будут ассоциироваться в нуклеосомный октамер. РЕЗЮМЕВ данный момент у нас в руках части одной или нескольких головоломок. Мы не уверены, что имеем все части, и даже не знаем, сколько всего головоломок. Вполне вероятно, что существует несколько способов активации транскрипции. За прошедшие пять лет выяснилось, что образования «активных генов» еще недостаточно для транскрипции. Помимо этого требуется «активный хроматин». В настоящее время изучается взаимоотношение между альтернативными структурами генов (метилирован-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.172____________ ГЛАВА 12_______________________________________________________________________ ными и неметилированными; B-ДНК и петлями, или Z-ДНК) и альтернативными структурами хроматина (НMG-модифицированными нуклеосомами и немодифицированными; свободными от нуклеосом областями и областями, содержащими нуклеосомы). Участие гистона H1 в общем подавлении транскрипции и участие скручивания в активации специфических локальных участков представляются ключевыми элементами в регуляции генов. Остается выяснить, каким образом хроматин информируется о том, какую структуру ему следует принять. Вероятно, существуют определенные реципрокные взаимодействия между ДНК и хроматином. Посредством этих взаимодействий ДНК может управлять формообразованием хроматина в конкретном направлении, а данное изменение в структуре хроматина может в свою очередь позволить ДНК изменить свою структуру определенным образом. Одна из моделей заключается в следующем: когда ДНК реплицируется, нуклеосомы разрушаются. На этом этапе характер метилирования может быть изменен или сохранен 1. В активных генах некоторые из транс-регуляторных факторов (такие, как ТАТА-связывающий белок) могут присоединяться к ДНК и эти участки ДНК избегнут конденсации с участием гистона H1. Вместе с тем нуклеосомы в гипометилированных участках могут изменить конформацию так, что окажутся способными присоединить HMG 14 и HMG 17. Экспонированная ДНК может затем связаться с топоизомеразами на ядерном матриксе. Это присоединение позволит ДНК закрутиться таким образом, что в участках промоторных и энхансерных последовательностей возникнут альтернативные структуры. В этих местах цис-последовательности могли бы затем присоединить транс-регуляторные белки и РНК-полимеразу для осуществления транскрипции. Это лишь одна из возможных моделей, удовлетворяющих экспериментальным данным, но и против нее имеются возражения. Как заметил Альбер Клод, мы только начали составлять опись обретенного нами богатства. 1 Вновь образующиеся нуклеосомы могут располагаться в соответствии с распределением метилированных оснований. ЛИТЕРАТУРА  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ______________________________ 173  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.174_______________ ГЛАВА 12_____________________________________________________________________________  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ 175  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.176_______________ ГЛАВА 12______________________________________________________________________________  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||