Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТРАНСЛЯЦИОННАЯ И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ_________________ 203
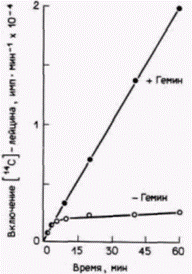
В нескольких лабораториях пытались выяснить, каким образом такая маленькая молекула, какой является гем, может регулировать синтез белка. В 1972 г. Адамсон и др. (Adamson et al., 1972) обнаружили, что стимулирующий эффект гема на синтез глобинов может быть имитирован путем добавления к системе трансляции слабосвязанных рибосомных белков. Поскольку такие смеси богаты факторами инициации трансляции, каждый фактор испытали в отдельности. Оказалось, что эукариоти-
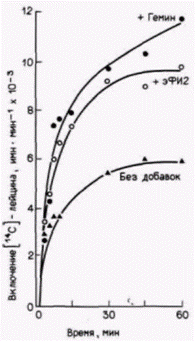
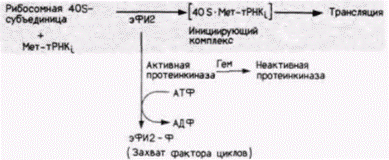
ческий фактор инициации 2 (эФИ2) восстанавливает синтез белка в трансляционной системе из лизатов, дефицитных по гему (рис. 14.7). Этот фактор инициации отвечает за связывание инициаторной тРНК и присоединение ее к рибосомной 40S-субъединице. Какова взаимосвязь между гемом и эФИ2? Чтобы ответить на этот вопрос, лизаты, дефицитные по гему, добавляли к трансляционным системам, содержащим гем (Levin et al., 1976; Ranu et al., 1976). Было обнаружено, что добавка порции лизата, дефицитного по гему, действительно подавляет синтез глобинов в системе трансляции. Это наблюдение указывало на присутствие ингибитора. Более того, оказалось, что эта ингибирующая фракция имеет ферментативную активность. Она содержит киназу, способную фосфорилировать эФИ2. Фосфорилирование эФИ2 в конечном итоге останавливает трансляцию. В норме, после того как рибосомные субъединицы объединяются, эФИ2 высвобождается в виде комплекса с ГДФ (Raychaudhuri et al., 1985). Это высвобождение осуществляется с помощью эФИ-2В (называемого иногда фактором циклов или фактором обмена гуанинового нуклеотида), который присоединяется к эФИ2 и удаляет его с рибосомы. Однако, когда этот фактор циклов присоединяется к фосфорилирован- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.204_______________ ГЛАВА 14_____________________________________________________________________________
ной форме эФИ2, он остается связанным с эФИ2 и комплекс с эФИ2 не уходит с рибосомы (Thomas et al.. 1985; Gross el al., 1986). В результате весь фактор циклов (концентрация которого в 10-20 раз ниже, чем эФИ2) оказывается захваченным в таких неактивных комплексах. Циркуляция эФИ2 прекращается, и синтез белка останавливается. Добавление фактора циклов к лизатам, дефицитным по гему, приводит к восстановлению синтеза белка до уровня трансляционных систем, содержащих гем (Grace et al., 1984). В итоге регуляцию синтеза глобинов гемом можно представить следующим образом (рис. 14.8). 1. В отсутствие гема специфическая протеинкиназа фосфорилирует фактор инициации 2. 2. Фосфорилированный фактор инициации 2 связывается со своим фактором циклов и не высвобождает его. В конечном счете весь фактор циклов иммобилизуется в этих комплексах. Комплекс эФИ2 – эФИ-2В остается связанным с рибосомой, и трансляция останавливается. 3. Избыточный гем способен присоединиться к протеинкиназе, инактивируя ее (Fagard, London. 1981). Инактивированная киназа не будет фосфорилировать эФИ2, поэтому трансляция не останавливается. Таким образом, синтез глобинов продолжается до тех пор, пока присутствует гем. Трансляционный контроль синтеза глобинов не ограничивается этим. Как отмечалось в гл. 12, в диплоидной клетке имеются четыре активных α-глобиновых гена и лишь два активных ß-глобиновых гена. Если бы каждый ген транскрибировался и транслировался с одинаковой скоростью, то следовало ожидать, что количество α-глобиновых молекул вдвое превысит количество ß-глобиновых молекул. Этого, естественно, не происходит. Обнаруживается отношение 1,4:1 для α-мРНК:ß-мРНК, но 1:1 для белков (Lodish, 1971). Таким образом, уравнивание количеств белков обусловлено регуляцией на уровне трансляции. Полагают, что это уравнивание происходит на стадии инициации трансляции (Kabat, Chappell, 1977). Оказалось, что α-глобиновая мРНК конкурирует с ß-глобиновой мРНК за факторы инициации, но ß-глобиновая мРНК является лучшим конкурентом. ß-Глобиновая мРНК узнавалась более эффективно факторами инициации и поэтому транслировалась с большей частотой. Если эти две мРНК присутствовали в равных количествах и при лимитирующем количестве факторов инициации, то лишь 3% производимого белка составлял α-глобин. Однако если нефракционированную мРНК (α- и ß-глобиновую мРНК из лизированных клеток) добавляли к избытку таких факторов, то все молекулы мРНК транслировались с одинаковой эффективностью и итоговое отношение а- и ß-глобинов составляло 1,4:1. Результаты недавних экспериментов (Ray et al., 1983; Sarkar et al., 1984) косвенно свидетельствуют о том, что в качестве фактора инициации, ответственного за дискриминацию между двумя типами глобиновых мРНК, выступает кэп-связывающий белок. Хотя до сих пор неясно, как эта дискриминация осуществляется, известно, что на эффективность трансляции влияет вторичная структура 5’-лидерной последовательности (Pelletier, Sonnenberg, 1985). Как видно из рис. 14.9. 5'-концы α- и ß-глобиновых мРНК существенно различаются. Таким образом, правильное соотношение α-глобина, ß-глобина и гема устанавливается на стадии инициации трансляции. Итак, синтез гемоглобина подвержен регуляции на уровнях транскрипции и процессинга РНК, однако итоговая молекула формируется при тонкой координации на уровне трансляции. Селективная деградация мРНКДругой механизм трансляционной регуляции касается типов мРНК с различной продолжительностью жизни. Для стабильной мРНК, такой, как ß-глобиновая, время полужизни составляет около 17 ч, для молекул же мРНК разнообразных факторов роста время полужизни составляет меньше 30 мин. Следовательно, количество белка, произведенного с одной молекулы глобиновой мРНК, должно быть существенно больше того, что произ- | ||||||||||||||