Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.______________ ТРАНСЛЯЦИОННАЯ И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ_____________ 209
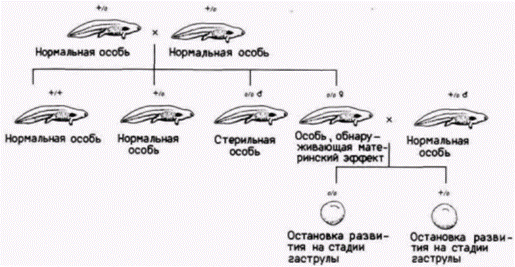
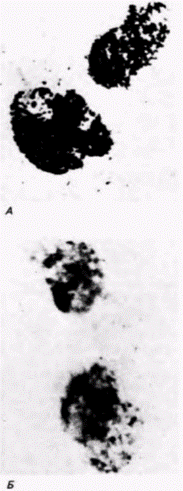
достаточно для обеспечения развития только до стадии вылупляющейся бластулы. Опыты на амфибиях дали похожие результаты, правда, в этом случае стимулом для увеличения скорости синтеза белка оказалась овуляция яйца, а не его оплодотворение. В активированных энуклеированных ооцитах лягушки белки, синтезируемые вскоре после оплодотворения, продуцируются не только в соответствующих количествах, но и именно тех типов, что и в контрольных нормальных зародышах (Smith, Ecker, 1965; Ecker, Smith, 1971). В этом случае цитоплазма ооцита также оказывается «запрограммированной» для обеспечения процессов раннего развития даже в отсутствие ядра. В конечном счете в ядрах зародыша инициируется транскрипция, но даже эта транскрипция в эмбриональных ядрах должна быть активирована материнскими факторами ооцита. Эта концепция получила поддержку в исследованиях 0-мутанта мексиканского аксолотля. 0-Мутация, обусловленная материнским эффектом, заключается в том, что гомозиготные самки откладывают яйца, которые благополучно оплодотворяются и совершенно нормально развиваются до стадии позднего дробления и ранней бластулы (Briggs, Cassens, 1966). На стадии средней бластулы яйца, откладываемые самкой 0/0, обнаруживают замедленный митоз. В таких зародышах образуется спинная губа бластопора, но дальнейшее развитие всегда останавливается во время гаструляции (рис. 14.14). На стадии бластулы в ооцитах самок дикого типа начинается синтез новых белков (Malacinski. 1971). Однако в ооцитах самок 0/0 на стадии бластулы не происходит этот всплеск белкового синтеза и набор белков оказывается идентичен тому, что продуцируют энуклеированные зиготы. В то время как в контроле (норме) на стадии поздней бластулы наблюдается интенсивный синтез РНК, в мутантных зародышах синтез РНК не обнаруживается вовсе или отмечается низкий уровень продукции РНК (рис. 14.15). Было показано, что у зародышей, полученных от самок 0/0, отсутствует фактор, который активирует геном на стадии бластулы (Briggs, Cassens, 1966). Этот фактор можно было изолировать из цитоплазмы нормальных бластомеров или из ядерного сока премейотических ооцитов. Когда этот фактор инъецировали в ооциты от самок 0/0, он предотвращал остановку развития на стадии гаструлы, позволяя зародышу развиваться нормально. Таким образом, для активации ядер амфибий нужен специфический фактор. В отсутствие такого фактора развитие продолжается только до той стадии, которая обеспечивается запасенными мРНК ооцита. У амфибий запасенного ооцитного материала достаточно, чтобы зародыш мог начать гаструляцию. Однако дальше развитие без синтеза новых РНК идти не может. Результаты опытов по физической, химической и генетической энуклеации ооцита с очевидностью свидетельствуют о том, что в его цитоплазме действительно существуют запасенные мРНК и что продукты этих мРНК обеспечивают раннее развитие зародыша. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.210_______________ ГЛАВА 14_____________________________________________________
Характеристика материнских мРНКЭрик Дэвидсон и его коллеги оценили сложность ооцитной мРНК методом, аналогичным использованному ими для анализа сложности яРНК (гл. 13). РНК в большом избытке гибридизовали с денатурированной ДНК; было обнаружено, что значение Соt для 50%-ной гибридизации пропорционально количеству имеющихся различных РНК-последовательностей. С помощью этого анализа они подсчитали, что каждый ооцит (у представителей самых разнообразных типов животных) имеет различные последовательности в количестве, достаточном для приблизительно 1600 копий каждой из 20 000 - 50 000 типов РНК (Galau et al., 1976; Hough-Evans et al., 1977). Из клеток всех известных типов мРНК ооцита характеризуется наибольшей сложностью, и эта сложность отражает огромный потенциал ооцита к развитию. Однако лишь немногие из этих мРНК охарактеризованы. Использование бесклеточных систем трансляции и кДНК-зондов позволило идентифицировать в цитоплазме ооцита мРНК гистонов (Skoultchi, Gross, 1973) и мРНК тубулина (Raff et al., 1972). Очевидно, что продукты этих мРНК важны для образования хроматина и митотического веретена при дроблении. Биохимические методы позволили идентифицировать мРНК для рибонуклеотид-редуктазы (фермент, необходимый для образования дезоксирибонуклеотидов из запасенных рибонуклеотидов) и для фермента вылупления (фермент, который позволяет зародышам разрушать оболочки оплодотворения) (Raff, 1980). В ооцитах двустворчатых моллюсков рибонуклеотид-редуктаза запасается необычным образом. Большая субъединица накапливается в виде белка в цитоплазме ооцита, а малая субъединица запасается в виде нетранслируемой материнской мРНК. Только после оплодотворения новосинтезированная малая субъединица может объединяться с предобразованной большой субъединицей, чтобы сформировать функциональный фермент (Standart et al., 1986). С помощью методов рекомбинантных ДНК удалось выделить запасенную мРНК для актина и других белков. Небезынтересно, что некоторые запасенные мРНК распределены по ооциту неравномерно. Такое неравномерное распределение РНК-последовательностей мы наблюдаем в цитоплазме ооцитов улитки и оболочника, но такая же локализация наблюдается в ооцитах морского ежа и лягушки (Rodgers, Gross, 1978). И если, по данным некоторых авторов (Rebagliati et al., 1985), в цитоплазме неоплодотворенных ооцитов Xenopus большая часть материнских мРНК распределена равномерно, то некоторые мРНК локализованы либо в анимальной, либо в вегетативной области ооцита. Из этих ооцитов была экстрагирована РНК, содержащая (поли)А, и затем для перевода молекул РНК в популяцию двухцепочечных ДНК была использована обратная транскриптаза. Эти двухцепочечные ДНК были встроены в векторы для клонирования и выращены по отдельности в клетках Ε. coli. Таким путем получили около двух миллионов клонов. |