Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.214_______________ ГЛАВА 14____________________________________________________________________________
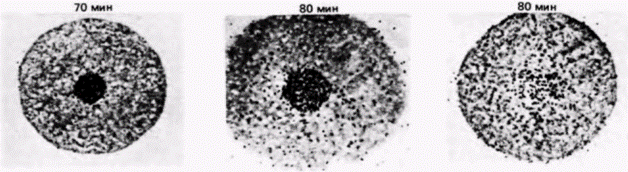
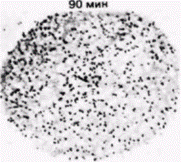
могут влиять на дифференциальную трансляцию РНК в ооцитах Spisula. Некоторые бабочки используют для трансляционного контроля механизм, связанный с изменениями 5'-кэп-группы (Kastern et al., 1982). Чтобы эффективно транслироваться, почти все эукариотические мРНК нуждаются в присутствии на своих 5'-концах кэп-группы, содержащей 7-метилгуанозин (Shatkin, 1976). В ооците табачного бражника запасенные мРНК имеют неметилированную кэп-группу, при этом гуанозин содержится, но к нему не добавлена метильная группа. Такие мРНК не транслируются в белки в бесклеточной системе. Однако при оплодотворении в ооцитах бражника проходит волна метилирования и завершается формирование кэп-групп. Молекулы мРНК, обладающие сформированными кэп-группами, способны затем связаться с рибосомами и инициировать трансляцию. В любом случае, замаскирована ли молекула мРНК белками или не завершена модификация ее 5’-конца, инициация трансляции будет подавлена. Эта молекула может не транслироваться до тех пор. пока не поступит соответствующий сигнал. КОМПАРТМЕНТАЛИЗОВАННЫЕ мРНК. В некоторых работах подвергается сомнению вывод о том, что ооцитные РНП не способны к трансляции. Вместо этого полагают, что белоксинтезирующий аппарат в ооците компартментализован, благодаря чему закрыт доступ мРНК (в составе РНП) к рибосомам (Moon et al., 1982). Синтез гистоновых мРНК в ооцитах морского ежа регулируется, по-видимому, с помощью разграничения такого типа. Гистоновые мРНК локализованы не в цитоплазме ооцита, а в его большом пронуклеусе. И только по завершении оплодотворения, когда пронуклеус разрушается, гистоновая мРНК выходит в цитоплазму (рис. 14.20) (DeLeon et al., 1983). Этого может не быть в случае других мРНК. В пронуклеусе находится менее 0,1% всей мРНК ооцита (Angerer, Angerer, 1981), а те РНП, которые содержат мРНК для актина и тубулина, локализованы преимущественно в цитоплазме (Showman et al., 1982). Известно, что некоторые материнские мРНК, как и отдельные рибосомы, присоединены к цитоскелету (Moon et al., 1983), следовательно, цитоскелет также может отделить молекулы мРНК от рибосом. ИЗМЕНЕНИЕ ЭФФЕКТИВНОСТИ ТРАНСЛЯЦИИ. В предложенных ранее моделях трансляционной регуляции предполагается, что транскрипционный аппарат способен эффективно транслировать любую мРНК, но что мРНК и рибосомы физически или химически отделены друг от друга. На самом деле этого не требуется. Исходно низкое значение pH в ооците само по себе может препятствовать синтезу белка. Как обсуждалось в гл. 2, у морского ежа в ходе оплодотворения происходит значительное высвобождение ионов водорода, приводящее к увеличению значения pH в цитоплазме с 6,9 до 7,4. Из неоплодотворенных ооцитов морского ежа группой исследователей была получена бесклеточная систе- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________ ТРАНСЛЯЦИОННАЯ И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ_________________ 215
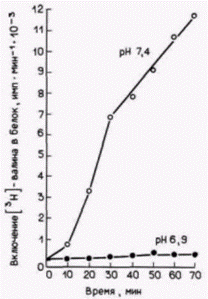
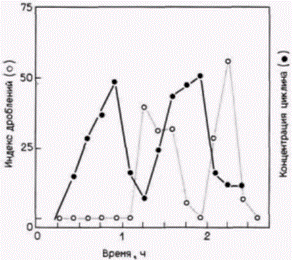
ма трансляции in vitro (Winkler, Steinhardt, 1981). Значение pH в полученной суспензии либо сохраняли неизменным, либо изменяли с помощью диализа и затем измеряли включение радиоактивного валина в белки. Экзогенную мРНК не добавляли. На рис. 14.21 показаны результаты одного из таких экспериментов. Увеличение значения pH с уровня ооцита (pH 6,9) до уровня зиготы (pH 7.4) вызывало подъем белкового синтеза, напоминающий тот, что происходит при оплодотворении. Было высказано предположение, что изменение pH активирует трансляционный аппарат яйца (Hille et al., 1985; Danilchik et al., 1986). Рибосомы и факторы инициации, выделенные из ооцитов, были менее активны при трансляции, чем рибосомы, полученные из оплодотворенных яиц. Кроме того, инъекция экзогенной глобиновой мРНК в неоплодотворенные яйцеклетки не увеличивала количества синтезируемого белка. Глобиновая мРНК транслировалась за счет других мРНК, что свидетельствует о наличии какого-то компонента трансляционного аппарата в лимитирующем количестве. Лимитирующим фактором является, вероятно, фактор инициации трансляции. Добавление эФИ-2В (ГТФ-связывающий фактор циклов) или эФИ-4F (кэп-связывающий белок) к лизату, приготовленному из неоплодотворенных яйцеклеток, приводило к увеличению трансляционной эффективности этого лизата (Colin et al., 1987; Lopo et al., 1988). Вполне вероятно, что подщелачивание цитоплазмы яйца служит как для демаскирования мРНК, так и для активации факторов инициации. Это положение получило подтверждение в опытах, показавших трехкратное увеличение связывания мРНК с рибосомами после повышения значения pH (Winkler et al., 1985). При этом не наблюдалось присоединения ооцитных мРНП к рибосомам. Следовательно, яйцеклетка морского ежа регулирует трансляцию как путем изменения доступности мРНК, так и путем активации факторов инициации трансляции. Существует много способов регуляции трансляции запасенных в яйцеклетке мРНК, и различные организмы могут использовать несколько таких способов одновременно. Материнские мРНК и дроблениеДробление у морского ежа требует непрерывного синтеза белка на запасенных материнских мРНК. Если яйца морского ежа оплодотворяются в присутствии ингибитора трансляции, то дробления не происходит, хотя оба пронуклеуса сливаются. Кроме того, не образуется митотического веретена, хромосомы не конденсируются и ядерная мембрана не разрушается (Wagenaar, Mazia, 1978). | ||||||||