Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.220_______________ ГЛАВА 14______________________________________________________________________________
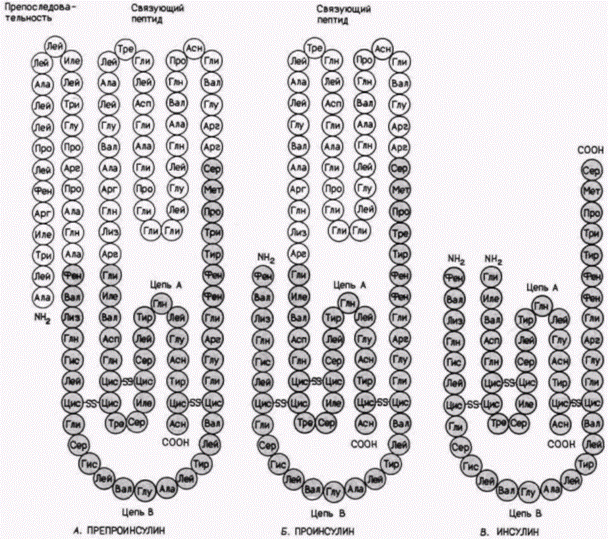
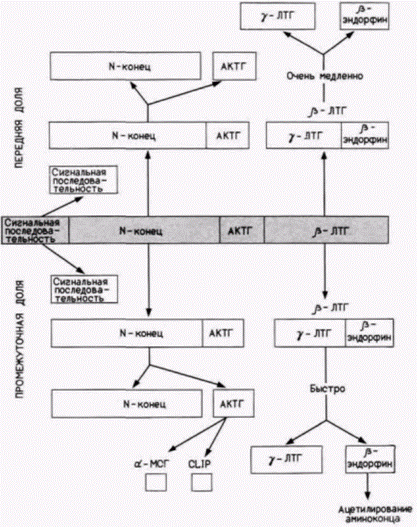
цессинг этих гормонов зависит от типа клеток, в которых они находятся. В клетках передней доли гипофиза АКТГ является конечным продуктом, который может секретироваться, чтобы стимулировать продукцию стероидов в коре надпочечников. Однако в клетках промежуточной доли гипофиза АКТГ расщепляется с образованием α-меланоцитостимулирующего гормона (α-МАГ) (см. обзор Herbert et al., 1981). Некоторые белки могут функционировать только после того, как они модифицируются ковалентным присоединением меньших по размеру молекул. Например, фосфорилаза-киназа не активна, если она сама не фосфорилирована. Однако будучи фосфорилированной, она каталитически активна. Коллаген, один из основных структурных белков тела, не может функционировать, если его пролины и определенные лизины не гидроксилированы, и неспособность к этой модификации приводит иногда к серьезным заболеваниям. Посттрансляционные модификации гистонов могут играть важную роль в регуляции самой транскрипции. У миксомицета Physarum polycephalum отсутствуют клеточные стенки, и активность всех ядер регулируется синхронно внутри общей цитоплазмы, что делает этот объект прекрасной мо- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.ТРАНСЛЯЦИОННАЯ И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ 221
делью для изучения биохимии клеточного цикла. У физарума гистон H4 может существовать в нескольких формах в зависимости от характера его ацетилирования. Сильноацетилированный (2–4 ацетильных группы) Н4 связан с транскрипционной активностью (Chahal et al., 1980). Напротив, фосфорилирование гистона H1 проявляется в активации его способности конденсировать хроматин, благодаря чему транскрипция уменьшается. Ацетилирование H4 и фосфорилирование H1 у этого миксомицета находятся в обратной зависимости друг от друга. Таким образом, валовая транскрипционная активность хроматина может регулироваться фосфорилированием или ацетилированием гистонов. Инактивация белков при посттрансляционных модификацияхИзменения предсуществующих белков могут приводить также к их инактивации. Ранее в этой главе мы указали, как фосфорилирование инактивирует фактор инициации 2, регулируя тем самым синтез гемоглобина. Сходным образом инактивируются при фосфорилировании гликоген-синтетаза и пируваткиназа. Глутамин-синтетаза инактивируется, когда на нее переносится остаток АМФ. Поскольку все эти реакции обратимы, каталитическая активность белков может регулироваться исключительно точно с помощью изменения активности ферментов, добавляющих или отщепляющих модифицирующие группы. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.222_______________ ГЛАВА 14_____________________________________________________________________________ В ряде случаев некоторые белки опасно оставлять внутри клетки. Например, необходимо, чтобы быстро разрушались белки, вызывающие переход клеток к делению, если с ростом клеток скоординирован синтез ДНК. Эти быстро разрушающиеся белки (время полужизни которых составляет менее 2 ч) содержат одну или несколько областей, богатых пролином, глутаминовой кислотой, серином и треонином (Rogers et al., 1986). Долгоживущие белки редко имеют такие кластеры, а если и имеют, то они упрятаны глубоко внутри структуры белка. Однако наиболее важным единичным детерминантом времени жизни белка является, по-видимому, его аминоконцевая аминокислота. Бахмайр и др. (Bachmair et al., 1986) с помощью мутирования клонированного гена для ß-галактозидазы изменяли первый кодон (АУГ) на кодоны для пятнадцати других аминокислот. Когда клетки дрожжей были трансформированы этими шестнадцатью плазмидами, несущими ген дикого типа или один из его мутантных аллелей, разница в продолжительности жизни соответствующего белка оказалась огромной (табл. 14.6). И если время полужизни внутри клетки для нормальной ß-галактозидазы (с метионином на своем аминоконце) составляет более 20 ч, то в случае других аминоконцевых аминокислот это время порой сокращается до менее 3 мин.
Корреляция между продолжительностью жизни белка и его аминоконцевой аминокислотой распространяется, очевидно, также и на природные белки. Кроме того, эта корреляция соответствует наблюдениям, что аминоконцы белков претерпевают посттрансляционную модификацию при гибели клеток in vivo (Softer, 1980, Shyne-Athwal et al., 1986). При этом на аминоконцы белков переносятся с аминоацилированных тРНК дестабилизирующие аминокислоты (Apг, Лиз, Лей, Фен и Тир). Предполагается, что определенный фактор присоединяется к другим клеточным белкам, превращая их в мишень для деградации, и что вероятность связывания этого фактора с любым данным белком зависит от его аминоконца (Bachmair et al., 1986). Связавшись, этот фактор обеспечивает присоединение к данному белку убиквитина. Пришивание убиквитина (небольшой пептид, который образует ковалентные связи с остатками лизина белка-мишени) маркирует белок для деградации. На рис. 14.27 показано, что каждая молекула ß-галактозидазы, намеченная для деградации, комплексируется с молекулами убиквитина в количестве до 15. Клетки различаются по белкам, которые они способны разрушать. Один из таких примеров лактатдегидрогеназа (ЛДГ), которая катализирует обратимое взаимопревращение пирувата и лактата. ЛДГ кодируется двумя различными генами: один ген кодирует субъединицы ЛДГ-А, а другой ЛДГ-В. Эти гены находятся на разных хромосомах. Функциональный фермент ЛДГ является тетрамером. т.е. он состоит из четырех субъединиц. Эти субъединицы могут быть А- или В-разновидностей. Если экспрессируются оба гена, то ожидается присутствие пяти различных форм ЛДГ: A4, А3В1, А2В2, А1В3 и В4. Альтернативные формы фермента называют изоферментами. Эти изоферменты ЛДГ обладают различной каталитической активностью при различных клеточных условиях. Если оба гена ЛДГ экспрессируются одинаково и рекомбинация субъединиц происходит случайно, то можно ожидать появления изоферментов разных типов в следующем отношении 1(А4):4(А3В1):6(А2В2):4(А1В3):1(В4). Эти изоферменты имеют различные электрические заряды, так как субъединица В несет больший отрицательный заряд, чем субъединица А. Следовательно, эти пять изоферментов можно разделить при электрофорезе и затем окрасить их на каталитическую активность (рис. 14.28). Когда равные количества субъединиц объединяются искусственно, действительно обнаруживается отношение 1:4:6:4:1. Однако если обратиться к индивидуальным органам, то наблюдаются значительные отклонения от этого соотношения. Мышечная ЛДГ состоит преимущественно из А-субъединиц, тогда как изоферменты в семенниках, сердце и поч- | ||||||||||||