|
Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
|
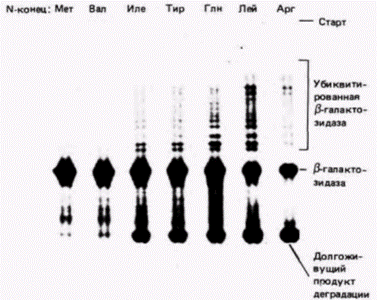
Рис. 14.27. Разрушение ß-галактозидазы с различными аминокислотами на аминоконце. Плазмиды, несущие различные гены (каждая плазмида содержала один ген ß-галактозидазы, но каждый ген кодировал различные аминоконцы), вводили в клетки дрожжей, которые затем метили радиоактивным метионином в течение 5 мин. Клетки лизировали и ген Р-галактозидазы выделяли с помощью иммунопреципитации антителами, полученными к этому ферменту. Белки, узнаваемые антителами (и поэтому выпадающие в осадок), отделяли от антител и неосажденных белков, разделяли в геле и подвергали радиоавтографии. Те полипептиды β-галактозидазы, которые начинались метионином (Мет) или валином (Вал), разрушались в очень незначительной степени. Полипептиды, начинавшиеся изолейцином (Иле), тирозином (Тир) или глутамином (Глн), разрушались достаточно сильно (накопление молекул в нижней части геля), присоединяя наряду с этим несколько пептидов убиквитина (набор полос в верхней части геля свидетельствует об утяжелении интактного белка). ß-Галактозидазы, начинающиеся лейцином (Лей) или аргинином (Apг), разрушались в еще большей степени. (Из Bachmair et al., 1986; фотография с любезного разрешения A.Bachmair.)
|
|
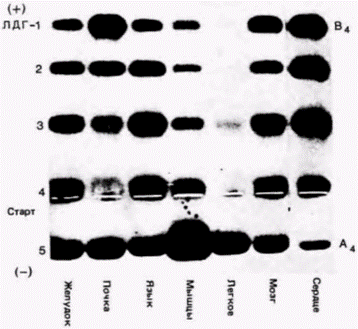
Рис. 14.28. Гель-электрофорез, показывающий различное содержание пяти изоферментов лактатдегидрогеназы (ЛДГ) в разных тканях крысы. (Из Markert, Ursprung, 1971.)
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
224_______________ ГЛАВА 14_____________________________________________________________________________
ках составлены в основном из В-субъединиц (Markert, 1968).
Используя антитела к ЛДГ для осаждения новосинтезированных А-субъединиц, группа исследователей (Fritz et al., 1969) показала, что скорость синтеза ЛДГ-А существенно не варьирует в разных тканях. Однако скорость ее разрушения варьирует очень сильно. ЛДГ-А сердечной мышцы разрушается в 22 раза быстрее, чем в скелетной мышце. Поэтому контроль изоферментов ЛДГ осуществляется не на уровнях транскрипции или трансляции, а на уровне разрушения фермента.
Субклеточная компартментализация белков с помощью посттрансляционных модификаций: адресование белков в мембраны и лизосомы
После того как белки синтезированы, они должны быть правильно размещены в клетке. В конечном итоге белок может быть локализован в растворимой цитоплазме, митохондриях, лизосомах, эндоплазматическом ретикулуме или ядре: он может быть даже выделен клеткой.
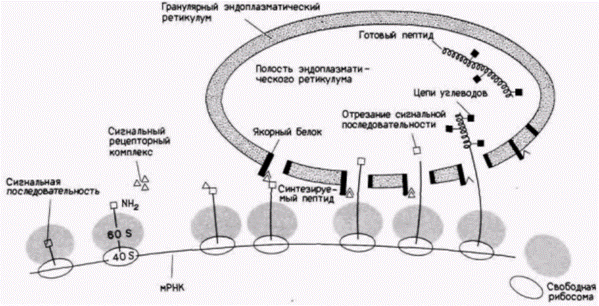
Белки, которые предназначены для лизосом, эндоплазматического ретикулума или секреции, проходят в полость гранулярного эндоплазматического ретикулума в то время, когда они еще транслируются (рис. 14.29). Эти белки (включая коллаген и пептидные гормоны, обсуждавшиеся ранее) имеют сигнальную последовательность, состоящую примерно из 30 аминокислот, которая узнается сигнальным рецепторным комплексом, плавающим в цитоплазме. Когда этот комплекс (который содержит шесть различных пептидных цепей и небольшую молекулу РНК) связывается с пептидом, растущим на цитоплазматической рибосоме, трансляция останавливается. Затем этот комплекс присоединяется к якорному белку на эндоплазматическом ретикулуме, и трансляция возобновляется. Растущие полипептиды проходят через мембрану ретикулума, и, когда они оказываются внутри полости, сигнальная последовательность удаляется, а остающийся белок может быть модифицирован (Blobel, Dobberstein, 1975; Walter, Blobel, 1983; Weidmann et al., 1987). Если белок (или предшественник белка) содержит гидрофобную область, то он, возможно, станет частью эндоплазматического ретикулума, а позже клеточной мембраны. Одна из нерешенных проблем в этой области касается того, как белки локализуются в конкретных участках клеточной мембраны. Так, в плазматических мембранах клеток многих типов определенные белки находятся только на одной стороне мембраны. Мы наблюдали подобное явление при поляризации бластомеров млекопитающих перед компактизацией. Недавно полученные данные (Mostov, 1987) свидетельствуют о том, что существуют определен-
|
Рис. 14.29. Модели трансляции и гликозилирования секретируемых белков. Первые примерно 50 аминокислот полипептида обычно кодируют «сигнальную последовательность», которая указывает, что данный белок предназначен для встраивания в мембраны гранулярного эндоплазматического ретикулума (ГЭР). Эта последовательность узнается сигнальным рецепторным комплексом и затем сайтами на ГЭР. Когда она оказывается внутри полости, часть этой последовательности отрезается. При дальнейшей элонгации белка к нему добавляются углеводы.
|
|
|
|
 Скачать 19.05 Mb.
Скачать 19.05 Mb.


