Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
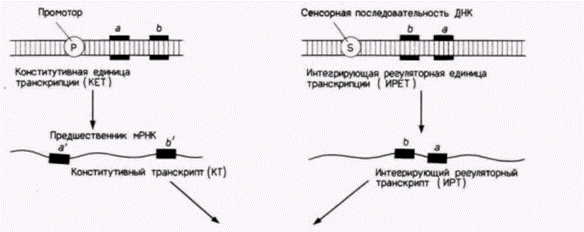
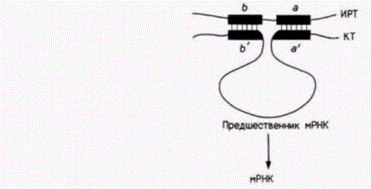
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.184_______________ ГЛАВА 13______________________________________________________________________________ Этот вид мРНК обнаруживается в дифференцированных клетках, синтезирующих белки какой-либо одной группы. В одной клетке может содержаться от 104 до 105 копий. Например, клетки яйцевода кур-несушек содержат 1,0–1,5·105 молекул овальбуминовой мРНК. Ретикулоциты мыши и курицы содержат соответственно 4·104 и 1,5·105 молекул глобиновых мРНК на клетку. мРНК кольца Бальбиани 2 из клеток слюнных желез Chironomustentans является еще одним представителем этого класса избыточных мРНК. Большая часть данных, свидетельствующих о регуляции на уровне транскрипции, получена для класса избыточных мРНК (так как их проще всего очистить и изучить). Однако они могут представлять собой исключение. Обычно эти мРНК кодируют белки, характеризующие определенную клетку, и поэтому представляют конечную стадию дифференцировки, а не ее первопричину. Например, эритроцит проходит долгий путь дифференцировки, прежде чем достигнет стадии, когда начинает синтезироваться глобин. Из предыдущего раздела мы узнали, что последовательности мРНК, специфические для конкретной клетки, можно обнаружить в яРНК клеток всех типов. В табл. 13.2 суммированы некоторые из этих данных. Для уникальных последовательностей РНК, кодирующих белки, характерна цитоплазматическая, а не ядерная специфичность. Противоположная ситуация наблюдается для повторяющихся последовательностей РНК. Транскрипты с умеренно повторяющихся генов не обнаруживаются в мРНК морского ежа, тем не менее внутри ядра проявляется клеточная специфичность в отношении этих последовательностей! В ядерных РНК морского ежа, культивируемых клеток человека и клеток асцитной опухоли крысы повторяющиеся последовательности перемешаны с уникальными (напоминая этим последовательности ДНК). Было обнаружено, что в яРНК зародышей морского ежа имеются специфические РНК-повторы, представленные на различных стадиях развития. Более того, эти повторы в яРНК были представлены обеими комплементарными цепями. Дэвидсон и Бриттен использовали эти данные для построения своей модели экспрессии генов. Во-первых, они предположили, что уникальные гены, которые образуют классы сложных и умеренно повторяющихся мРНК, транскрибируются постоянно с одной и той же скоростью в клетках всех типов. Во-вторых, экспрессия генов регулируется путем определения количества каждого предшественника мРНК, который подвергается процессингу и поступает в цитоплазму. В-третьих, внутриядерные дуплексы РНК–РНК, образуемые комплементарными повторяющимися транскриптами, определяют, какой предшественник мРНК претерпит процессинг. Образование дуплексов в клетках данного типа зависит от внутриядерной концентрации специфических повторов яРНК. Модель регуляции Дэвидсона и Бриттена представлена на рис. 13.9. «Конститутивная единица транскрипции» (КЕТ) транскрибируется постоянно в клетках всех типов. В результате синтезируется конститутивный транскрипт (КТ), состоящий из кодирующей белок РНК (включая интроны и фланкирующие последовательности) и последовательностей с промежуточной повторяющейся ДНК. В другой области генома находятся «интегрирующие регуляторные единицы транскрипции» (ИРЕТ), которые не содержат структурных генов и транскрибируются специфическим для клеток образом1. Эти гены содержат последовательность ДНК (сенсор), которая может включить ИРЕТ в ответ на какой-то конкретный сигнал. ИРЕТ содержит специфические ДНК-повторы и транскрибируется, обеспечивая клетку специфическими интегрирующими регуляторными транскриптами (ИРТ). Между повторами из КТ и комплементарными повторами из ИРТ образуются дуплексы РНК–РНК. Эти дуплексы требуются для сохранения и процессинга яРНК. Если двухцепочечные участки не образуются, то яРНК подвергается гидролизу нуклеазами. Если дуплексы формируются, то яРНК сохраняется, чтобы пройти процессинг и стать мРНК. Существует множество вариаций на эту тему. Одна из интересных гипотез заключается в том, что активация ИРЕТ может быть эквивалентом того, что принято называть детерминацией. Чтобы ген экспрессировался, требуется активировать как специфический ген (КЕТ), так и ИРЕТ. Если ген не экспрессируется постоянно, необходим двухступенчатый процесс: активация транскрипции структурного гена и активация транскрипции ИРЕТ. Первая активация может представлять детерминацию, тогда как вторая активация будет вызывать экспрессию гена и дифференцировку. В этом случае детерминация клетки может повлечь за собой дифференцировку ядра. 1 Мы вновь видим специфическую для клеток дифференциальную транскрипцию, хотя в этой модели постулируется дифференциальная транскрипция специфических для ядер повторяющихся последовательностей, а не генов, кодирующих белки. Вся дифференцировка возвращается в конце концов к активации специфических генов компонентами цитоплазмы ооцитов или внешними факторами (что, возможно, справедливо для плода млекопитающих). Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.____________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК__________________________________ 185
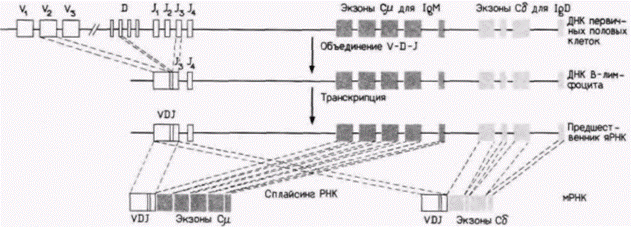
Присутствие в ядре предшественников мРНК, не прошедших процессингДанные, полученные на морском еже. свидетельствуют, что популяции яРНК в различных дифференцированных клетках идентичны, поэтому можно ожидать, что зонды для мРНК, специфичных для одного типа клеток, будут находить комплементарные последовательности в ядрах из неэкспрессирующих клеток. С помощью кДНК глобиновой мРНК были обнаружены предшественники глобиновой мРНК в общей клеточной РНК из печени, мозга и культивируемых клеточных линий мыши (Humphries et al., 1976), а также в яРНК из неиндуцированных клеток больных эритролейкозом Фрейда (Gottesfeld, Partington, 1977) и из ооцитов Xenopus (Perlman et al., 1977). Слабая транскрипция овальбуминовых генов была обнаружена в печени, селезенке, мозге и сердце курицы (Axel et al., 1976; Tsai et al., 1979). Ее уровень соответствует приблизительно одной молекуле, кодирующей овальбумин, на каждые два клеточных ядра: даже те РНК, которые, как известно, регулируются на уровне транскрипции, можно обнаружить в очень небольших количествах в ядрах клеток другой специфичности. Некоторые из наиболее убедительных данных, свидетельствующих о контроле транскриптов РНК на уровне процессинга, получены в экспериментах с вирусами клеток мыши. В этом случае сплайсинг яРНК с образованием конкретных мРНК может осуществляться в клетках одних типов и не может в других. Вирус полиомы и вакуолизирующий обезьяний вирус 40 (SV40) инфицируют клетки и интегрируются в хозяйские хромосомы. При этом они синтезируют свою собственную РНК, которая продуцирует вирусоспецифические белки. Подобно РНК клетки хозяина, транскрипты вирусов полиомы и SV40 должны вначале подвергнуться сплайсингу, чтобы избавиться от интронов. Стабильные вирусные мРНК могут накапливаться в цитоплазме только после процессинга вирусной РНК. (Молекулы РНК некоторых других вирусов, реплицирующихся в цитоплазме, не нуждаются в сплайсинге.) Недифференцированные стволовые клетки тератокарциномы (гл. 6) непермиссивны для инфицирования и экспрессии генов вирусов полиомы и SV40. Однако, если эти стволовые клетки дифференциру- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.186_______________ ГЛАВА 13_________________________________________________________ ются в клетки соматических типов, они неожиданно становятся доступными для инфицирования этими двумя вирусами. Причиной исходной непермиссивности является, очевидно, неспособность к процессингу РНК. Недифференцированные клетки тератокарциномы не осуществляют сплайсинг предшественников мРНК вируса SV40, тогда как дифференцированные клетки делают это. В стволовых клетках гигантские предшественники мРНК накапливаются и в конце концов разрушаются. Только дифференцированные клетки способны преобразовывать эту ядерную РНК в цитоплазматическую мРНК (Segal et al., 1979). Вирусы, которые не нуждаются в процессинге РНК для экспрессии генов (Синдбис и вирус осповакцины), способны к полноценному росту как в стволовых клетках тератокарциномы. так и в ее дифференцированных производных. Данные о том, что сплайсинг проходит только в дифференцированных клетках мыши (Topp et al., 1977) и производных тератокарциномы, свидетельствуют о зависимости развития клетки от экспрессии собственно ферментов сплайсинга (или их специфических ИРТ-«кофакторов»). Эти агенты, ответственные за процессинг РНК SV4O, играют, без сомнения, более подходящую для них роль в клетке и могут отвечать за процессинг некоторых предшественников мРНК. необходимых для клеточной дифференцировки. Образование альтернативных белков на одном гене: дифференциальный процессинг РНК в иммунной системеДифференциальный процессинг РНК оказался чрезвычайно важным для образования ряда специфических белков. Наиболее хорошо изученные случаи относятся к образованию различных иммуноглобулинов (антител) в ходе дифференцировки В-лимфоцитов. Экспрессия генов, кодирующих антитела, в процессе развития лимфоцитов и их ответ на антиген включают в себя многочисленные события, связанные с селекцией и перестройкой генных сегментов. Эти селекция и перестройка осуществляются преимущественно на уровне ДНК (см. гл. 10 и 11). Но некоторые аспекты регуляции экспрессии генов антител проявляются на уровне процессинга РНК. В процессе своего развития В-лимфоцит, прежде чем он станет клеткой, секретирующей антитела, синтезирует пробные антитела, которые могут секретироваться и встраиваться в плазматическую мембрану. Здесь они функционируют как рецепторы антигена. Поверхностные иммуноглобулины могут принадлежать к классам IgM или IgD в зависимости от стадии развития лимфоцита и от того, контактировал ли он с антигеном того типа, с которым реагируют его антитела. Вначале поверхностные иммуноглобулины относятся к классу IgM; после первой стимуляции антигеном они могут быть одновременно IgM и IgD; впоследствии на клеточной поверхности могут присутствовать только IgD. Но «вариабельная» (антигенсвязывающая) часть иммуноглобулина остается неизменной на протяжении всей жизни конкретного лимфоцита и его дочерних клеток. При этом, как было показано Маки и др. ( Maki et al., 1981), переключение с IgM на IgD происходит на уровне процессинга РНК. Синтезируется единый РНК-транскрипт, который содержит экзоны, кодирующие вариабельную (антигенсвязывающую) область и константные области мю (IgM) и дельта
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК___________________________ 187
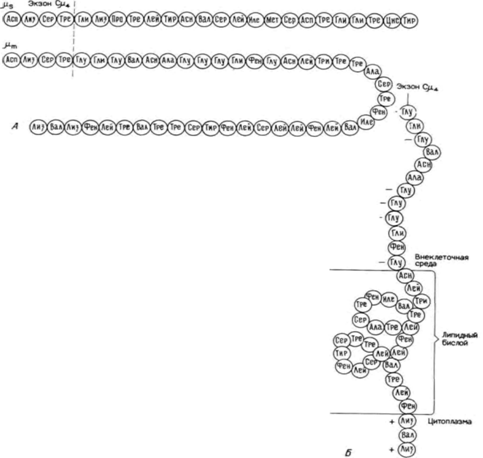
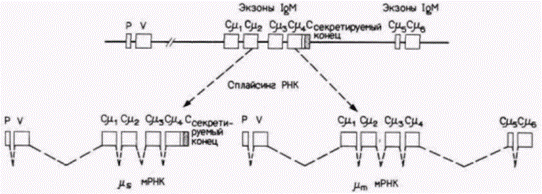
(IgD), раздвоенные разнообразными интронами. Что будет кодировать мРНК, выходящая в цитоплазму, – IgM или IgD, зависит от того, какой из двух альтернативных механизмов сплайсинга используется. Если вырезаются и отбрасываются дельта (δ)экзоны, то будут образовываться IgM. Если при сплайсинге удаляются мю(μ)экзоны, тогда будут синтезироваться IgD. В течение переходного периода, когда используются оба механизма сплайсинга, продуцируются иммуноглобулины обоих классов (рис. 13.10). Выбор между синтезом IgM или IgD не является единственной функцией дифференциального процессинга РНК Назначение этих белков – будут ли они встроены в плазматическую мембрану или будут секретированы – решается аналогичным образом. IgD обычно прикреплены к клеточной мембране, и присутствие IgD в сыворотке, как считают, может являться результатом только случайной утечки или гибели клеток. Напротив, IgM может существовать в двух различных формах, мембрансвязанной (mIgM) и секретируемой (sIgM). Мембрансвязанный IgM функционирует в качестве рецептора антигена, а секретируемый IgM является первым типом антител, который обнаруживается в крови, когда организм впервые сталкивается с антигеном. Оказалось, что sIgM и mIgM отличаются друг от друга карбоксильными концами (Singer et al., 1980). Эти молекулы идентичны, за исключением того, что мембрансвязанная форма содержит гидрофобный «хвост», который удерживает ее в мембране (рис. 13.11). Молекулы мРНК для мембранной и секретируемой форм IgM различны. Обе они транскрибируются на одном Сμ-гене, однако по-разному проходят процессинг (Rogers et al., 1980; Early el al., 1980; Alt el al.,1980). Секретируемый IgM содержит области, копируемые генами VDJ и экзонами Сμ1, Сμ2, Сμ3, и Сμ4. Помимо этого он содержит хвостовую часть, которая позволяет ему секретироваться. Мембрансвязанный IgM имеет аналогичное строение, за исключением ответственной за секрецию хвостовой части, вместо которой к нему добавлен фрагмент, кодируемый двумя дополнительными экзонами Сμ5, и Сμ6, которые формируют гидрофобный хвост, Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.188_______________ ГЛАВА 13_____________________________________________________________________________
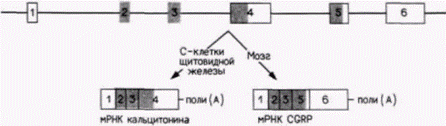
способный встраиваться в мембрану лимфоцита. При сплайсинге РНК решается, какая из молекул будет образована, sIgM или mIgM (рис. 13.12). Помимо этого в процессе формирования антител имеется третий этап, где дифференциальный процессинг РНК играет важную роль. В каждом В-лимфоците синтезируются молекулы лишь одного типа антител, которые кодируются только одной из двух гомологичных хромосом, имеющих такие гены. Это явление называют аллельным исключением. Что происходит с другой хромосомой, имеющей гены антител? Группа исследователей обнаружила ядерные РНК, соответствующие неперестроенным или неправильно перестроенным генам антител (Perry et al., 1980). Это наблюдение свидетельствует о том, что происходит транскрипция «неэкспрессирующихся» генов антител, которая не сопровождается процессингом с образованием мРНК. Дифференциальный процессинг РНК: генерация новых белков в разных клетках в разное времяДифференциальный процессинг РНК изучали наиболее интенсивно на примере экспрессии иммуноглобулиновых генов, однако было установлено, что он контролирует альтернативные формы экспрессии более чем 50 различных белков (Breitbart et al., 1987). В ряде случаев сплайсинг РНК может создавать в разных клетках различные белки. Процессинг определенного предшественника мРНК в некоторых клетках щитовидной железы поставляет мРНК для гормона кальцитонина. Однако в нервных клетках тот же предшественник мРНК проходит процессинг в мРНК для нейропептида CGRP (рис. l3.13)(Amara et al., 1982; Crenshaw et al., 1987). Это явление интересно само по себе, а также потому, что другой транскрипт после альтернативного сплайсинга генерирует в нейронах образование субстанции Р, а в тех клетках щитовидной железы, в которых синтезируется кальцитонин, субстанции К. Полагают (Crenshaw et al., 1987), что существуют специфичные для нейронов регулирующие сплайсинг факторы, которые функционируют на целом наборе предшественников, способных к альтернативному сплайсингу. Полагают также, что сходным образом пять различных фибронектинов человека генерируются одним вариантом гена фибронектина. Разнообразные (и в ряде случаев органоспецифические) формы
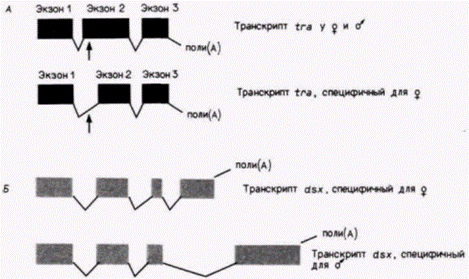
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с._____________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК_________________________________ 189 фибронектина транслируются с разных мРНК, возникающих из предшественника фибронектиновой мРНК благодаря соединению вместе различных экзонов (Tamkun et al., 1984; Hynes, 1987). Альтернативный сплайсинг предшественников мРНК генерирует, очевидно, различные формы молекул адгезии нервных клеток N-MKA (Cunningham et al., 1987), а также фетальные и взрослые формы миозинов (Nabeshima et al., 1984; Rozek, Davidson, 1986). Таким образом, альтернативный сплайсинг РНК может создавать семейство белков, кодируемых одним геном. Если один и тот же предшественник мРНК по-разному проходит процессинг в клетках различного типа, то можно ожидать, что образование мРНК зависит от присутствующих в этих клетках факторов процессинга РНК для тропонина Τ – белка, специфичного для мышц и обеспечивающего чувствительность актомиозина к ионам кальция, – образуется в ядре мышечной клетки при сплайсинге, соединяющем вместе определенные экзоны (Breitbart, Nadal-Ginard, 1987). Способность к правильному процессинг у предшественника РНК тропонина Т определяется, по-видимому, специфическим для мышц фактором сплайсинга. Немышечные клетки не объединяют нужные экзоны. и этого не делают также одноядерные миобласты. Лишь многоядерные мышечные трубочки содержат фактор, который может обеспечить правильный процессинг яРНК-предшественника этого специфического для мышц белка. Альтернативный процессинг РНК и детерминация полаДаже если дифференциальный процессинг РНК действительно генерирует некоторые из белков, характеризующих тип дифференцированных клеток, это не обязательно означает, что альтернативный сплайсинг РНК участвует в более ранних событиях, которые определяют судьбу клеток. Однако недавние исследования убедительно свидетельствуют о том, что дифференциальный процессинг РНК играет основную роль в детерминации полового фенотипа дрозофилы (Baker et al., 1987; Boggs et al., 1987). Как мы увидим в гл. 21. в развитии полового фенотипа у дрозофилы участвуют группы генов, которые преобразуют отношение Х-хромосома:аутосома в мужской или женский тип. Одним из ключевых генов в этом процессе является ген transformer. Этот ген необходим для дифференцировки самок, и его утрата приводит к появлению самцов независимо от соотношения хромосом. На протяжении всего личиночного периода ген transformerактивно синтезирует транскрипт, который проходит процессинг в неспецифическую мРНК (имеющуюся и у
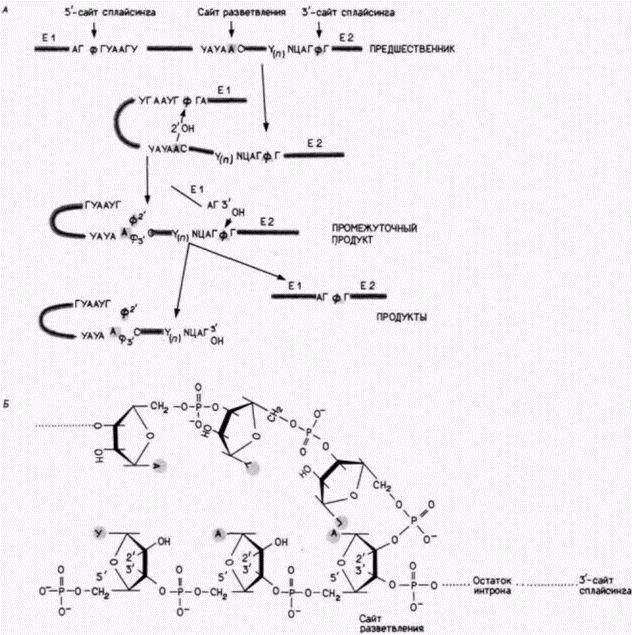
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.190_______________ ГЛАВА 13_____________________________________________________________________________ самок, и у самцов) или специфическую для самок мРНК (рис. 13.14, А). Только самки содержат мРНК, образованную при альтернативном сплайсинге, и она является единственной функциональной мРНК, синтезируемой этим геном. Неспецифическая мРНК, присутствующая и у самцов, и у самок, содержит стоп-кодон (УГА) в начале второго экзона. В отличие от этого в специфической для самок мРНК кодон УГА находится в интроне и не влияет на трансляцию мРНК. Белок, кодируемый такой мРНК, содержит большое количество аргинина, а его длина составляет около 196 аминокислот (Boggs et al., 1987). В процессе детерминации пола дрозофилы ген transformer контролирует, по-видимому, экспрессию основного гена doublesex (dsx). Ген doublesexнеобходим для формирования фенотипа любого пола, и мутации в этом гене подавляют образование семенников и яичников. На стадии формирования куколки ген doublesexсинтезирует транскрипт, который может подвергнуться процессингу двумя альтернативными способами. Он может генерировать мРНК, специфичную для самок, или мРНК, специфичную для самцов (рис. 13.14. Б) (Baker et al., 1987). У самок и самцов первые три экзона этого гена одинаковы, а четвертые экзоны различаются. В специфичной для самцов РНК делетирован большой фрагмент РНК-предшественника, который включает в себя специфичный для самок экзон. Авторы этой работы полагают, что гены детерминации пола, функционирующие ранее гена doublesex (transformer и transformer-2 ), нужны для образования фактора сплайсинга, который обеспечивает процессинг РНК-предшественника в мРНК, специфичную для самок. Если оба гена transformer отсутствуют (как при мутациях) или не активны (как у мух, характеризующихся фенотипом XY; см. гл. 21), то транскрипт гена doublesex проходит процессинг способом, специфичным для самцов, и образуются самцы. Если эта гипотеза правильна, то дифференциальный процессинг РНК играет исключительно важную роль на протяжении всего индивидуального развития. Дополнительные сведения и гипотезы: Биохимия процессинга РНККак осуществляется сплайсинг предшественников мРНК? Каким образом из одного предшественника могут возникать различные мРНК? Изучение биохимии процессинга РНК началось сравнительно недавно, поэтому в настоящее время мы не можем полностью прояснить эту довольно малоизученную область. Двумя наиболее важными открытиями за последние несколько лет явились обнаружение разветвленных промежуточных продуктов РНК и идентификация каталитических рибонуклеопротеидных частиц внутри ядра. Сайты сплайсингаСравнение последовательностей ДНК большого числа различных генов выявило определенное сходство в местах соединения интронов и экзонов. Последовательность оснований интрона обычно начинается с ГT, а последовательность оснований экзона обычно оканчивается на АГ (табл. 13.3). Фактически «консенсусная последовательность» для 5'-концов нитронов – АГ/ГТ (т.е. большинство экзонов оканчивается на АГ, а интрон начинается с ГТ), а 3'-концевая последовательность большинства интронов ΊΤΝЦΑΓ (где N может быть любым нуклеотидом). Эти сайты оказываются очень важными для процессинга интрона. Болезнь ß-талассемия характеризуется генетической недостаточностью продукции βглобинов. При этом мутации возникают не в экзонах, кодирующих глобиновый белок, а в интронах. В случае одной из таких мутаций, приводящих к талассемии, последовательность ТТГГТЦТ в первом интроне изменена на ТТАГТЦТ. Обычный 3'-концевой сайт сплайсинга для этого интрона ТТАГ/ГЦТ. Поэтому данная мутация создает искусственный сайт сплайсинга, благодаря чему появляется возможность для ошибочного сплайсинга (Spritz et al., 1981). На самом деле ß-глобиновый предшественник при талассемии претерпевает сплайсинг в неправильных местах с вероятностью выше 90% (Busslinger et al., 1981). Сайты разветвленияПомимо сайтов сплайсинга существует еще одна последовательность, необходимая для правильного вырезания нитронов. Это сайт разветвления. Он расположен внутри интрона обычно на расстоянии около 20–50 нуклеотидов выше 3'-концевого сайта сплайсинга и имеет консенсусную последовательность УАУААЦ. В большинстве положений У может быть заменен на Ц, а А – на Г. Однако предпоследний (подчеркнутый) остаток А является незаменимым. Этот остаток А имеет ключевое значение, Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК___________________________________ 191 Таблица 13.3. Последовательности нуклеотидов в местах соединения кодирующих областей и промежуточных последовательностей 1)
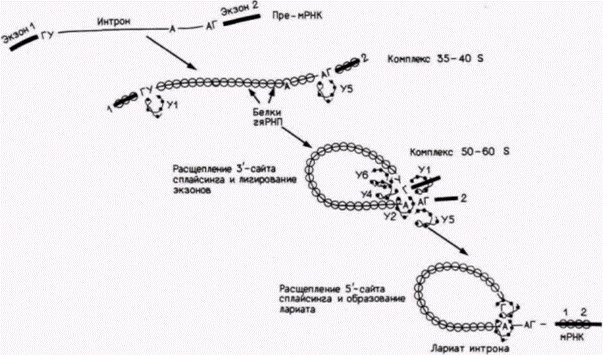
поскольку он образует фосфодиэфирное «разветвление» с фосфатом 5’-концевого сайта сплайсинга (рис. 13.15). Он делает это, используя свою свободную 2'-гидроксильную группу для соединения с фосфатом из 5’-сайта сплайсинга. Таким образом, фосфат из ГМФ, вместо того чтобы удерживать первый экзон, высвобождает его и зацепляется за 2’-гидроксильную группу АМФ в сайте разветвления. В результате этого маневра высвобождается первый экзон и образуется «лариатная» (типа лассо) структура в качестве промежуточной. Свободный 3'-ОН-конец первого экзона присоединяется затем к фосфату в 3'-сайте сплайсинга ниже петли лариата, благодаря чему первый экзон заменяет собой интрон. В результате происходит соединение двух экзонов с помощью группы АГ из первого экзона и Г из второго экзона (Sharp, 1987). Промежуточный продукт, напоминающий по форме лассо, с 2'—5' фосфодиэфирной связью был обнаружен в опытах с клонированным фрагментом ß-глобинового гена человека, состоящим из первых двух экзонов и интрона между ними (Ruskin et al., 1984). РНК, транскрибированную с этого клона, добавляли в экстракт ядер из клеток человека, способный осуществлять сплайсинг этого «предшественника» по соответствующим сайтам (Krainer et al., 1984). Для завершения этой реакции in vitro требуется около часа, после чего можно изолировать промежуточные продукты с помощью гель-электрофореза (поскольку лариатная структура затрудняет миграцию при электрофорезе). Химический анализ этих промежуточных продуктов подтвердил, что нуклеотид А в сайте разветвления имеет две фосфодиэфирные связи, одну с участием 2-ОН-группы и одну с участием 3'-ОН-группы. Вскоре после этого были идентифицированы аналогичные промежуточные продукты ß-глобиновых транскриптов при процессинге in vivo в зародышах кролика (Zeitlin, Efstratiadis, 1984). Роль малых ядерных рибонуклеопротеидных частицВ ядрах многоклеточных организмов реакции сплайсинга не происходят самопроизвольно1. На самом деле они катализируются частицами, состоящими из малых ядерных РНК (мяРНК) и белков. Эти малые рибонуклеопротеидные частицы обо- 1 Вызывает удивление, что такой самопроизвольный сплайсинг на самом деле происходит при удалении интронов из транскриптов митохондриальных генов дрожжей и из рибосомной РНК простейшего Tetrahymena(см. Sharp, 1987). Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.192_______________ ГЛАВА 13_____________________________________________________________________________
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК_________________________________ 193
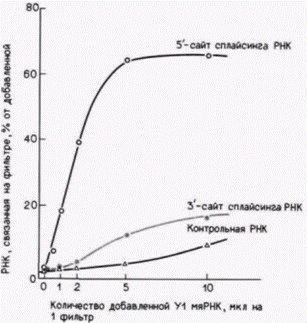
значают как мяРНП. Существует пять основных мяРНК – U1, U2, U4, U5 и U6, – каждая из которых присутствует в количестве от 2·105 до 2·106 копий на ядро и содержит от 56 до 217 нуклеотидов. Помимо этого в меньших количествах содержатся многочисленные другие мяРНК. Каждая мяРНП-частица содержит одну молекулу мяРНК в комплексе приблизительно с десятью белками (Maniatis, Reed, 1987). Первые предположения об участии мяРНП в сплайсинге вытекали из наблюдения, что 5'-концевой участок U1 мяРНК комплементарен 5’-сайту сплайсинга интронов (рис. 13.16; Lerner et al., 1980; Rogers, Wall, 1980). Последующие опыты (Mount et al., 1983; Tatei, 1984) показали, что очищенные U1 мяРНП специфически связываются с последовательностями 5'-сайтов сплайсинга в РНК-предшественниках (рис. 13.17), a U2 мяРНП специфически присоединяются к сайтам разветвления. Если U2 мяРНП смешать с предшественниками мРНК и затем добавить РНКазу, то единственной РНК, защищенной от гидролиза, окажется РНК в сайтах разветвления и в участках, окружающих эти сайты (потому что эти участки закрыты присоединенными U2 мяРНП) (Black et al., 1985). Другие мяРНП, вероятно U5, присоединяются к 3'-сайтам сплайсинга, так как эти мяРНП способны защищать 3'-сайт сплайсинга от расщепления РНКазой (Chabot et al., 1985). Полагают, что взаимодействие опосредовано узнаванием последовательности 3'-сайта белковым, а не рибонуклеиновым компонентом мяРНП (Tazi et al., 1986). Сплайсинг осуществляется только после того, как различные мяРНК войдут в контакт друг с другом и образуют на предшественнике мРНК сплайсосому. Гипотетическая схема сборки сплайсосомы представлена на рисунке 13.16. Когда U1 (и, возможно, U5) мяРНП связываются с предшественником мРНК, они позволяют присоединиться U2. Вероятно, после этого связываются U4, U5 и U6, хотя точный порядок пока не установлен (Grabowski et al., 1985; Black, Sleitz, 1986). Сплайсосома, подобно рибосоме, участвует в сближении различных РНК друг с другом и образует новые ковалентные связи. Конкретные субстраты, промежуточные продукты и катализаторы этих реакций пока неизвестны. Следует помнить также, что сплайсосома не встречается с «голыми» предшественниками мРНК. Сами молекулы пре-мРНК связаны с высококонсервативными основными белками (как показано на рис. 13.18), и эти белки сворачивают РНК в специфические структуры (Skoglund et al., 1983, 1986). Например, комплекс глобиновой яРНК с белком свернут таким образом, что определенные участки предшественника мРНК экспонированы в большей степени, чем другие участки (Patton, Chae, 1985). Поэтому сворачивание РНК этими белками позво-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.194______________ ГЛАВА 13______________________________________________________________________________
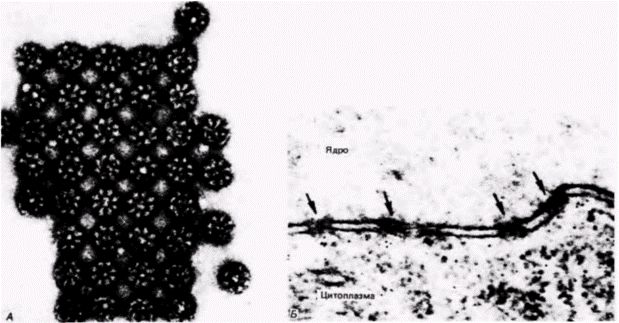
ляет с большей эффективностью узнавать определенные сайты сплайсинга, чем другие возможные сайты (свойство, которое становится важным, когда интроны простираются на 10 000 или более нуклеотидов). Некоторые из этих белков, связывающих яРНК, могут быть важны также и для сплайсинга. Группа таких белков (С-белки) обнаружена в сплайсосоме, и антитела против этих белков ингибируют разрезание РНК и образование разветвлений (Choi et al., 1986). Образование 3’-конца РНК Рибонуклеопротеидные комплексы, как полагают, важны также для определения положения, по которому предшественник мРНК разрезается на 3'-конце и к которому присоединяется полиаденилатный хвост. Первичный РНК-транскрипт содержит 3'-«хвостовую» последовательность, которая простирается далеко за точку, где оканчивается мРНК. Внутри этой области имеется последовательность ААУААА, необходимая для разрезания РНК на расстоянии 10-30 оснований ниже (с 3'-стороны) от этого сайта (Proudfoot, Brownlee, 1976). Мутации в этой последовательности нарушают формирование 3’-конца мРНК (Wickens, Stephenson, 1984; Orkin et al., 1985). Если сайт ААУААА в ß-глобиновой РНК человека изменен на ААЦААА, то 3'-конец новой РНК находится на расстоянии 900 нуклеотидов ниже обычного сайта полиаденилирования в пределах 15 нуклеотидов от следующего сайта ААТААА в 3'-фланкирующей области гена. Отрезание 3'-хвоста и полиаденилирование предшествуют сплайсингу, поэтому реакции сплайсинга проходят на полиаденилированном предшественнике мРНК. Кроме того, как мы видели ранее, в некоторых случаях имеются альтернативные сайты присоединения поли (А) (что наблюдается, например, при синтезе иммуноглобулинов). Что контролирует выбор одного из альтернативных поли(А)-сайтов и как присоединяются поли(А)-хвосты, в настоящее время неизвестно. Возможно, что в узнавании этой последовательности также участвуют мяРНП. Было показано, что антитела к мяРНП осаждают фрагмент РНК, содержащий последовательность ААУААА (Hashimoto, Sleitz, 1986), a U7 РНП необходима для разрезания на 3'-хвосте предшественника мРНК гистона Н3 у морского ежа (Strub, Birnstiel, 1987). Механизмы Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК_____________________________ 195 разрезания РНК-предшественников и присоединения поли(А)-хвостов еще предстоит выяснить. Имеется ряд примеров, когда транскрипция прекращается преждевременно и получается транскрипт без поли(А)-хвоста. Его отсутствие приводит к быстрому разрушению укороченной РНК. По-видимому, подобным образом регулируются по крайней мере два белка, контролирующие пролиферацию клеток. В покоящихся клетках инициируется транскрипция этих генов, но образуются неполные транскрипты. И лишь в растущих клетках синтезируются полные РНК (Bentley, Groudine, 1987; Bender et al., 1987). По крайней мере в одном из этих примеров мутации вблизи 3'-конца первого экзона (где может происходить преждевременная терминация) вызывают образование полных транскриптов в клетках, в которых в норме транскрипция оканчивается преждевременно (Gesarman et al., 1987). В этих случаях синтезируется белок, стимулирующий рост клеток, и клетки становятся злокачественными. Транспорт из ядраДо сих пор наиболее загадочным в процессинге РНК остается вопрос о том, как он связан с транспортом мРНК из ядра. Полагают, что мРНК выходит из ядра через ядерные поры. Строение такой поры и РНК, проходящая через нее, показаны на рис. 13.19. Если РНК транскрибируется на ядерном матриксе (как предполагалось в гл. 12), то вполне вероятно, что матрикс содержит также мяРНП, необходимые для ее процессинга. На ядерном матриксе были обнаружены предшественники ß-глобиновой мРНК кролика, не прошедшие сплайсинг или прошедшие его частично (Zeitlin et al., 1987), а также прошедшие частично сплайсинг предшественники овальбуминовой мРНК из клеток яйцевода курицы (Ciejek et al.. 1982). Ядерная оболочка со стороны цитоплазмы часто бывает усеяна рибосомами. Не могут ли рибосомы захватывать мРНК, когда она выходит из пор, и вытягивать мРНК из ядер по мере ее трансляции? Мы не можем дать утвердительный ответ на этот вопрос, однако существует по крайней мере один факт, свидетельствующий в пользу такой возможности. При определенной форме ß-талассемии человека мутация локализована в 39-м кодоне, который становится кодоном-терминатором. Естественно поэтому, что мутантный ген не синтезирует ß-глобин. Но этим не объяснить, почему в цитоплазме
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.196____________ ГЛАВА 13___________________________________________________________ наблюдается дефицит ß-глобиновой мРНК. Было обнаружено, что мутантная мРНК (синтезированная на клонированном гене in vitro) не уступает в стабильности ß-глобиновой мРНК дикого типа (Humphries et al., 1984), и было высказано предположение, что для выхода глобиновой мРНК из ядра, возможно, требуется ее трансляция на цитоплазматической стороне ядерной оболочки (Orkin, Kazazian, 1984). Когда эта трансляция прекращается (из-за образования кодона-терминатора), прекращается также транспорт мРНК из ядра. Многое предстоит еще выяснить, прежде чем мы сможем указать этапы, на которых происходит регуляция сплайсинга РНК в развитии. Это могло бы происходить при связывании мяРНП, образовании сплайсосомы, формировании 3’-конца или при транспорте РНК в цитоплазму. Была отмечена гетерогенность U1 класса мяРНП и высказано предположение, что у зародышей Xenopusсуществует не менее 7 различных типов U1 мяРНК и они характерны для различных периодов развития (Forbes et al., 1984). Авторы этой работы полагают, что различия в последовательностях мяРНК могли бы обусловливать присоединение различных белков, а это в свою очередь позволило бы осуществлять сплайсинг различных предшественников мРНК. Однако в настоящее время мы не можем указать на конкретный внутриядерный механизм селекции определенных специфических РНК-предшественников для процессинга в тканеспецифические цитоплазматические мРНК. РезюмеПроцессинг РНК должен рассматриваться как основной способ регуляции дифференциальной экспрессии генов. Экспериментальные данные свидетельствуют, что он определяет популяцию специфических для клеток мРНК при развитии морского ежа и, по-видимому, также мыши и крысы. Секвенирование ДНК и РНК показало, что дифференциальный процессинг РНК может приводить к возникновению различных белков в клетках разных типов (кальцитонин или CGRP; IgM или IgD) или в разные периоды в одной клеточной линии (мембрансвязанные и секретируемые IgM; миозины). Полагают также, что регуляция дифференциального процессинга ответственна за детерминацию полового фенотипа дрозофилы. Раскрытие механизма, лежащего в основе дифференциального процессинга РНК, возможно, позволит нам проникнуть в суть клеточной дифференцировки и эмбриональной детерминации. Литература Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК___________________________________ 197  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.198_______________ ГЛАВА 13_____________  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. | |||||||||||||||||||||||||||||||||||||||