Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.____________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК_________________________________ 179
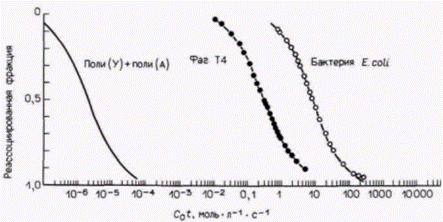
тем ниже скорость ее ренатурации с ДНК. Другими словами, если присутствует только один тип РНК (сложность = 1), то эта РНК-последовательность довольно быстро распределяется в реакционной смеси, найдя свой ДНК-гомолог. Однако если это же количество РНК содержит тысячу последовательностей (сложность = 1000), то каждая индивидуальная последовательность будет в тысячу раз более разбавленной и вероятность найти свой гомолог за то же самое время будет крайне мала. Двухцепочечные ДНК–РНК-гибриды можно легко отделить от негибридизованной РНК и затем вычислить долю радиоактивной РНК, которая нашла себе комплементарную ДНК Определение сложности обычно представляют графически в виде кривых C0t, причем С0 – исходная концентрация меченой нуклеиновой кислоты (в молях на 1 л), t – время (в секундах). Степень реассо-
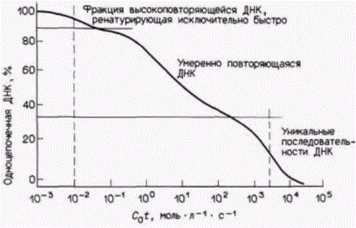
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.180_______________ ГЛАВА 13________________________________________________________________ циации должна быть функцией концентрации и времени. Поэтому долю ренатурированной РНК в процентах наносят на график относительно значения С0t (рис. 13.2). Опыты такого типа были проведены как с ДНК, так и с РНК; результаты показали, что некоторые последовательности ДНК представлены в геноме миллионы раз (фракция высокоповторяющихся последовательностей), некоторые последовательности представлены тысячи раз (фракция умеренных повторов) и, наконец, некоторые ДНК (такие, как гены, кодирующие ферменты) представлены единственной копией на гаплоидный геном (рис. 13.3) (Britten, Konne, 1968). Определенная с помощью этого метода сложность яРНК оказалась существенно большей, чем сложность мРНК из тех же клеток. Во-первых, определенные последовательности яРНК ассоциировали с ДНК очень быстро. Это означает, что они содержат РНК, транскрибированную с повторяющихся последовательностей ДНК. Цитоплазматическая мРНК из клеток бластулы морского ежа не содержит последовательности, которые гибридизуются с ДНК-повторами, тогда как приблизительно 25% яРНК, разрезанной на фрагменты размером около 1100 нуклеотидов, ассоциируют с ДНК при низких значениях С0t. Исходя из того, что у морского ежа средняя длина повторов в яРНК составляет примерно 300 оснований, можно получить оценку, согласно которой 70% молекул яРНК содержат по крайней мере одну повторяющуюся последовательность (Smith et al., 1974). В том случае, если РНК гибридизовали с очищенной неповторяющейся (уникальной) ДНК (чтобы повторы не усложняли картину гибридизации), сложность яРНК обычно в 4–20 раз превосходила сложность мРНК из того же органа или типа клеток (табл. 13.1). По оценкам, полученным в таких работах, у Таблица 13.1. Примерные кинетические характеристики и относительная сложность популяций мРНК и яРНК у различных видов
зародышей морского ежа только 10-20% яРНК входят в популяцию цитоплазматических мРНК. В печени крысы только 11% типов последовательностей яРНК становятся информационными РНК, а в культивируемых клетках насекомых эта оценка снижается до 5%. На основе приведенных данных можно прийти к выводу, что ядерные транскрипты содержат: 1) небольшую фракцию гяРНК, которая является предшественником мРНК клетки; 2) большую фракцию яРНК, которая очень быстро обменивается внутри ядра. Популяция молекул яРНК содержит многочисленные последовательности, отличающиеся от тех, которые проходят процессинг в мРНК Контроль развития на уровне процессинга яРНКИз предыдущего раздела мы узнали, что в геноме транскрибируется намного больше последовательностей по сравнению с теми, которые становятся мРНК. Этот вывод предполагает, что контроль дифференцировки может эффективно осуществляться после транскрипции путем дифференциального процессинга предшественников специфических мРНК. Недавние исследования на морском еже и крысе подтвердили это. Из клеток бластулы морского ежа была получена уникальная ДНК с помощью денатурации ДНК и выделения фракции, которая не реассоциировала при значении С0t, равном 200 (Kleene, Humphreys, 1977). Ядерная РНК из клеток бластулы связывала 15% этой ДНК. Сходным образом яРНК со стадии плутеуса также связывала только 15% этой ДНК, даже если ее добавляли в большом избытке. Поскольку только одна цепь ДНК комплементарна РНК, 15% гибридизованной ДНК соответствуют 30% генома. Следовательно, около 30% генома активно транскрибируют яРНК на стадии бластулы и около 30% генома активно транскрибируют яРНК на стадии плутеуса. Одинаковы ли эти два набора последовательностей ДНК? Ответ на этот вопрос был получен в опытах, в которых ядерные РНК со стадий бластулы и плутеуса смешивали и затем добавляли их смесь к денатурированной уникальной ДНК. Если эти последовательности отличаются полностью, то следует ожидать, что свяжется 30% ДНК (т.е. 60% генома будут кодировать совместный набор мРНК для бластулы и плутеуса). Если они идентичны, то следует ожидать, что свяжется 15% ДНК. Полученные результаты представлены на рис. 13.4. Смесь связывала только 15% ДНК. Последовательности яРНК бластулы и плутеуса присоединялись к одной и той же ДНК. В пределах ошибки эксперимента можно считать, что популяции яРНК в клетках бластулы и плутеуса идентичны. | ||||||||||||||