Билет 1 1 белки как основа жизни. Роль белков
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
4. Больному необходимо активировать окислительно-восстановительные и энергетические процессы. Какие витамины необходимо назначить в курсе лечения такого больного? Объясните почему? В окислительно- восстановительных процессах принимают участие витамины А, Е, К, В2, РР, С. Поэтому их нужно назначить такому больному. Билет 43 1)Строение ферментов… По строению ферменты могут быть: 1. однокомпонентные (простые белки), 2. двухкомпонентные (сложные белки). К ферментам - простым белкам – относятся пищеварительные ферменты (пепсин, трипсин). К ферментам – сложным белкам – можно отнести ферменты, катализирующие окислительно - восстановительные реакции. Для каталитической активности двухкомпонентных ферментов необходим дополнительный химический компонент, который называется кофактор, их могут играть как неорганические вещества (ионы железа, магния, цинка, меди и др.), так и органические вещества – коферменты (например, активные формы витаминов). Для работы ряда ферментов необходимы и кофермент, и ионы металлов (кофактор). Коферменты – низкомолекулярные органические вещества небелковой природы, связанные с белковой частью фермента временно и непрочно. В случае, когда небелковая часть фермента (кофермент) связана с белковой прочно и постоянно, то такую небелковую часть называют простетической группой. Белковая часть сложного белка-фермента называют апоферментом. Вместе апофермент и кофактор образуют холофермент. В процессе ферментативного катализа, принимает участие не вся белковая молекула, а лишь определенный участок – активный центр фермента. Активный центр ферментов представляет часть молекулы фермента, к которой присоединяется субстрат и от которой зависят каталитические свойства молекулы фермента. В активном центре фермента выделяют «контактный» участок – участок, притягивающий и удерживающий субстрат на ферменте благодаря своим функциональным группам и «каталитический» участок, функциональные группы которого непосредственно участвуют в каталитической реакции. У некоторых ферментов, кроме активного центра, имеется еще «другой» центр – аллостерический. С аллостерическим центром взаимодействуют различные вещества (эффекторы), чаще всего различные метаболиты. Соединение этих веществ с аллостерическим центром приводит к изменению конформации фермента (третичной и четвертичной структуры). Активный центр в молекуле фермента либо создается, либо он нарушается. В первом случае реакция ускоряется, во втором случае тормозится. Поэтому аллостерический центр называют регуляторным центром фермента. Ферменты, имеющие в своей структуре аллостерический центр, называются регуляторными или аллостерическими. В основу теории механизма действия ферментов положено образование фермент-субстратного комплекса. Механизм действия фермента:
2. на второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (En) и субстрат (S) начинают сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или энергетического барьера данной химической реакции. Энергия активации – энергия, необходимая для перевода всех молекул 1 моля S в активированное состояние при данной температуре. Для каждой химической реакции существует свой энергетический барьер. Благодаря образованию фермент-субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа. 3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-субстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне. Кофактор - небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия). Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой. Роль кофактора в основном сводится к следующему:
Активаторами могут быть: 1) кофакторы, т.к. они важные участники ферментативного процесса. Например, металлы, входящие в состав каталитического центра фермента: амилаза слюны активна в присутствии ионов Са, лактатдегидрогеназа (ЛДГ) – Zn, аргиназа – Mn, пептидаза – Mg и коферменты: витамин С, производные различных витаминов (НАД, НАДФ, ФМН, ФАД, КоАSH и др.). Они обеспечивают связывание активного центра фермента с субстратом. 2) анионы также могут оказывать активирующее влияние на активность фермента, например, анионы Сl- активируют слюнную амилазу; 3) активаторами могут служить также вещества, создающие оптимальное значение рН среды для проявления ферментативной активности, например, НСl для создания оптимальной среды желудочного содержимого для активации пепсиногена в пепсин; 4) активаторами являются также вещества, переводящие проферменты в активный фермент, например, энтерокиназа кишечного сока активирует превращение трипсиногена в трипсин; 5) активаторами могут быть разнообразные метаболиты, которые связываются с аллостерическим центром фермента и способствуют формированию активного центра фермента. Ингибиторы - это вещества, которые тормозят активность ферментов. Различают два основных типа ингибирования: необратимое и обратимое. При необратимом ингибировании - ингибитор прочно (необратимо) связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким образом, могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.). Обратимое ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться. Обратимое ингибирование бывает 2-х типов: конкурентное и неконкурентное. При конкурентном ингибировании обычно субстрат и ингибитор очень похож по химическому строению. При этом виде ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с активным центром фермента. Они конкурируют друг с другом за место в активном центре фермента. Классический пример, конкурентного ингибирование – торможение действия сукцинатдегидрогеназы малоновой кислотой. Неконкурентные ингибиторы связываются с аллостерическим центром фермента. Вследствие этого происходят изменения конформации аллостерического центра, которые приводят к деформации каталитического центра фермента и снижению ферментативной активности. Часто аллостерическими неконкурентными ингибиторами выступают продукты метаболизма. Лекарственные свойства ингибиторов ферментов (Контрикал, Трасилол, Аминокапроновая кислота, Памба). Контрикал (апротинин) применяют для лечения острого панкреатита и обострения хронического панкреатита, острого панкреонекроза, острых кровотечений. 2)Обмен безазотист.остат.ак…. За сутки у человека распадаются примерно 100г АК. Катаболизм всех АК сводится к образованию шести веществ, вступающих в общий путь катаболизма: ПВК, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат и ЩУК. Эти вещества окисляются в ЦТК для образования АТФ или используются для синтеза глюкозы и кетоновых тел. Гликогенные аминокислоты - АК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре). Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Смешанные (гликкетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел. 3.____________ 4. В стационар поступил больной в активной стадии атеросклероза. В какой фракции липопротеидов крови больше всего содержится холестерин? Больше все холестерина содержится в липопротеинах низкой плотности (ЛПНП), их еще называют атерогенными. Билет 44 1)Понятие об обмене в-в и метабол. Путях.. Метаболизм или обмен веществ — набор химических реакций, которые возникают в живом организме для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды. Метаболизм обычно делят на две стадии: в ходе катаболизма сложные органические вещества деградируют до более простых; в процессах анаболизма с затратами энергии синтезируются такие вещества, как белки, сахара, липиды и нуклеиновые кислоты. Обмен веществ происходит между клетками организма и межклеточной жидкостью, постоянство состава которой поддерживается кровообращением: за время прохождения крови в капиллярах через проницаемые стенки капилляров плазма крови 40 раз полностью обновляется с интерстициальной жидкостью. Серии химических реакций обмена веществ называют метаболическими путями, в них при участии ферментов одни биологически значимые молекулы последовательно превращаются в другие. Основные метаболические пути и их компоненты одинаковы для многих видов. Например, некоторые карбоновые кислоты, являющиеся интермедиатами цикла трикарбоновых кислот присутствуют во всех организмах Катаболические, анаболические пути. Ферментативное расщепление основных питательных веществ, а именно углеводов, жиров и белков, происходит в клетке через ряд последовательных ферментативных реакций. Катаболизм основных питательных веществ включает три главные стадии. На первой стадии крупные пищевые молекулы расщепляются на составляющие их основные строительные блоки. Полисахариды, например, расщепляются до гексоз или пентоз, липиды — до жирных кислот, глицерина и других компонентов, белки — до аминокислот, которых имеется 20 видов. На второй стадии большое число продуктов, образовавшихся на первой стадии, превращается в более простые молекулы, число типов которых сравнительно невелико. Так, гексозы, пентозы и глицерин, разрушаясь, превращаются сначала в трехуглеродный фосфорилированный сахар — глицеральдегид-3-фосфат, а затем расщепляются далее до единственной двууглеродной формы — ацетильной группы, входящей в состав ацетил- КоА. Двадцать различных аминокислот также дают при расщеплении лишь несколько конечных продуктов, а именно ацетил-КоА, α-кетоглутарат, сукцинат, фумарат и оксалоацетат. Продукты, образовавшиеся на второй стадии, вступают в третью стадию, которая для них всех является общей и на которой они в конечном счете окисляются до CO2 и воды. Процесс анаболизма также включает три стадии. Исходными веществами, или строительными блоками служат для него соединения, поставляемые третьей стадией катаболизма. Таким образом, третья стадия катаболизма является в то же время первой, исходной, стадией анаболизма. Синтез белка, например, начинается на этой стадии с α - кетокислот, являющихся предшественниками α -аминокислот. На второй стадии анаболизма α -кетокислоты аминируются аминогруппой доноров с образованием α -аминокислот, а на третьей, заключительной, стадии аминокислоты объединяются в пептидные цепи. Продукты метаболизма выводятся с мочой, фекалиями, выдыхаемым воздухом и потом. Специфические вещества задерживаются или удаляются из организма в той степени, в какой это необходимо для поддержания гомеостаза, при этом вместе со шлаковыми продуктами распада выводятся потенциально полезные вещества. Небольшие количества этих веществ выводятся из организма в виде кишечных газов, волос, ногтей, десквамированного эпителия кожи, кожного сала, ушной серы, слизи из полости носа и влагалища, слюны, слез, семенной жидкости и менструальных выделений. Уровни потерь этих веществ опубликованы в работах. 2)Обмен фенилаланина и тирозина… Фенилаланин – незаменимая аминокислота, так как в клетках животных не синтезируется ее бензольное кольцо. Метаболизм метионина осуществляется по 2-м путям: включается в белки или превращается в тирозин под действием специфической монооксигеназы – фенилаланингидроксилазы. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений как катехоламины, тироксин, меланин и др. В щитовидной железе из тирозина синтезируются гормоны тироксин и трийодтиронин. В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов. Промежуточным продуктом их синтеза является ДОФА. Однако в отличие от меланоцитов, гидроксилирование тирозина осуществляется под действием тирозингидроксилазы, которая является Fe2+- зависимым ферментом, и его активность регулирует скорость синтеза катехоламинов. 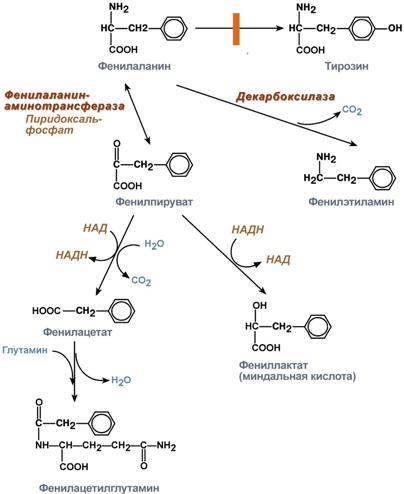 3. Количественное определение холестерина в ЛВП Фракции липопротеи-нов крови (ХМ, ЛОНП, ЛНП) осажда-ют раствором фосфор-но-вольфрамовой кис-лоты и хлорида магния. В надосадочной жидкости после цен-трифугирования остаются ЛВП, в которых определяется ХС фер-ментативным методом (см.выше). Расчет ве-дут по формуле: ХС(ЛВП) (ммоль/л) = (Ацентр/ Аст) х 1,29 Аст = 0,4 это степень поглощения стандарт-ного раствора ХС с конц. 1,29 ммоль/л (0,5 г ХС в 1 л раствора). ХС-ЛВП используется для определения коэффициента атерогенности, по которому судят о вероятности атеросклероза (см. выше) 4. У больных с хроническими воспалительными процессами различной локализации обычно повышено содержание пировиноградной кислоты. Какие пути синтеза пирувата в организме вы знаете? Что может привести к накоплению ее в организме? Пируват синтезируется в результате окисления глюкозы. Накопления пирувата и лактата в крови является одним из признаков воспаления, протекающего в тканях. Накопление пирувата может быть результатом недостаточности витаминов пируватдегидрогеназного комплекса, особенно В1, а так же гипоксии, вызванной нарушением работы сердечно-сосудистой и легочной систем. Билет 45 1)Вит С… 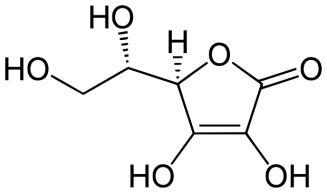 Витамин С (аскорбиновая кислота). Источники витамина С - свежие фрукты, овощи, зелень. Суточная потребность человека в витамине С составляет 50-75 мг. Биологические функции. Образование коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов. Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты. Витамин С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам нейтрализует супероксид-анион радикал до перекиси водорода. Клинические проявления недостаточности витамина С. Недостаточность аскорбиновой кислоты приводит к заболеванию, называемому цингой (скорбут). Цинга, возникающая у человека при недостаточном содержании в пищевом рационе свежих фруктов и овощей, описана более 300 лет назад, со времени проведения длительных морских плаваний и северных экспедиций. Это заболевание связано с недостатком в пище витамина С. Болеют цингой только человек, приматы и морские свинки. Главные проявления авитаминоза обусловлены в основном нарушением образования коллагена в соединительной ткани. Вследствие этого наблюдают разрыхление дёсен, расшатывание зубов, нарушение целостности капилляров (сопровождающееся подкожными кровоизлияниями). Возникают отёки, боль в суставах, анемия. 2)Биосинтез белков… Трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой. Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин). Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих. Процесс трансляции разделяют на
3. Определение глюкозы в моче качественной реакцией Бенедикта. Проба основана на редуцирующих свойствах глюкозы. Глюкоза восстанавливает гидроксид меди до гидрата закиси меди. Отсутствует Появление глюкозы в моче: сахарный диабет, кома диабетическая, с. Иценко-Кушинга, мальабсорбция глюкозы-галактозы, гликоглицинурия, гемохроматоз, острый тяжелый панкреатит, акромегалия, сепсис, с. де Тони-Дебре-Фанкоми, тиреотоксикоз, кишечный токсикоз, цистиноз. Определение кетоновых тел в моче. Кетоновые тела (ацетоацетат, оксибутират, ацетон) в кислой среде с нитропруссидом натрия дает красное окрашивание. Отсутствуют Кетонурия является следствием кетонемии и диагностическим тестом при сахарном диабете. Ацетил-КоА образуется в результате окисления жирных кислот, при диабете накапливается в клетках, так как его окисление в ЦТК снижается. Избыток ацетил КоА идет на синтез кетоновых тел, что ведет к кетонемии и кетонурии. 4. В лаборатории исследовали мочу и кровь больного для определения желчных пигментов. В крови установлено высокое содержание прямого и непрямого билирубина. В моче увеличено количество уробилиногена. Для какой формы желтухи характерна подобная картина? Такие показатели характерны для гемолитической желтухи. |
