Билет 1 1 белки как основа жизни. Роль белков
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
2)Понятие о белках крови… Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой. Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. 2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови. 3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4– раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе. крови. 3) Количественное определение витамина С в моче. Количество аскорбиновой кислоты определяется титриметрически по количеству 2,6-дихлорфенолиндо-фенола, пошедшего на титрование, и рассчитывается на суточное количество мочи. 2,6-дихлорфенолиндофе-нол (синего цвета) восстанавливается и обесцвечивается витамином С. 20 – 30 мг аскорбиновой кислоты за сутки Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей. ДИАГНОСТИКА ГИПОВИТАМИНОЗА С: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается. 4)У больного в моче методом хроматографии обнаружена фенилпировиноградная кислота, в крови фенилаланин (0,4 г/л). Встречается ли фенилпировиноградная кислота в моче здоровых людей? Каково происхождение этого соединения? Для какого заболевания типичны подобные данные биохимического анализа мочи и крови? У здоровых людей фенилпировиноградная кислота в моче отсутствует. Ее наличие указывает на наследственное заболевание фенилкетонурия, при котором нарушается гидроксилирование аминокислоты фенилаланина. В этом случае происходит превращение ее в фенилпируват и фениллактат, которые и обнаруживаются в моче. Билет 5 1)Углеводосод.белки… Углеводсодержащие белки (гликопротеины и протеогликаны). Простетическая группа гликопротеинов может быть представлена моносахаридами (глюкозой, галактозой, маннозой, фруктозой, 6-дезоксигалактозой), их аминами и ацетилированными производными аминосахаров (ацетилглюкоза, ацетилгалактоза. На долю углеводов в молекулах гликопротеинов приходится до 35%. Гликопротеины преимущественно глобулярные белки. Углеводный компонент протеогликанов может быть представлен несколькими цепями гетерополисахаридов. Биологические функции гликопротеинов: 1. транспортная (белки крови глобулины транспортируют ионы железа, меди, стероидные гормоны); 2. защитная: фибриноген осуществляет свертывание крови; б. иммуноглобулины обеспечивают иммунную защиту; 3. рецепторная (на поверхности клеточной мембраны расположены рецепторы, которые обеспечивают специфическое взаимодействие).4. ферментативная (холинэстераза, рибонуклеаза); 5. гормональная (гормоны передней доли гипофиза – гонадотропин, тиреотропин). Биологические функции протеогликанов: гиалуроновая и хондроитинсерная кислоты, кератинсульфат выполняют структурную, связующую, поверхностно-механическую функции. 2)Ферм-ты крови…. Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток ≪вымываются≫ в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей. Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфераза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы. Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствуето поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5. 3) Определение холестеринового индекса атерогенности. К=Х – Х ЛВП ХЛВП Здоровые 20 – 30 лет 2 – 2.5 Старше 30 лет 3 – 3.5 Больные атеросклерозом 4 - 7 Индекс атерогенности является прогностическим показателем развития атеросклероза. 4) Ребенок поступил в детскую больницу с явлениями отсталости умственного развития. При исследовании мочи выявлено наличие фенилпировиноградной кислоты. Какая пища нужна этому ребенку? Необходимо полностью исключить фенилаланин из рациона. Ребенка переводят на искусственное питание. Билет 6 1)Половые гормоны… Женские половые гормоны. Основным местом синтеза женских половых гормонов – эстрогенов – являются яичники и желтое тело. В настоящее время открыты 2 группы женских половых гормонов, различающихся своей химической структурой и биологической функцией: эстрогены (главный представитель – эстрадиол) и прогестины (главный представитель – прогестерон). Наиболее активный эстроген – эстрадиол, синтезируется преимущественно в фолликулах; два остальных эстрогена являются производными эстрадиола и синтезируются также в надпочечниках и плаценте. Все эстрогены состоят из 18 атомов углерода. Секреция эстрогенов и прогестерона яичником носит циклический характер, зависящий от фазы полового цикла: в первой фазе цикла синтезируются в основном эстрогены, а во второй – преимущественно прогестерон. Основная биологическая роль эстрогенов и прогестерона, синтез которых начинается после наступления половой зрелости, заключается в обеспечении репродуктивной функции организма женщины. В этот период они вызывают развитие вторичных половых признаков и создают оптимальные условия, обеспечивающие возможность оплодотворения яйцеклетки после овуляции. Прогестерон выполняет в организме ряд специфических функций: подготавливает слизистую оболочку матки к успешной имплантации яйцеклетки в случае ее оплодотворения, а при наступлении беременности основная роль – сохранение беременности; оказывает тормозящее влияние на овуляцию и стимулирует развитие ткани молочной железы. Эстрогены оказывают анаболическое действие на организм, стимулируя синтез белка. Мужские половые гормоны. Биосинтез андрогенов осуществляется главным образом в семенниках и частично в яичниках и надпочечниках Биологическая роль андрогенов в мужском организме в основном связана с дифференцировкой и функционированием репродуктивной системы, причем в отличие от эстрогенов андрогенные гормоны уже в эмбриональном периоде оказывают существенное влияние на дифференцировку мужских половых желез, а также других тканей, определяя характер секреции гонадотропных гормонов у взрослых. Во взрослом организме андрогены регулируют развитие мужских вторичных половых признаков, сперматогенез в семенниках и т.д. 2)Декарбоксил-е ак… Процесс отщепления карбоксильной группы аминокислот в виде CO2 получил название декарбоксилирования. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина,триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование ряда других аминокислот. Биогенные амины — вещества, обычно образующиеся в организме животных или растений из аминокислот при их декарбоксилировании (удалении карбоксильной группы) ферментами декарбоксилазами и обладающие высокой биологической активностью. К биогенным аминам относятся дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин и многие другие соединения. В организме животных многие биогенные амины выполняют роль гормонов и нейромедиаторов. Разлагаются в организме при участии ферментов аминоксидаз. Реакции декарбоксилирования являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента. 3) Количественное определение активности амилазы сыворотки крови амилокластическим методом. Амилаза сыворотки крови гидролизует крахмал в течение 60 минут. Остаток крахмала выявляется качественной реакцией с йодом. Активность амилазы определяется по разности окраски между контролем и опытом на ФЭКе. 16 – 30 мг крахмала, гидролизуемого за 1 час 1 мл сыворотки крови. Определение активности амилазы сыворотки крови является диагностическим тестом при заболеваниях поджелудочной железы. Фермент обладает небольшой молекулярной массой и размерами, легко проникает в кровь из поджелудочной железы и кишечника, фильтруется в мочу. Увеличение активности амилазы крови наблюдается при заболеваниях поджелудочной и околоушной желез, диабетическом кетоацидозе, заболеваниях желчных путей. 4. В инфекционное отделение поступил больной с предположительным диагнозом вирусный гепатит. Биохимическое определение каких пигментов мочи поможет врачу в диагностике этого заболевания? Причиной вирусного гепатита является разрушение клеток печени под влиянием вирусов. Это приводит к повышению в крови общего и прямого билирубина, который через почки попадает в мочу. Именно его появление в моче вместе с уменьшением уробилина поможет диагностировать это заболевание. Билет 7 1)Нуклеопротеины… Нуклеопротеины - сложные белки, в состав которых входит белок (протамин или гистон), небелковая часть представлена нуклеиновыми кислотами (НК): дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеиновой кислотой (РНК). Протамины и гистоны – белки с резко выраженными основными свойствами, т.к. они содержат более 30% арг и лиз. Нуклеиновые кислоты (НК) - это длинные полимерные цепи, состоящие из многих тысяч мономерных единиц, которые соединяются между собой 3`,5`- фосфоди-эфирными связями. Мономером НК является мононуклеотид, который состоит из азотистого основания, пентозы и остатка фосфорной кислоты. Азотистые основания бывают пуриновые (А и Г) и пиримидиновые (Ц, У, Т). В качестве пентозы выступает β– Д- рибоза или β –Д- дезоксирибоза. Азотистое основание соединено с пентозой N-гликозидной связью. Пентоза и фосфат связаны друг с другом сложноэфирной связью между –ОН группой, расположенной у С5’-атома пентозы, и фосфатом. Виды нуклеиновых кислот: 1. ДНК содержит А, Г, Т и Ц, дезоксирибозу и фосфорную кислоту. ДНК находится в ядре клетки и составляет основу сложного белка хроматина. 2. РНК содержит А, Г, У и Ц, рибозу и фосфорную кислоту. Различают 3 вида РНК: а) м-РНК (информационная или матричная) – копия участка ДНК, содержит информацию о структуре белка; б) р-РНК образует скелет рибосомы в цитоплазме, выполняет важную роль при сборке белка на рибосоме в процессе трансляции; в) т-РНК участвует в активации и транспорте АК к рибосоме, локализована в цитоплазме. НК имеют первичную, вторичную и третичную структуры. Первичная структура НК одинакова для всех видов – линейная полинуклеотидная цепь, в которой мононуклеотиды связаны 3’, 5’-фосфодиэфирными связями. Каждая полинуклеотидная цепь имеет 3’ и 5’ , эти концы заряжены отрицательно. Вторичная структура ДНК представляет собой двойную спираль. ДНК состоит из 2-х цепей, закрученных в спираль вправо вокруг оси. Виток спирали = 10 нуклеотидов, что составляет в длину 3,4 нм. Обе спирали антипараллельны. Третичная структура ДНК. Это результат дополнительного скручивания в пространстве молекулы ДНК. Это происходит при взаимодействии ДНК с белком. При взаимодействии с октамером гистона двойная спираль накручивается на октамер, т.е. превращается в суперспираль. Вторичная структура РНК – полинуклеотидная нить, изогнутая в пространстве. Эта изогнутость обусловлена образованием водородных связей между комплементарными азотистыми основаниями. У т-РНК вторичная структура представлена «клеверным листом», в котором различаю комплементарные и некомплементарные участки. Вторичная структура р-РНК – спираль одиночной изогнутой РНК, а третичная – скелет рибосомы. Поступая из ядра в ЦЗ, м-РНК образует со специфическими белками – информомерами комплексы (третичная структура м-РНК) и называются информосомами. 2)Обмен галактозы,фруктозы,… Нарушения, связанные с недостаточностью ферментов, которые принимают участие в переваривании и всасывании УВ. 1. Непереносимость лактозы: а) врожденная. Дефект по лактазе в просвете тонкого кишечника. Большой осмотический эффект невсосавшейся лактозы вызывает приток жидкости в тонкий кишечник, поэтому клиническими симптомами являются вздутие живота, тошнота, судороги, боль и водная диарея. Наследуется по аутосомно-рецессивному типу. б) приобретенная (временная). Может быть, и у взрослых вследствие инфекционных заболеваний или интенсивного лечения антибактериальными препаратами. 2. Нарушения обмена фруктозы: а) Фруктоземия (наследственная непереносимость фруктозы). Недостаточность фермента кетозо-1- фосфат-альдолазы приводит к резкому увеличению концентрации фруктозо-1-фосфата в клетках печени, вследствие чего развиваются хроническая недостаточность функций печени и почек, гипогликемия, диарея, рвота, боли в животе. б) Эссенциальная фруктозурия. Причина: недостаток фруктокиназы. Следствие: нарушение фосфорилирования фруктозы приводит к повышению содержания фруктозы в крови и аномальному выведению фруктозы с мочой. Это нарушение не вызывает патологических симптомов. 3. Нарушения обмена галактозы: а) Галактоземия. Причина: недостаток фермента гексозо-1-фосфатуридилтрансфераза печени. Больные дети плохо растут, прием молока вызывает рвоту и понос. Происходит увеличение печени и желтуха. При этом заболевании увеличивается концентрация галактозы и галактозо-1-фосфата. Галактоземия сопровождается галактозурией. У детей галактоземия приводит к умственной отсталости и катаракте хрусталика. Определяющим диагностическим критерием служит отсутствие в эритроцитах гексозо-1-фосфатуридилтрансферазы. б) Недостаток галактокиназы. Происходит накопление галактозы и ее превращение в галактитол. Следствие: раннее развитие катаракты 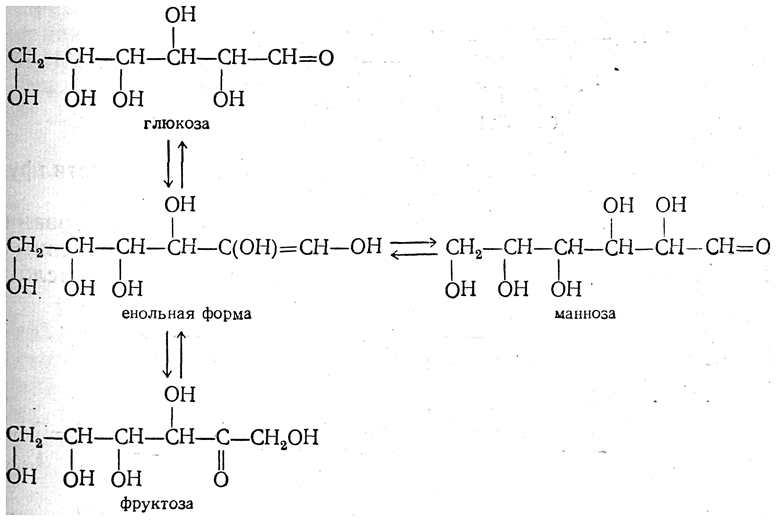 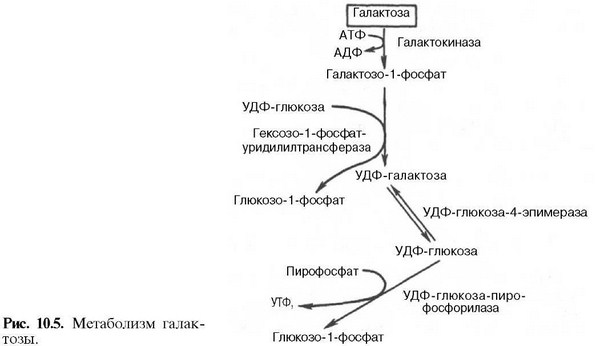 3) Количественное определение содержания ЛПНП в сыворотке крови. ЛПНП способны осаждаться в присутствии хлорида кальция и гепарина. По степени помутнения раствора судят о концентрации ЛПНП в сыворотке крови. 3 – 4.5 г/л Увеличение ЛПНП наблюдается при наследственном холестеринозе, сахарном диабете, нефрозах, гепатитах, хроническом алкоголизме, ксантоматозе, ожирении. 4. При исследовании крови больного в сыворотке обнаружено 0,2 г/л мочевой кислоты. Сколько мочевой кислоты содержится в крови здоровых людей? Могут ли данные этого анализа быть надежным критерием для распознавания заболевания? Каков диагноз заболевания? Каковы биохимические нарушения типичные для данного заболевания? Концентрация мочевой кислоты в крови человека в норме от 0,06 до 0,07 г/л у мужчин и от 0,05 до 0,06 г/л у женщин. Гиперурикемия является основным симптомом подагры, а также наблюдается при синдроме Леша-Нихана – врожденном дефиците фермента гуанингипоксантинфосфорибозилтрансферазы. Подъем мочевой кислоты может быть следствием усиленного распада тканевых нуклеотидов (патологическое изменение крови, миелоз). Это явление носит название «вторичной» подагры. Некоторое нарастание мочевой кислоты наблюдается при диете, богатой пуринами. |
