|
|
Билет 1 1 белки как основа жизни. Роль белков
Билет 8
1)Глюкагон и инсулин…
Инсулин, получивший свое название от наименования панкреатических островков. Молекула инсулина, содержащая 51 аминокислотный остаток, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. В физиологической регуляции синтеза инсулина доминирующую роль играет концентрация глюкозы в крови. Так, повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках, а снижение ее содержания, наоборот,– замедление секреции инсулина. Этот феномен контроля по типу обратной связи рассматривается как один из важнейших механизмов регуляции содержания глюкозы в крови. При недостаточной секреции инсулина развивается специфическое заболевание – сахарный диабет. Физиологические эффекты инсулина: Инсулин — единственный гормон, снижающий содержание глюкозы в крови, это реализуется через: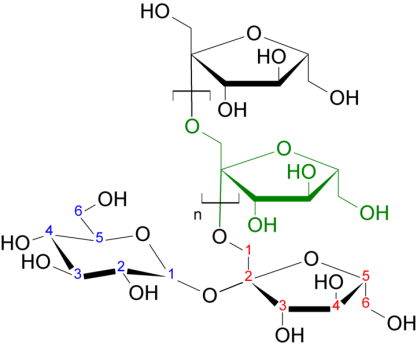
усиление поглощения клетками глюкозы и других веществ;
активацию ключевых ферментов гликолиза;
увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген;
уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из различных веществ
Анаболические эффекты
усиливает поглощение клетками аминокислот (особенно лейцина и валина);
усиливает транспорт в клетку ионов калия, а также магния и фосфата;
усиливает репликацию ДНК и биосинтез белка;
усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное — мобилизация жиров.
Антикатаболические эффекты
Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном. Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485. Первичная структура молекулы глюкагона следующая:
NH2-His-Ser-Gln-Gly-Thr-Phe- Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser- Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu- Met-Asn-Thr-COOH
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена. Глюкагон оказывает сильное инотропное и хронотропное действие на миокард вследствие увеличения образования. Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений
2)Биосинтез пирим.нукл….
Синтез пуринов и пиримидинов приводит к монофосфатам, соответственно ИМФ (IMP] и УМФ (UMP). Из этих двух предшественников синтезируются все другие нуклеотиды. Синтез пуриновых нуклеотидов осуществляется из инозинмонофосфата [ИМФ (IMP)]. Его основание гипоксантин превращается в две стадии соответственно в аденин или гуанин. Образующиеся нуклеозидмонофосфаты АМФ (AMP) и ГМФ (GMP) переходят в дифосфаты АДФ(ADP) и ГДФ (GDP) под действием нуклеозидфосфаткиназ и, наконец, фосфорилируютсянуклеозиддифосфаткиназами до трифосфатов АТФ (АТР) и ГТФ (GTP). Нуклеозидтрифосфаты служат строительными блоками для РНК (RNA) или функционируют в качестве коферментов. Преобразование рибонуклеотидов в дезоксирибонуклеотиды происходит на стации дифосфатов и катализируется нуклеозиддифосфат-редуктазой. Пути биосинтеза пиримидиновых нуклеотидов: прежде всего исходный УМФ фосфорилируется до ди-, а затем трифосфата УТФ. УТФ превращается цитидинтрифосфат-синтазой (CTP-синтаза) в ЦТФ. 2'-Дезоксирибоза, структурный элемент ДНК, не синтезируется в виде свободного сахара, а образуется на стадии дифосфата при восстановлении ρибонуклеозиддифосфатов. Такое восстановление — сложный процесс, в котором участвует несколько белков. Необходимые восстановительные эквиваленты поставляются НАДФН (NADPH). Тем не менее, они не переносятся непосредственно от кофермента к субстрату, а проходит прежде всего через ряд окислительно-восстановительных реакций. На первой стадии тиоредоксинредуктаза восстанавливает с помощью связанного с ферментом флавинадениндинуклеотида небольшой белок, тиоредоксин. При этом дисульфидный мостик в тиоредоксине расщепляется. Образующиеся SH-группы снова восстанавливают каталитически активный дисульфидный мостик в нуклеозиддифосфат-редуктазе («рибонуклеотид-редуктаза»). Свободные SH-группы являются действенными донорами электронов для восстановления рибонуклеотиддифосфатов. Рибонуклеотид-редуктаза эукариот представляет собой тетрамер, состоящий из двух R1- и R2 -субъединиц. Кроме упомянутого дисульфидного мостика, в ферменте во время реакции образуется тирозин-радикал, генерирующий радикал в субстрате. Последний отщепляет молекулу воды и вследствие этого переходит в радикал-катион. При последующем восстановлении образуется остаток дезоксирибозы и регенерируется тирозиновый радикал. Процесс регуляции рибонуклеотид-редуктазы имеет довольно сложный механизм. Субстратная специфичность и активность фермента контролируются двумя аллостерическими центрами связывания R1-субъединицы. АТФ и дАТФ соответственно повышают и уменьшают активность редуктазы, связываясь с центром а. С центром б взаимодействует другой нуклеотид, изменяющий в результате связывания субстратную специфичность фермента.
3, Количественное определение витамина С в моче. Количество аскорбиновой кислоты определяется титриметрически по количеству 2,6-дихлорфенолиндо-фенола, пошедшего на титрование, и рассчитывается на суточное количество мочи. 2,6-дихлорфенолиндофе-нол (синего цвета) восстанавливается и обесцвечивается витамином С. 20 – 30 мг аскорбиновой кислоты за сутки Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей.
ДИАГНОСТИКА ГИПОВИТАМИНОЗА С: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается.
4) В клинику нервных болезней поступил больной с диагнозом прогрессирующая мышечная дистрофия. В крови обнаружено высокое содержание креатина и снижение уровня креатинина. Какова биологическая роль креатина? Почему у больного снижено содержание креатинина в моче?
В мышцах происходит синтез из креатина креатинфосфата, который используется в первые секунды работы мышц. Креатинин является продуктом деградации креатина. В норме креатинин выделяется из организма с мочой. Выделение креатина с мочой наблюдается при потере мышечной массы.
Билет 9
1)Гормоны щит.железы…
Тироксин и трийодтиронин – основные гормоны фолликулярной части щитовидной железы. Помимо этих гормонов (биосинтез и функции которых будут рассмотрены ниже), в особых клетках – так называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы, обеспечивающий постоянную концентрацию кальция в крови. Он получил название ≪кальцитонин≫. Биологическое действие кальцитонина прямо противоположно эффекту паратгормона: он вызывает подавление в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Из L-тиронина легко синтезируется гормон щитовидной железы тироксин, содержащий в 4 положениях кольцевой структуры йод Биологическое действие гормонов щитовидной железы распространяется на множество физиологических функций организма. В частности, гормоны регулируют скорость основного обмена, рост и дифференцировку тканей, обмен белков, углеводов и липидов, водно-электролитный обмен, деятельность ЦНС, пищеварительного тракта, гемопоэз, функцию сердечнососудистой системы, потребность в витаминах, сопротивляемость организма инфекциям и др. Гипофункция щитовидной железы в раннем детском возрасте приводит к развитию болезни, известной в литературе как кретинизм. Помимо остановки роста, специфических изменений кожи, волос, мышц, резкого снижения скорости процессов обмена, при кретинизме отмечаются глубокие нарушения психики; специфическое гормональное лечение в этом случае не дает положительных результатов. Повышенная функция щитовидной железы (гиперфункция) вызывает развитие гипертиреоза
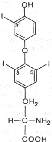
L-тироксин L-3,5,3'-трийодтиронин
2)Аэробный распад глюкозы…
Аэробный путь окисления глюкозы и его энергетика. Аэробный путь окисления глюкозы происходит в 3 этапа: 1. окисление молекулы глюкозы до 2 молекул пирувата; 2. окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА); 3. реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. 1-ый этап. Окисление молекулы глюкозы до 2 молекул пирувата - это первые 10 реакций гликолиза. Суммарная реакция 1 этапа:
Глюкоза + 2 НАД++ 2 АДФ → 2 пирувата + 2 НАДН + Н+ + 2 АТФ
2-ой этап. Окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетилКоА) происходит в матриксе митохондрий и осуществляется мультиферментным комплексом пируватдегидрогеназой. В его состав входят 3 фермента и 5 коферментов: 1. Пируватдекарбоксилаза – кофермент тиаминпирофосфат (активная форма витамина В1). 2. Дегидролипоилацетилтрансфераза – кофермента: в активном центре – липоевая кислота (витаминоподобное вещество), из матрикса митохондрий используется Коэнзим А (КоА
SH). 3. Дигидролипоилдегидрогеназа – коферменты: в активном центре – ФАД, из матрикса митохондрий используется – НАД. Суммарная реакция:
2 Пируват + 2 НАД+ + КоА → 2 ацетил-КоА + 2 НАДН + Н+
Каждый восстановленный НАД в митохондриях отдает протоны и электроны в полную ц.п.э., где образуется 2 х 3 АТФ = 6 АТФ. Таким образом, ценность второго этапа – 6 АТФ. Эти реакции происходят только в аэробных условиях! 3-ий этап. Реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. Следовательно, энергетический выход третьего этапа (в расчете на молекулу глюкозы) – 2 х 12 АТФ = 24 АТФ . Энергетическая ценность аэробного окисления глюкозы: 1 этап – 8 (6) АТФ 2 этап – 6 АТФ 3 этап – 24 АТФ Итого: 38 (36) АТФ (разница в 2 АТФ зависит от челнока, который переносит протоны и электроны из цитозоля от НАДН, образованного в 6-ой реакции гликолиза в митохондрии в ц.п.э.). Аэробное окисление глюкозы является главным источником энергии для большинства клеток организма
3) Наличие свободной HCl в желудочном содеожимом.Определение свободной HCl в желудочном содержимом. Для реакции на свободную HCl используют бумагу Конго. В сильно кислой среде Конго имеет синюю окраску, а в слабо кислой, нейтральной и щелочной – красную.
Титрование желудочного содержимого 0.1N раствором NaOH в присутствии фенолфталеина и диметиламиноазобензола. О содержании свободной HCl судят по количеству 0.1 N NaOH, пошедшего на титрование 100 мл желудочного содержимого 20 – 40 титр. ед.
40 – 60 титр. ед. В клинической практике широко используется как качественный, так и количественный метод анализа желудочного содержимого. Патологические изменения содержания HCl: гиперхлоргидрия – увеличение свободной HCl характерно для гиперацидного гастрита, язвы желудка и 12-перстной кишки.
Гипохлоргидрия – снижение свободной HCl наблюдается при гипоацидном гастрите.
Ахлоргидрия – полное отсутствие HCl в желудочном содержимом. Повышение общей кислотности более 60 т. ед. – гиперацидитас (язва желудка, 12-перстной кишки, гиперацидный гастрит). Снижение общей кислотности (менее 40 т.ед.) – гипоацидитас наблюдается при гипоацидном гастрите, снижении секреторной функции обкладочных клеток слизичтой желудка.
4) Врач предполагает наличие гиповитаминоза С у больного. Как можно провести биохимическую диагностику гиповитаминоза С?
Диагностика гиповитаминоза С проводится следующим образом: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается. Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей.
Билет 10
1)Простые и сложные белки…
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты. Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада. Классификация сложных белков: фосфопротеины (содержат фосфорную кислоту, кот присоединяется к ОН сер и тре), хромопротеины (флавопротеины(ФМН и ФАД) и гемопротеины(ферменты – цитохромы, каталаза и пероксидаза и неферменты – гемоглобин и миоглобин)), нуклеопротеины (содержат ДНК и РНК – рибосомы и хроматин), гликопротеины (содержат углеводы, кот связаны ковалентно с ОН гр сер и тре через О-гликозижную связь и с NH-гр арг и асп через N-гликозидную связь), липопротеины (содержат липиды, связанные с пом. нековалентных св: гидрофобных и ионных) и металлопротеины (содержат металлы). При функционировании белков может происходить их связывание с лигандами –низкомолекулярными веществами. Лиганд присоединяется к определенному участку в белковой молекуле – активному центру. Активный центр формируется на третичном и четвертичном уровнях организации белковой молекулы и образуется благодаря притяжению боковых радикалов определенных аминокислот (между -ОН группами сер формируются водородные связи, ароматические радикалы связаны гидрофобными взаимодействиями, -СООН и –NH2 - ионными связями).
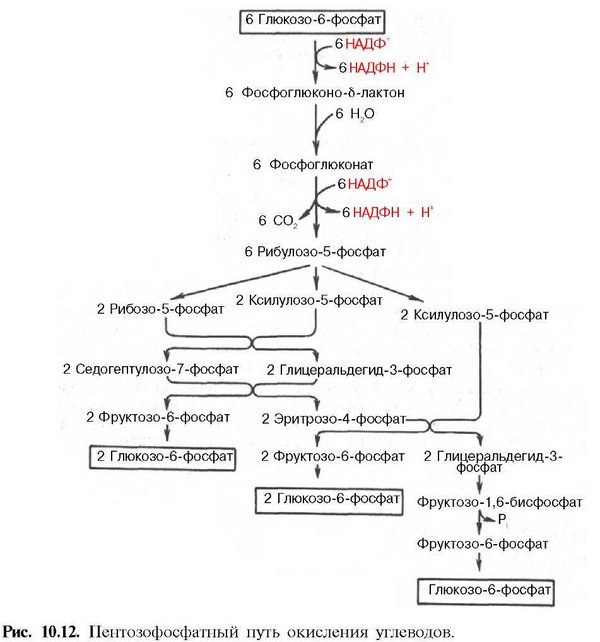
2)Пентозофосф. Путь превр.глюкозы…
3) Белок плазмы крови
А) экспресс-метод (метод «висящей» капли) В основу метода положена зависимость между содержанием белков в плазме и цельной крови и ее удельным весом. Определение удельного веса плазмы и цельной крови осуществляется путем погружения капли в растворы CuSO4 известного веса. Тот раствор CuSO4 , в котором капля сначала повисает, а затем опускается, равен удельному весу исследуемой жидкости. 65-85 г/л
6.5-8.5 мг% Гиперпротеинемия – увеличение общего содержания белков плазмы крови наблюдается при диарее у детей, рвоте, непроходимости верхнего отдела тонкой кишки, обширных ожогах. Потеря воды организмом приводит к повышению концентрации белка в крови: а) относительная гиперпротеинемия связана с потерей воды организмом (диарея, рвота, ожоговая болезнь, травмы); б) абсолютная гиперпротеинемия обусловлена резким нарастанием глобулинов при инфекциях, а также синтезом патологических белков или белков «острой фазы».
Гипопротеинемия – снижение общего содержания белков плазмы может быть обусловлено с несколькими причинами: а) нарушение белок-синтезирующей функции печени (паренхиматозная желтуха, гепатиты, цирроз печени). Происходит снижение белкового коэффициента за счет снижения синтеза альбуминов; б) задержкой воды при заболеваниях сердечно-сосудистой системы; в) потерей белка с мочой при патологии почек; г) кровопотерями при травмах и операциях
Б) биуретовый метод Метод основан на образовании биуретового комплекса Cu(OН)2 с пептидными связями, имеющего розово-фиолетовое окрашивание. Интенсивность окраски пропорциональна количеству пептидных связей.
В) метод Лоури. Метод основан на способности белков образовывать окрашенные комплексы синего цвета при осуществлении двух цветных реакций – биуретовой и реакции Фолина (восстановление белками смеси фосфорновольфрамовой и фосфорномолиюденовой кислот – реактив Фолина). Интенсивность окраски зависит от количества белка.
Активность аминотрансфераз (АлАт и АсАт) в крови. Метод определения активности АлАт и АсАт основан на определении оптической плотности дифенилгидразона пирувата, явлвющегося продуктом дезаминирования аланина и иаспартата. АлАт 0.1-0.7
АсАт 0.1-0.55 Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканейЮ, богатых данными ферментами (печень, миокард). АсАт – резкое повышение через 6-12 часов после возникновения инфаркта миокарда, достигает максимума к 24-48 часам, а затем постепенно к 5 дню приходит к норме. Если к 4-5 дню активность АсАт не снижается, то пророгноз плохой.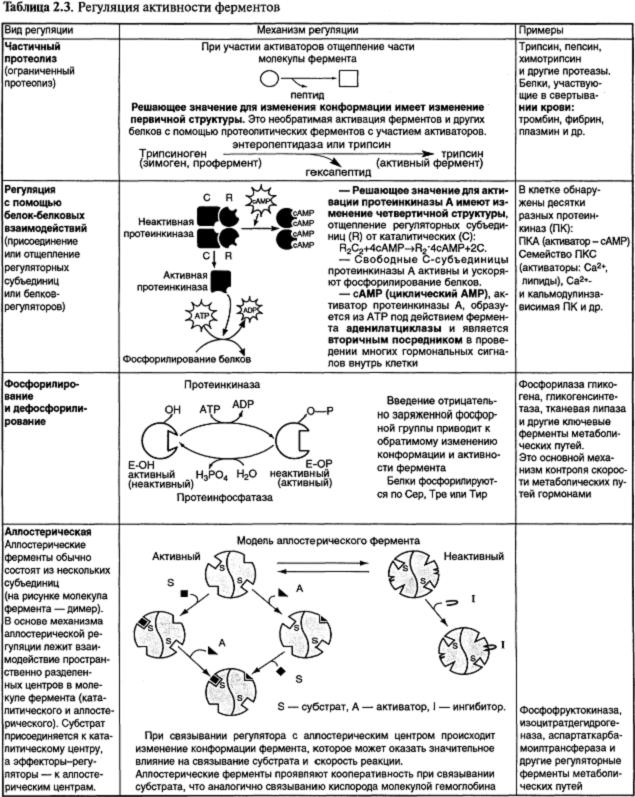
АлАт – при заболеваниях печени, токсических поражениях печени, холепатиях, холестазе, дерматомиозите. Повышение активности АлАт наблюдается при остром инфаркте миокарда, но не столь резко по сравнению с изменением АсАт. В норме соотношение акимвности АлАт и АсАт= 1.33±0.42. У больных инфекционным гепатитом происходит снижение коэффициента, а при инфаркте миокарда – резко возрастает.
4) У больного с наклонностью к гиперхолестеринемии, прием даже умеренного количества углеводов с пищей ведет к гиперхолестеринемическому кризу. Почему ?
Углеводы, являются одним из источников Ацетил-КоА для организма, который в норме утилизируется в цикле Кребса. При предрасположенности к гиперхолестеринемии происходит снижение утилизации Ацетил-КоА в и направление его на синтетические процессы, в том числе и синтез холестерина.
|
|
|
 Скачать 1.24 Mb.
Скачать 1.24 Mb.