Билет 1 1 белки как основа жизни. Роль белков
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
3. Количественное определение активности амилазы (диастазы) мочи по Вольгемуту. Моча разводится в геометрической прогрессии. Каждое разведение инкубируют с крахмалом в течение 30 минут. Негидролизованный крахмал определяют по реакции с иодом. Активность амилазы расчитывается по наибольшему разведению, способному гидролизовать крахмал. 16-34 мг крахмала, гидролизованного за 30 мин 1 мл мочи Увеличивается при острых панкреатитах (10-30 раз), обострениях хронических панкреатитах, опухолях и травмах поджелудочной железы. Гиперамилаземия наблюдается при паротитах, опухолях и травмах слюнных желез, слюнокаменной болезни. Снижение активности амилазы наблюдается при сахарном диабете. 4. У сердечного больного в процессе длительного лечения мочегонными препаратами возникла слабость, нарушение ритма сердца. Какие показатели водно-солевого обмена следует у него определить в моче? Почему могут измениться эти показатели? Мочегонные средства вымывают из организма катионы, среди которых К+, необходимый для работы сердца. Билет 40 1)Свободнорадикальное окисление… Свободнорадикальное окисление – важный и многогранный биохимический процесс превращений кислорода, липидов, нуклеиновых кислот, белков и других соединений под действием свободных радикалов, а перекисное окисление липидов (ПОЛ) – одно из его последствий. Свободные радикалами (СР) представляют собой соединения, имеющие неспаренный электрон на наружной орбите и обладающие высокой реакционной способностью. К числу первичных СР относятся супероксидный анион-радикал, окись азота, а вторичными СР являются гидроксильный радикал, синклетный кислород, перекись водорода, пероксинитрит. Образование СР тесно связано, с одной стороны, с появлением свободных электронов при нарушениях процессов окисления в дыхательной цепи, превращении ксантина, синтезе лейкотриенов и простогландинов. Эти реакции зависят от активности ксантиноксидазы, дегидроротатдегидрогеназы, льдегидоксидазы, холестериноксидазы, ферментов цитохрома Р-450. Синтез супероксид — аниона инициируется ангиотензином II, который образуется из ангиотензина I под действием ангиотензинпревращающего фермента. Его активность в сосудах больных с выраженным атеросклерозом особенно высока. Причина этого явления пока неясна. Оксид азота образуется при окисленииL-аргинина под действием NO-синтетазы при участии кальмодулина. В литературе представлены данные о том, что синтез NO при атеросклерозе не нарушен, но его дефицит может возникать при увеличении его соединения с супероксид – анионом. Оно завершается синтезом пероксинитрита с большими патогенными потенциями, в том числе и образованием окисленных форм ЛПНП. С другой стороны, для синтеза вторичных СР используется водород НАДФ-Н, НАД-Н — его донаторов. Супероксид — анион может восстанавливать Fe3+ в Fe2+, при взаимодействии которого с перекисью водорода, перекисями липидов и гипохлоритом образуются высокотоксичные вторичные радикалы. Из всех СР наибольшей активностью обладают гидроксильный радикал и пероксинитрит. Активность СР ограничивается антиоксидантами, которые разрывают цепи молекул при реакциях СРО, разрушают молекулы перекисей. К числу ферментных антиоксидантов относятся супероксиддисмутаза (СОД), глютатионпероксидаза, каталаза, находящиеся в клеточных структурах. Неферментные антиоксиданты – витамины Е, К, С, убихиноны, триптофан, фенилаланин, церулоплазмин, трансферрин, гаптоглобин, глюкоза, каротиноиды – блокируют активность СР в крови. 2)Уровни регуляции обмен.пр.в ор-ме… Регуляция скорости протекания метаболизма часто осуществляется путем изменения скорости одной или, возможно, двух ключевых реакций, катализируемых "регуляторными ферментами ". Некоторые физико-химические факторы, контролирующие скорость ферментативной реакции, например, концентрация субстрата, имеют первостепенное значение при регуляций общей скорости образования продукта данного пути метаболизма. В то же время другие факторы, влияющие на активность ферментов, например температура и pH, у теплокровных животных постоянны и практически не имеют значения для регуляции скорости процессов метаболизма. При достижении равновесия прямая и обратная реакции протекают с одинаковой скоростью, и, следовательно, концентрации продукта и субстрата остаются постоянными. Многие метаболические реакции протекают именно в таких условиях, т.е. являются "равновесными". В стационарных условиях in vivo протекание реакции слева направо возможно за счет непрерывного поступления субстрата и постоянного удаления продукта D. Такой путь мог бы функционировать, но при этом оставалось бы мало возможностей для регуляции его скорости путем изменения активности фермента, поскольку увеличение активности приводило бы только к более быстрому достижению равновесия. В действительности в метаболическом пути, как правило, имеются одна или несколько реакций "неравновесного" типа, концентрации реактантов которых далеки от равновесных. При протекании реакции в равновесном состоянии происходит рассеивание свободной энергии в виде теплоты, и реакция оказывается практически необратимой. По такому пути поток реактантов идет в определенном направлении, однако без системы контроля наступит его истощение. Концентрации ферментов, катализирующих неравновесные реакции, обычно невелики, и активность ферментов регулируется специальными механизмами; эти механизмы функционируют по принципу "одноходового" клапана и позволяют контролировать скорость образования продукта. Гомеостаз – относительное динамическое постоянство внутренней среды и устойчивость основных физиологических функций организма человека и животных. "Сохранение структурно-функциональной стабильности" - суть любого гомеостаза, управляемого гомеостатом или саморегулируемого. С точки зрения химической биофизики гомеостаз – это состояние, при котором все процессы, ответственные за энергетические превращения в организме, находятся в динамическом равновесии. Это состояние обладает наибольшей устойчивостью и соответствует физиологическому оптимуму. С этих позиций основными причинами нарушения гомеостаза являются необычные для нормальной жизнедеятельности неферментативные реакции, протекающие в мембранах; в большинстве случаев это цепные реакции окисления с участием свободных радикалов, возникающие в фосфолипидах клеток. Эти реакции ведут к повреждению структурных элементов клеток и нарушению функции регулирования. К факторам, являющимся причиной нарушения гомеостаза, относятся также агенты, вызывающие радикалообразование, - ионизирующие излучения, инфекционные токсины, некоторые продукты питания, никотин, а также недостаток витаминов и т.д. Одним из основных факторов, стабилизирующих гомеостатическое состояние и функции мембран, являются биоантиокислители, которые сдерживают развитие окислительных радикальных реакций. 3._______________- 4. Почему больному с атеросклерозом врач при выписке из больницы рекомендовал сбалансировать диету. Каков ее состав? При атеросклерозе необходимо ограничить количество в рационе жиров и углеводов из которых образуется много Ацетил-КоА, используемого для синтеза холестерина. При этом необходимо назначить диету с большим содержанием белка, липотропных факторов (для усиления синтеза ЛПВП), витаминов и клетчатки (для выведения избытка холестерина из организма). Билет 41 1)Окислит. Декарбоксилирование… 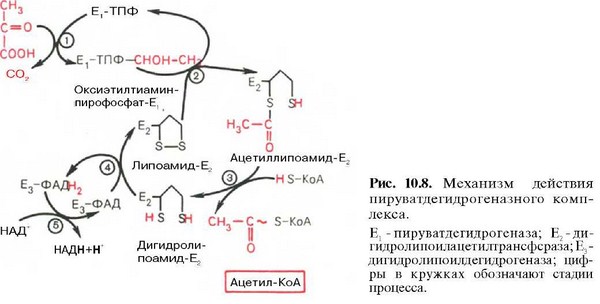 2)Химизм мышеч.сокращ-я… В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий: 1) миозиновая ≪головка≫ может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер; 2) содержащая АДФ и Н3РО4 миозиновая ≪головка≫ может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90°; 3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера; 4) новая молекула АТФ связывается с комплексом миозин–F-актин ; 5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) ≪головки≫ от F-актина - расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом. Затем цикл возобновляется. Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регуляторная роль принадлежит ионам Са2+ . Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция. Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ. По современным представлениям, в покоящейся мышце (в миофибриллах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур. Связывание ионов Са2+ разветвленной сетью трубочек и цистерн саркоплазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой. Возможность пребывания живой мышцы в расслабленном состояниипри наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионов Са2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость актомиозиновых структур волокна. 3. Аминный азот в сыворотке крови. α-аминокислоты при взаимодействии с нингидрином подвергаются окислительному дезаминирванию и декарбоксилированию. При этом нингидрин, восстанавливаясь, вступает в реакцию а продуктами, образовавшимися из аминокислот. Образуется соединение, окрашенное в фиолетовый цвет, интенсивность которого пропорциональна количеству свободных аминокислот. 4 – 11 мг% 2.5 – 7.8 ммоль/л Изменение содержания аминного азота в сыворотке крови может служить одним из показателей катаболических или анаболических процесов в организме. Увеличение содержания аминного азота – гипераминоацидемия – наблюдается при болезнях печени, приводимых к ослаблению синтеза мочевины, повышенном распаде тканевых белков, нарушении выделительной функции почек (задержка азотистых шлаков). Уменьшение уровня азота может наблюдаться при недостаточном поступлении белка с пищей, нарушении всасывания азотистых продуктов, истощения больного, избыточное удаление аминаз с мочой. 4. При лечении больного запланировано воздействие на обмен веществ через аденилатную систему. Какие, известные вам, биологически активные соединения активизируют аденилатциклазную систему и какие подавляют? Через аденилатциклазную систему действуют некоторые гормоны, например адреналин. Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу, (например, алкалоиды, кофеин, теофиллин), способствуют сохранению и увеличению концентрации циклического АМФ в клетке. Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше, т. е. усиливается действие гормона. Билет 42 1)Структурная орг-я белк.молекул… Существует четыре уровня пространственной организации белка: первичная, вторичная, третичная и четвертичная структура белковых молекул. Первичная структура белка - последовательность аминокислот в полипептидной цепи (ППЦ). Пептидная связь формируется только за счет альфа-аминогруппы и альфа-карбоксильной группы аминокислот. Вторичная структура - это пространственная организация стержня полипептидной цепи в виде α-спирали или β-складчатой структуры. В α-спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется α-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. β-Складчатая структура удерживается также водородными связями между С=О и NH-группами. Третичная структура - особое взаимное расположение в пространстве спиралеобразных и складчатых участков полипептидной цепи. В формировании третичной структуры участвуют прочные дисульфидные связи и все слабые типы связей (ионные, водородные, гидрофобные, Ван-дер-ваальсовые взаимодействия). Четвертичная структура – трехмерная организация в пространстве нескольких полипептидных цепей. Каждая цепь называется субъединицей (или протомером). Поэтому белки, обладающие четвертичной структурой, называют олигомерными белками. 2)Биохимия железа… В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонук-леотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа. В организме взрослого человека содержится 3 - 4 г железа, из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68% железа всего организма, ферритин - 27%, миоглобин - 4%, трансферрин - 0,1%, На долю всех содержащих железо ферментов приходится всего 0,6% железа, имеющегося в организме. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки. В нейтральной или щелочной среде железо находится в окисленном состоянии - Fe3+, образуя крупные, легко агрегирующие комплексы с ОН-, другими анионами и водой. При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям и образуют с ними хелатные комплексы, изменяя свойства и функции этих соединений, поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин. В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 - 20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается (см. ниже "Регуляция поступления железа в клетки"). Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. елезо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин. В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%. Нарушения метаболизма железа. Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках. Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных тложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу. 3. Количест-венное опре-деление ак-тивности лактатде-гидрогеназы (ЛДГ) в сыворотке крови ЛДГ катализирует в щелочной среде обратимую реакцию окисления молочной кислоты (лактата) до пи-ровиноградной кислоты (пирувата) в присутствии НАД. Образовавшийся пируват, взаимодействуя с 2,4-динитрофенил-гидразином, дает фенилгидразон желто-кориченевого цвета; интенсивность окраски зависит от количества пирувата. Активность ЛДГ определяют по количеству образовавшегося пирувата. 0,8-4,0 мкМоль пирувата на 1 мл сыворотки в течение 10 минут инкубации Повышение активности ЛДГ наблюдается при инфаркте миокарда (ЛДГ1 и ЛДГ2), остром лейкозе, перрнициозной анемии, злокачественных новообразованиях, заболеваниях гепатобилиарной системы (ЛДГ4 и ЛДГ5), поражениях скелетной мускулатуры, травматическом шоке, гемолитической анемии |
