Билет 1 Альбумины, глобулины, фибриноген
 Скачать 2.76 Mb. Скачать 2.76 Mb.
|
|
Аскорбиновая кислота, биологическая роль: 1) синтез коллагена (гидроксилирование пролина и лизина) 2) Гидроксилирование триптофана в 5-гидрокситриптофан (при синтезе серотонина) 3) Реакции гидроксилирования при биосинтезе гормонов корковой и мозговой части надпочечников 4) В составе оксигеназной системы микросом витамин С играет роль прооксиданта 5) Стабилизирует витамин Е, выполняя антиоксидантную функцию 6) Участвует в синтезе тироксина 7) Защищает железо от окисления в тонком кишечнике, облегчая всасывание Гиповитаминоз проявляется как цинга, железодефицитная анемия, ослабление иммунозащитных сил организма и усиление реакций свободнорадикального окисления. Суточная потребность=160-200мг/сутки. Источником этого витамина является растительная пища. Наибольшее кол-во в чёрной смородине и шиповнике. 3.Укажите суточную потребность в углеводах. Углеводы –источник энергии. Структурный компонент нуклеиновых кислот, гликопротеинов, гликолипидов, глюкозаминогликанов. Средняя суточная потребность –500г 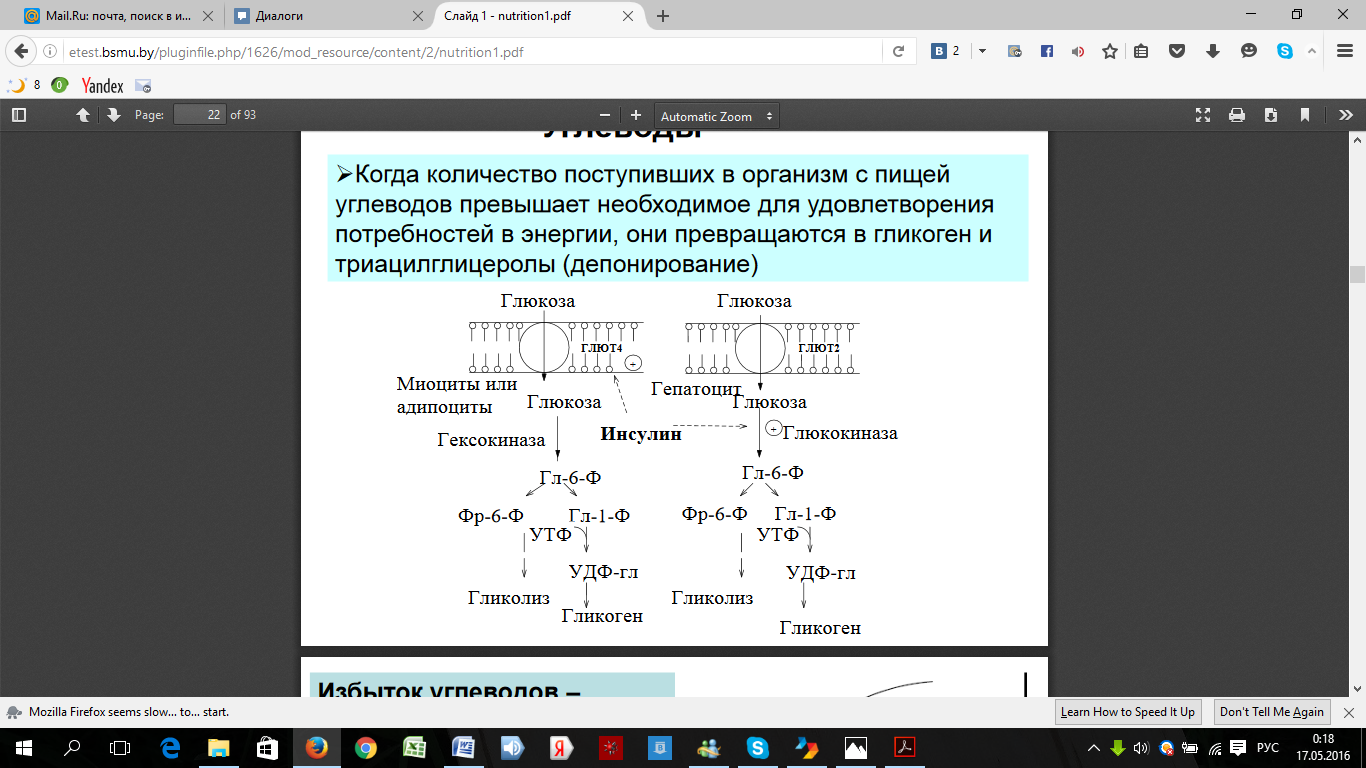 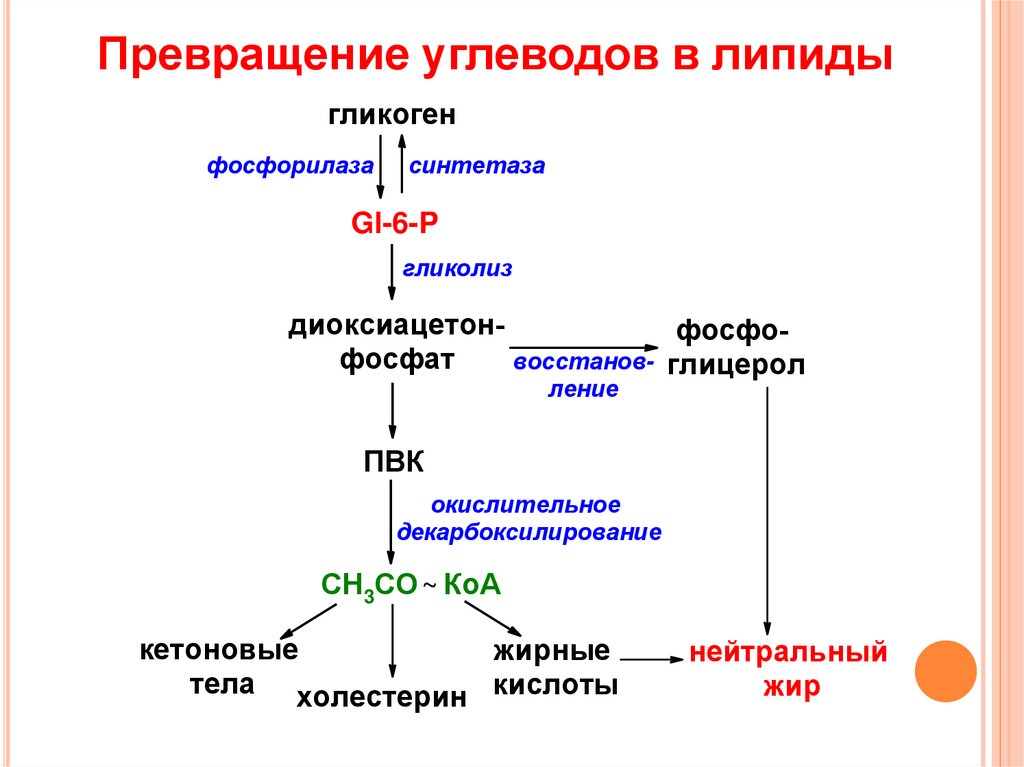 5. Биороль натрия 1. Определяет осмолярность и объём внеклеточной жидкости 2. Создание биоэлектрических потенциалов на мембранах клеток 3. Регуляция кислотно-основного состояния организма (Nа+/ Н+ -обмен в почках) 4. Участвует в транспорте через клеточную мембрану глюкозы, галактозы, АК (в кишечнике и почках) –Nа-зависимый синпорт; антипорт –Nа+/ К+, Na+/Ca2+ 5. Участвует в регуляции метаболизма (ингибирующее действие на ферменты клеток, активирует некоторые пищеварительные ферменты Основной путь выделения натрия – почки. Выделение натрия почками регулируется: альдостероном; предсердными натрийуретическими пептидами. Подчеркивая важную роль этих гормонов в регуляции обмена натрия, следует помнить, что вода может задерживаться во внеклеточном компартменте благодаря осмотическому эффекту ионов. Так как натрий (и сопутствующие анионы, главным образом хлориды) – главный компонент внеклеточного компартмента, его количество во внеклеточной жидкости определяет то, каким будет объем этого компартмента. Это – важная концепция. Суточная потребность до 5-8 г/сут NаCl. Норма NаClдля гипертоников-не более4-5г/сут В плазме крови –135-150 ммоль/л Билет 10. 1.буферные системы крови. Бикарбонатная. ( max эффект при pH=7,4) На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Состоит из молекулы угольной кислоты Н2СО3- донор протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона: 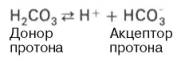 Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Фосфатная. представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов): 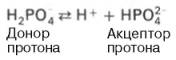 В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2 и составляет около 1%. Белковая. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.(7-10 % буферной ёмкости)Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+(кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4. Гемоглобиновая. Играет важную роль как в процессе дыхания(транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболической CO2), так и в поддержании постоянства pH внутри эритроцитов, а в результате и в крови целом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb). Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое. В норме рН крови соответствует 7,36. Колебания величины рН крови крайне незначительны. Так, в условиях покоя рН артериальной крови соответствует 7,4, а венозной — 7,34. ЛКТАТАЦИДОЗ. Уровень лактата в крови - результат равновесия между процессами его образования и утилизации. Кратковременный компенсированный лактоацидоз встречается довольно часто даже у здоровых людей при интенсивной мышечной работе. Повышение содержания лактата в крови может быть следствием нарушения метаболизма пирувата. Так, при гипоксии уменьшается активность ПДГ комплекса и снижается окислительное декарбоксилирование пирувата. Возникновению лактоацидоза также способствуют нарушения глюконеогенеза при печёночной недостаточности различного происхождения. Кроме того, лактоацидозом может сопровождаться гиповитаминоз В1, так как производное этого витамина выполняет коферментную функцию в составе ПДК при окислительном декарбоксилировании пирувата. 2) Фибриноген (фактор I) – гликопротеин, синтезируется в печени и клетках ретикулоэндотелиальной системы (в костном мозге, селезенке, лимфатических узлах и т. д.); и содержится в плазме крови в концентрации 2 - 4 г/л. Молекула фибриногена состоит из шести п.п цепей, которые связаны друг с другом дисульфидными связями. Исходный вид – 2А2a2В2β2y, притом А и В -всего лишь концевые пептиды своих цепей со множеством ГЛУ и АСП (помним, что эти АМК заряжены «-») цепи отталкиваются, поэтому фибриноген и растворим. Переход фибриногена в фибрин происходит по схеме:  Фибрин S - растворим, полимер, нет ковалентных связей (непрочен), в норме мало (тромбозы) Фибрин I- нерастворим, полимер, образованы ковалентные связи 3) Энергетические ценность углеводов. Энергетические потребности организма взрослого человека в состоянии покоя составляют 1300–1800 ккал. Они увеличиваются при ожогах, травмах, инфекционных заболеваниях, в послеоперационный период. При голодании они снижаются. Основными источниками энергии являются углеводы — 42 %, жиры — 40 %, белки — 15 % и алкоголь — 3 %. Желательно, чтобы 55 % АТФ образовывалось в результате расщепления углеводов, 30 % — липидов, 15 % — белков 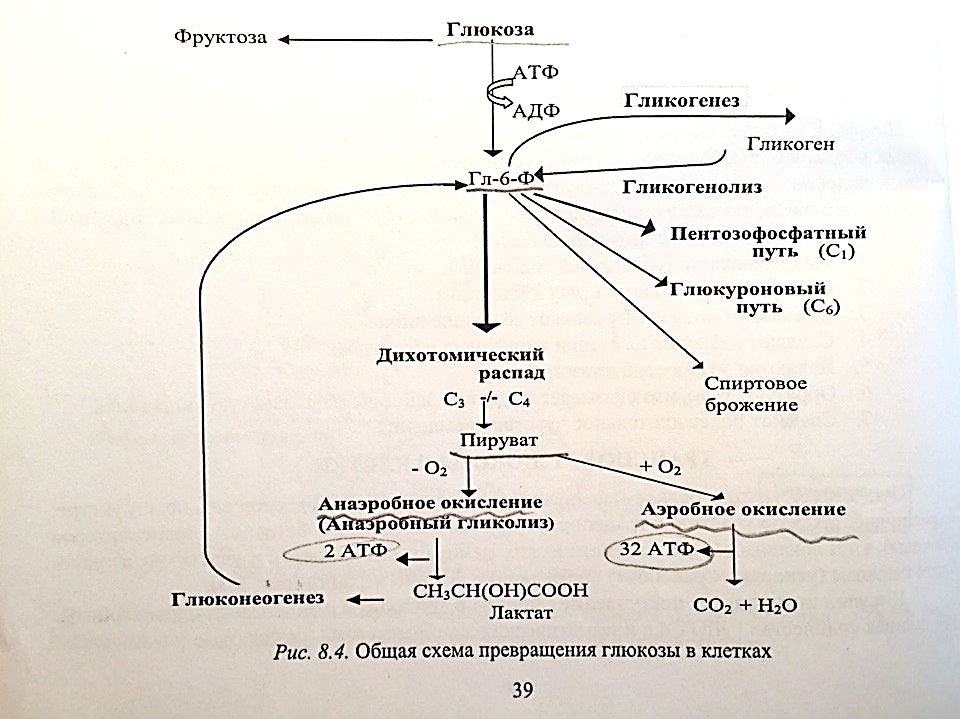 Гликолиз — это сложный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз, протекающий без потребления кислорода). Суммарное уравнение анаэробного гликолиза:C6H12O6 + 2АДФ + 2Фн 2CH3CH(OH)COOH + 2АТФ + 2H2O Гликолиз функционирует во всех живых клетках. Все ферменты локализованы в цитозоле. Гликолиз осуществляется в два этапа: 1. Подготовительный этап — дихотомический распад глюкозы на две молекулы глицеральдегид-3-фосфата. Превращения сопровождаются затратой 2 АТФ 2. Этап гликолитической оксидоредукции — превращение двух молекул глицеральдегид-3- фосфата в лактат. Включает окислительно-восстановительные реакции и реакции фосфорилирования, сопровождающиеся синтезом АТФ. Энергетический баланс гликолиза — две молекулы АТФ на одну молекулу глюкозы. АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ Это основной путь катаболизма глюкозы у аэробных организмов. Процесс осуществляется в митохондриях в три этапа: Аэробный гликолиз, Окислительное декарбоксилирование ПВК, Лимоннокислый цикл. В аэробных условиях глюкоза окисляется до СО2 и Н2О. Энергетический баланс аэробного окисления глюкозы — 30–32 моля АТФ на молекулу глюкозы. 4.Пантотеновая кислота (витамин B5) Пантотеновая кислота - белый мелкокристаллический порошок, хорошо растворимый в воде. Она синтезируется растениями и микроорганизмами, содержится во многих продуктах животного и растительного происхождения (яйцо, печень, мясо, рыба, молоко, дрожжи, картофель, морковь, пшеница, яблоки). В кишечнике человека пантотеновая кислота в небольших количествах продуцируется кишечной палочкой. Пантотеновая кислота - универсальный витамин, в ней или её производных нуждаются человек, животные, растения и микроорганизмы. Суточная потребность человека в пантотеновой кислоте составляет 10-15 мг. Биологические функции. Пантотеновая кислота используется в клетках для синтеза коферментов: 4-фосфопантотеина и КоА. 4-фосфопантотеин - кофермент пальмитоилсинтазы. КоА участвует в переносе ацильных радикалов в реакциях общего пути катаболизма активации жирных кислот, синтеза холестерина и кетоновьх тел, обезвреживания чужеродных веществ в печени. Клинические проявления недостаточности витамина. У человека и животных развиваются дерматиты, дистрофические изменения желёз внутренней секреции (например, надпочечников), нарушение деятельности нервной системы (невриты, параличи), дистрофические изменения в сердце, почках, депигментация и выпадение волос и шерсти у животных" потеря аппетита, истощение. Низкий уровень пантотената в крови у людей часто сочетается с другими гиповитаминозами (В.,, В2) и проявляется как комбинированная форма гиповитаминоза. 5) Обмен железа в организме Содержание железа в организме — 3–5 г, наибольшее его количество (2/3) приходится на гемоглобин, на миоглобин и ферменты около 15%, около 20% железа хранится в депо. Fe принимает участие в связывании, транспорте и депонировании О2 (гемоглобин и миоглобин), в транспорте электронов в дыхательной цепи (цитохромы), в окислительно-восстановительных реакциях (некоторые оксидоредуктазы), реакциях гидроксилирования (цитохром Р450) и обезвреживания перекисей (каталаза и пероксидазы). Железо всасывается в верхней части тонкого кишечника. При возрастании потребности в нѐм (кровопотери) Fe всасывается эффективнее. Витамин С улучшает всасывание железа. Из просвета кишечника свободное железо захватывается муцином слизистой. Интегрин на щѐточной каѐмке энтероцита облегчает транспорт Fe внутрь клетки, где железо связывается с белком мобилферрином. Этот белок «собирает» железо изо всех отсеков цитозоля энтероцита и переносит в кровь, где Fe3+ сразу же связывается с белком апотрансферрином — образуется трансферрин (гликопротеин). Трансферрин, помимо транспортной функции, защищает также ткани от токсического действия свободных ионов железа. Затем, связываясь со специфическим мембранным рецептором, трансферрин поступает вместе с ним в клетки кроветворных органов. После освобождения от Fe трансферриновый рецептор возвращается в плазматическую мембрану. В клетках печени, костного мозга и селезѐнки железо связывается с апоферритином. Одна молекула апоферритина может заключать в себе до 4,5 тысяч атомов железа. Апоферритин, связанный с Fe, называется ферритином. Железо может быть снова использовано только после распада ферритина. При загрузке депо (ферритина) Fe откладывается в виде нерастворимого комплекса — гемосидерина. В норме между скоростью всасывания и выведения железа существует равновесие. Существенный дефицит железа может возникать при кровопотере (с 1 мл крови теряется 0,5 мг Fe). Недостаток Fe возникает также при потреблении бедной железом пищи и нарушениях его всасывания. В результате развивается железодефицитная гипохромная анемия, характеризующаяся сухостью кожи, глосситом-восполением языка, атрофией вкусовых сосочков, голубыми склерами и тд. Основной формой депонирования железа является ферритин — водорастворимый гликопротеиновый комплекс, который содержится в макрофагах печени, селезёнки, костного мозга, в эритроцитах и сыворотке крови. При заполнении депо железа микроэлемент откладывается в виде гемосидерина в клетках печени и селезѐнки отмечается при переливании больших объѐмов крови или гемолизе эритроцитов. Гемосидероз — избыточное отложение гемосидерина в тканях организма. Возможные причины гемосидероза — усиленный распад эритроцитов, нарушение утилизации этого пигмента в процессе эритроцитопоэза, усиленное всасывание его вкишечнике, нарушение обмена железосодержащих пигментов, ацерулоплазминемия. Ге́мохромато́з (пигме́нтный цирро́з, бро́нзовый диабе́т) — наследственное, генетически обусловленное заболевание, проявляется нарушением обмена железа с накоплением его в тканях и органах. Железо поглощается из пищи и чрезмерно накапливается в органах и тканях: печени, поджелудочной железе, миокарде,селезёнке, коже, эндокринных железах и других местах. Избыточное накопление железа в организме может спровоцировать развитие ряда заболеваний: цирроз печени, сердечная недостаточность, сахарный диабет,артрит. Суточная потребность в железе для взрослых — 1–2 мг, однако всасывается всего лишь 10 % содержащегося в рационе питания Fe. Вариант 13 Ферменты плазмы крови (секреторные, экскреторные, индикаторные)… В крови могут присутствовать следующие ферменты: Секреторные (плазмоспецифические) — синтезируются в печени и в норме постоянно выделяются в кровь, где выполняют свои функции, поэтому диагностич. значение имеет только понижение активности данных ф. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолиза и кининогенеза, ренин). Снижение активности этих ферментов в плазме будет свидетельствовать о снижении синтетической способности клеток или о накоплении ингибиторов в плазме крови. · ЛХАТ лецитин-холестерин-ацил-трансфераза - Осущ. р.этерификации ХС в стр-ре альфа-липопротеинов. · ЛП-липаза(ф-р просветления) - Уч.в гидролизе триглицеридов в стр-ре ХМ и ЛПОНП(пре-бета-ЛП) · Псевдохолинэстераза - Участ.в расщеп.ацетилхолина, бутирилхолина. Диагностич.значение имеет при б.Боткина и при отравлении фосфоорганич.соединениями(активность резко снижается) · Б. Лизоцим – фактор неспецифической резистентности организма · Церулоплазмин(медь-содержащая оксидаза) Экскреторные — образуются органами пищеварительной системы (поджелудочной железой, слизистой оболочкой кишечника, печенью) и в норме выделяются с желчью (например, щелочная фосфатаза). При патологических состояниях могут появляться в крови. Индикаторные (клеточные) — попадают в кровь из клеток органов и тканей при их некрозе (гибели клеток), повышении проницаемости клеточных мембран или усилении пролиферации клеток, продуцирующих фермент. Например, при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы, нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы, костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД), предстательной железы – кислой фосфатазы, гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы, желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП). Таким образом, определение активности ряда ферментов в крови имеет диагностическую ценность. П 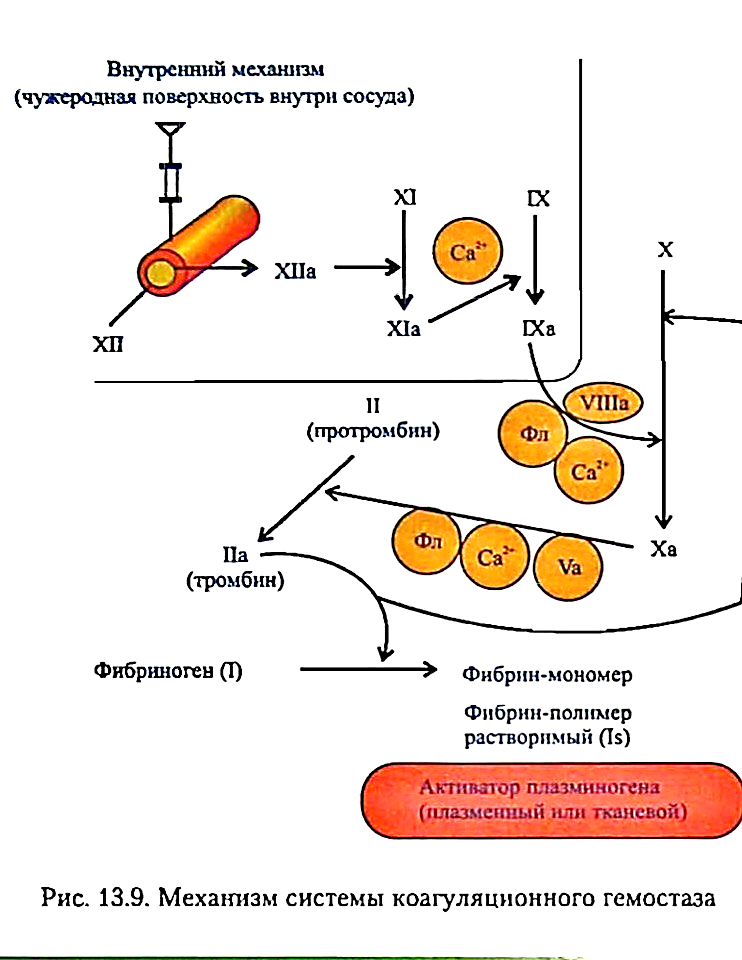 ри контакте крови с чужеродной поверхностью запускается процесс… ри контакте крови с чужеродной поверхностью запускается процесс…Внутренний механизм коагуляционного гемостаза – медленный процесс. Реакции начинаются при контакте крови с чуж пов-стью. В контактной фазе белки плазмы (фактор ХII, ВМК, прекалликреин, фактор ХI) образуют комплекс с чужеродной пов-стью. Активный сериновый центр прекалликреина активирует фактор ХII, тот активирует фактор ХI - фактор ХIа, который стимулирует образование активного фактора IХа. Фактор IХа образует с фактор Х, ионами кальция, тромбопластином тромбоцитов(Р3), фактором VIIIа теназный комплекс, итогом взаимодействия которого является активированный фактор Ха. Вторая фаза – образование тромбина – Фактор Ха, ионы кальция, Р3, фактор Vа образуют протромбиназный комплекс, который переводит неактивный протромбин в тромбин. Первый образовавшийся тромбин начинает ускорять все предыдущие реакции (активирует тромбоциты, фактор V). Следующая фаза коагуляции – превращение фибриногена (фактор I) в фибрин (фактор Iа) под действием тромбина. Фибрин – конечный продукт гемокоагуляции , он – основа кровеостанавливающего тромба. |
