биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
 Скачать 14.38 Mb. Скачать 14.38 Mb.
|
|
Механизм действия ферментов Проблемы структуры и функции ферментов, вопросы механизма их действия являются предметом изучения ведущих лабораторий мира. Повышение скорости реакции под действием ферментов объясняют тем, что при ферментативном катализе фермент соединяется (в принципе обратимо) со своим субстратом, образуя нестойкий промежуточный ферментсубстратный комплекс, который в конце реакции распадается с освобождением фермента и продуктов реакции (Арни, Михаэлис, Ментен, 1910-1915 гг.). Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции. В процессе реакции различают следующие стадии: 1. Присоединение молекулы субстрата к ферменту. 2. Преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов. 3. Отделение конечных продуктов реакции от фермента. Пример: E - фермент S – субстрат P - продукт В  реакциях анаболизма, допустим А+В AB, фермент может соединяться как с одним, так и с другим субстратом или обоими субстратами: реакциях анаболизма, допустим А+В AB, фермент может соединяться как с одним, так и с другим субстратом или обоими субстратами: В   реакциях катаболизма, допустим: AB А+В реакциях катаболизма, допустим: AB А+Ва  ) АВ+Е АВЕ ) АВ+Е АВЕ б   ) ABE А+ВЕ (а+б+в) АВ+Е А + В E ) ABE А+ВЕ (а+б+в) АВ+Е А + В Eв  ) BE В+Е ) BE В+Е Схема образования промежуточного фермент-субстратного комплекса представлена на рисунке 4.2. Если фермент в активном центре содержит кофермент, то образуется тройной комплекс (рис.4.2.). 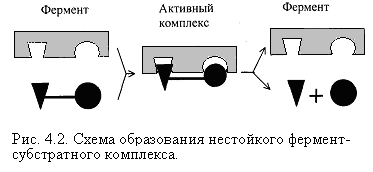 Фермент вступает во взаимодействие с субстратом на очень короткий период. Существование такого комплекса получило доказательство лишь в последние годы. В образовании фермент-субстратного комплекса участвуют водородные связи, электростатические и гидрофобные взаимодействия, а также, в ряде случаев, ковалентные, координационные связи. Информация о природе связей может быть получена методами электронного парамагнитного резонанса (ЭПР), ядерного магнитного резонанса (ЯМР), ультрафиолетовой и инфракрасной спектроскопии. Для каталитической активности существенное значение имеет пространственная структура ферментного белка, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. В каталитическом процессе существенное значение имеют точное соответствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия. Это означает, что между ферментом и субстратом должна быть не только пространственная или геометрическая комплементарность, но и электростатическая – спаривание противоположных зарядов (групп) субстрата и активного центра фермента. Таким образом, в механизме ферментативного катализа ведущую роль играют промежуточные фермент-субстратные комплексы, образование которых определяется тонкой структурой активного и эффекторного центров и уникальной структурой всей молекулы фермента, обеспечивающими высокую каталитическую активность и специфичность действия биокатализаторов. Кинетика ферментативных реакций зависит от природы реагирующих веществ – фермента, субстрата и условий их взаимодействия – концентрации, рН среды, температуры, присутствия активаторов или ингибиторов. Основные свойства ферментов К ферментам применимы три основных критерия, характерных для неорганических катализаторов: 1) они остаются относительно неизменными после реакции, то есть освобождаются вновь и могут реагировать с новыми молекулами субстрата; 2) ферменты оказывают свое действие в ничтожно малых концентрациях; Например: 1 молекула реннина (содержится в слизистой оболочке желудка теленка) створаживает около 106 молекул казеиногена молока за 10 минут при 37 0C; 3) наличие фермента (катализатора) не оказывает влияния как на величину константы равновесия, так и на изменения свободной энергии. Катализаторы лишь повышают скорость реакций (точку равновесия не сдвигают). 1. Термолабильность ферментов. Скорость химической реакции зависит от температуры. Реакции, катализируемые ферментами, так же чувствительны к изменениям температуры. Скорость химической реакции повышается в два раза при повышении температуры на 10 0C. Ускорение реакции идет до 45 0C, затем, в связи с денатурацией белка-фермента, снижается. При 100 0C почти все ферменты полностью утрачивают свою активность. Оптимальной температурой для ферментов теплокровных является 37-40 0C. При низких температурах (0° и ниже) ферменты не разрушаются, не денатурируют, но активность их снижается до нуля рис. 4.3.). 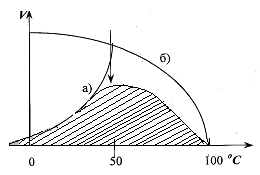 Рис.4.3. Влияние температуры на скорость катализируемой ферментом реакции. а - повышение скорости реакции как функция температуры; б - понижение скорости реакции как функция денатурации белка-фермента; стрелка (→) указывает оптимум температуры. 2. Зависимость активности ферментов от рН среды. Ферменты обычно активны в узких пределах значений рН, как правило, рН 6,0-8,0. Каждый фермент имеет свой оптимум рН. рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключением является пепсин, рН-оптимум которого – 2,0. Объясняется это функцией пепсина, т.к. в желудочном соке содержится свободная соляная кислота, создающая кислое значение рН. Влияние изменений рН среды на активность фермента заключается в том, что изменяется степень ионизации кислотных и основных групп (-COOH, -SH, имидазольной, -NH2 и т.д.). При разных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса (рис.4.4). 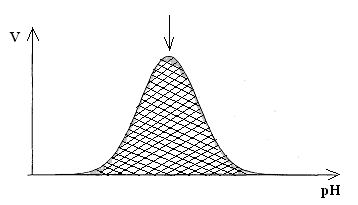 Рис.4.4. Влияние рН на скорость катализируемой ферментом реакции (стрелка указывает оптимум рН). 3. Специфичность ферментов. Ферменты обладают высокой специфичностью действия и этим существенно отличаются от неорганических катализаторов. Например: измельченная платина или палладий могут катализировать восстановление десятков соединений различной структуры. А фермент обычно проявляет свою активность только при полном соответствии активного центра и субстрата, только при «узнавании» обычно протекает одна высокоспецифичная реакция среди тысячи других химических реакций, осуществляемых в живой клетке. В зависимости от механизма действия различают ферменты с относительной или групповой и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов характерна относительная специфичность. Например, пепсин расщепляет белки животного и растительного происхождения, хотя они могут отличаться по химическому строению, аминокислотному составу и физико-химическим свойствам. Однако пепсин не расщепляет жиры и углеводы; пепсин разрывает пептидную связь - СО–NH - между аминокислотами. Липаза, катализирующая гидролиз жиров на глицерин и жирные кислоты, разрывает сложноэфирные связи. Аналогично групповой специфичностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидролизирующие α-гликозидные связи в полисахаридах. Указанные ферменты пищеварительные, их групповая специфичность имеет биологический смысл. Абсолютная специфичность – это способность фермента катализировать превращение только единственного субстрата. Например: аргиназа, расщепляющая в организме аргинин; уреаза, катализирующая распад мочевины и др. Стереохимическая специфичность: оксидазы (аминокислот) действуют только на свой специфический стереоизомер – L- или D-аминокислот. Специфичностью обладают также ферменты, катализирующие синтетические реакции. Факторы, определяющие активность ферментов Концентрация субстрата и фермента имеют непосредственное отношение к скорости реакции. Концентрация субстрата имеет до определенного предела прямую зависимость: чем выше концентрация, тем больше продукта реакции. Содержание фермента имеет также прямую зависимость: чем выше концентрация, тем больше продукта. Такая прямая зависимость отмечается до полунасыщения субстрата и фермента. Активирование и ингибирование ферментов Активность фермента зависит от присутствия активаторов, в качестве которых могут выступать различные соединения, например, HCl – для пепсина; желчные кислоты – для панкреатической липазы; глутатион, цистеин, витамин С – для тканевых ферментов и папаина (растительный фермент); ионы металлов – для многих ферментов (табл.4.2.). Обычно трудно провести грань между металлоферментами и ферментами, активируемыми ионами металлов (последние легко диссоциируют). Некоторые ферменты вообще неактивны в отсутствии металлов. Например, при удалении ионов цинка угольная ангидраза практически лишена ферментативной активности, при этом Zn2+ не может быть заменен ионом другого металла. В ряде случаев ионы металлов выполняют роль простетических групп ферментов. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Ингибиторы – полностью или частично подавляют активность ферментов. К таким факторам относятся, прежде всего агенты, вызывающие денатурацию белка: нагревание, кислоты, щелочи, соли тяжелых металлов. Таблица 4.2. Участие ионов металлов в активировании ферментов.
Специфические ингибиторы – подавляют активность какого-либо одного фермента или группы ферментов. Изучение действия этих ингибиторов имеет важное значение, они могут дать ценную информацию о природе активного центра фермента, о механизме образования фермент-субстратного комплекса. Известны вещества, специфически связывающие ту или иную группу в молекуле фермента, выключая ее из химической реакции. Например, JCH2 - COOH (йодацетат), его амид и ряд других соединений легко входят в связь с SH-группами ферментов. Ряд ферментов блокируется фосфорорганическими соединениями. Ингибиторы позволяют определить функции множественных форм ферментов (изоэнзимов). На ингибировании ферментов основан механизм действия многих токсинов и ядов на организм. Например, при отравлениях синильной кислотой смерть наступает как результат торможения дыхательных ферментов. Влияние инсектицидов – результат блокирования фермента холинэстеразы. Нервно-паралитические яды (зоман, зарин, Vx) тоже блокируют ферменты. Типы ингибирования Различают обратимое, необратимое и конкурентное ингибирование. Конкурентное ингибирование вызывается веществами, имеющими структуру, похожую на субстрат, но немного отличающуюся от структуры истинного субстрата. Примером является торможение активности сукцинатдегидрогеназы малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты в фумаровую (рис. 4.5). Если в среду добавить малоновую кислоту (ингибитор), то в силу структурного сходства ее с истинным субстратом янтарной кислотой (наличие двух ионизированных карбоксильных групп) она будет реагировать с активным центром с образованием фермент-ингибиторного комплекса. Однако при этом перенос водорода от малоната не происходит, т.к. структура субстрата янтарной кислоты и малоната несколько отличаются, они конкурируют за связывание с активным центром и степень ингибирования будет зависеть от соотношений количества янтарной и малоновой кислот. Метод конкурентного торможения широко применяется в медицине и ветеринарии, в частности действие сульфаниламидных препаратов рассчитано на такое ингибирование. 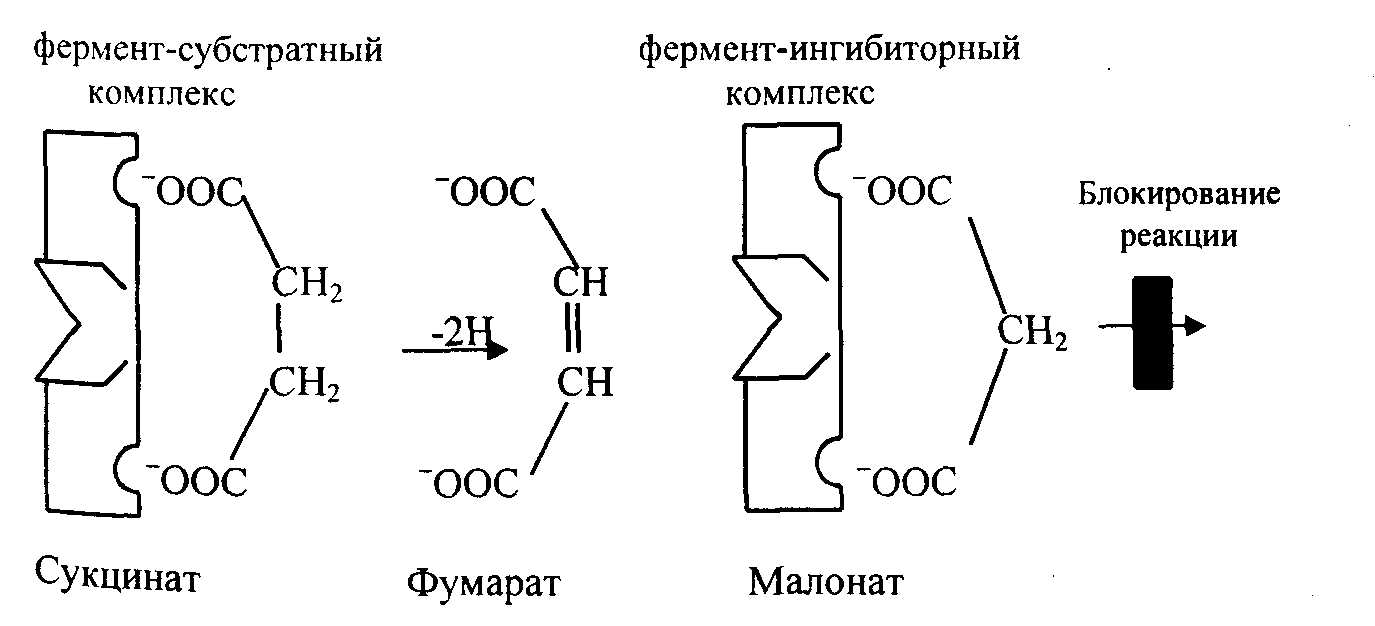 Рис.4.5. Схема конкурентного ингибирования фермента. Так, бактерии используют парааминобензойную кислоту для синтеза фолиевой кислоты, необходимой для их роста. n-аминобензойная кислота сульфаниламид Благодаря структурному сходству сульфаниламид блокирует действие фермента, в результате рост бактерий подавляется. Некоторые аналоги витамина B6 и фолиевой кислоты, в частности, дезоксиптиридоксин и аминоптерин действуют как конкурентные ингибиторы (антивитамины), тормозящие многие биохимические процессы в организме. Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. При этом образуется ковалентная связь и вследствие этого фермент инактивируется полностью, а торможение (ингибирование) бывает необратимым. Например: действие йодоцетата, соляной кислоты и др. На активность фермента влияют следующие факторы:
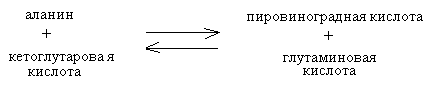 2. Изменение количества фермента. На бактериях хорошо изучено индуцирование синтеза фермента, когда источником питания является один продукт, например, глюкоза. Когда глюкоза заменяется на лактозу, то появляется новый фермент – галактозидаза, расщепляющий лактозу на глюкозу и галактозу. 3. Активирование проферментов. Протеолитические ферменты желудочно-кишечного тракта и поджелудочной железы синтезируются в неактивной форме в виде проферментов (зимогенов). Активирование их происходит под действием специфических агентов. Например: трипсиноген (поджелудочная железа) в кишечнике превращается в трипсин под действием энтерокиназы (открыто в лаборатории И.П. Павлова). 4. Химическая модификация фермента: ключевые ферменты энергетического обмена – фосфорилаза, гликогеназа и др. контролируются путем химической модификации – фосфорилирования и дефосфорилирования. 5. Регуляция активности ферментов по принципу обратной связи – распространенная форма регуляции. Концентрация конечного продукта является мощным ингибирующим фактором. Например: в клетках E.coli изолейцин, являющийся конечным продуктом, избирательно подавляет активность треониндегидратазы (первую фазу превращения в изолейцин). 6. Другие типы регуляции: к ним могут быть отнесены конкуренция ферментов за общий субстрат, выключение одного из ферментов (изоферментов). О количестве фермента судят по скорости катализируемой реакции при определенных условиях – или по убыли субстрата или по образованию продукта реакции. За единицу (E) любого фермента принимается то его количество, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в минуту (мкМоль/мин). Кроме того, активность фермента обозначают в каталах (kat) – 1 моль/сек. IE ферм.=16,67 нкатал. Для выражения активности фермента пользуются определением активности: удельной, молекулярной. Удельная активность фермента – это единица ферментативной активности на 1 мг белка. Молекулярная активность – это число молекул субстрата, подвергающаяся превращению одной молекулой фермента в минуту. Например: одна молекула каталазы эритроцитов способна расщепить в 1 мин 5-106 молекул H2O2. Классификация и номенклатура ферментов Рациональная номенклатура ферментов составляется путем прибавления к латинскому корню названия субстрата, на который действует фермент, или к названию процесса, катализируемого ферментом, окончания "аза". Например, фермент, воздействующий на крахмал (amylum), называется амилаза; мочевину (urea) – уреаза; фенолы – фенолаза и т.д. Кроме рационального названия сохранились ранее появившиеся термины: пепсин, трипсин. В 1961 г. принята новая международная классификация, в основу которой принят тип катализируемой реакции. В настоящее время известно около 3000 различных ферментов. Классификацию их проводят по типу их действия. Различают 6 классов ферментов: 1 .Оксидоредуктазы – окислительно-восстановительные ферменты; катализируют биологическое окисление. 2.Трансферазы – катализируют реакции переноса различных химических групп от одной молекулы (донора) к другой молекуле (акцептору). 3. Гидролазы – осуществляют химические превращения веществ с участием молекулы воды. 4. Лиазы – отщепляют от субстратов ту или иную группу негидролитическим путем. 5. Изомеразы – осуществляют изомерные превращения соединений. 6. Лигазы (синтетазы) – катализируют реакции синтеза, сопровождающиеся отщеплением фосфорной кислоты от АТФ или другого трифосфата. I класс. Оксидоредуктазы – это ферменты окислительно-восстановительных реакций, лежащих в основе биологического окисления. Название ферментов составляется по следующей форме: название субстрата (донора), от которого отщепляются атомы водорода (электроны), название акцептора, на который переносятся атомы водорода и оканчивается названием "оксидоредуктаза": например, лактат: НАД-оксидоредуктаза. Различают следующие подклассы: 1) аэробные дегидрогеназы, которые переносят электроны и протоны водорода с окисляемого субстрата на кислород: H2S + O2 сероводород к ним относятся ферменты оксидазы; 2) анаэробные дегидрогеназы переносят электроны и протоны водорода с окисляемого на другой субстрат. К ним относятся пиридинзависимые и флавинзависимые дегидрогеназы. Например, окисление молочной кислоты происходит под действием лактатдегидрогеназы, при этом НАД восстанавливается в НАДН2: 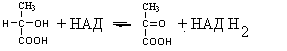 молочная кислота пировиноградная кислота Окисление янтарной кислоты происходит под действием сукцинатдегидоогеназы, при этом ФАД восстанавливается в ФАДН2. 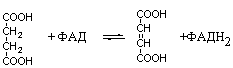 янтарная кислота фумаровая кислота 3) электронтранспортазы – переносчики электронов. К ним относятся цитохромные ферменты, цитохромоксидазы дыхательной цепи митохондрий 4) пероксидаза и каталаза. Пероксидаза катализирует окисление субстрата перекисью водорода. Например, под действием пероксидазы сероводород окисляется с участием перекиси водорода: H   2 S + H2O2 S окисленная + 2H2O 2 S + H2O2 S окисленная + 2H2OКаталаза в организме животных разрушает перекись водорода на воду и молекулярный кислород: 2   H2O2 2H2O + O2 H2O2 2H2O + O2Каталаза обезвреживает действие перекиси и является источником молекулярного кислорода в тканях. II класс. Трансферазы – катализируют реакции переноса атомов и групп атомов, включают следующие подклассы: 1) Аминоферазы – ферменты, переносящие аминогруппы с одного вещества на другое. Коферментом является производное витамина B6 (пиридоксин): например, глутаминовая кислота отдает аминную группу на пируват, в результате синтезируется аланин и образуется а-кетоглутаровая кислота. 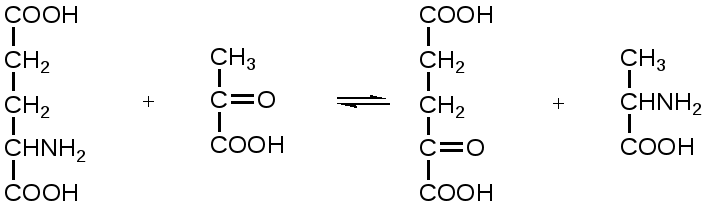 глутаминовая пируват α - кетоглутаровая аланин кислота кислота Пиридоксин – фермент, осуществляющий эту реакцию, называется 1-глутамил:пируватаминотрансфераза или по старой номенклатуре – аминофераза. 2) Ацилтрансферазы – ускоряют перенос ацилов (остатков карбоновых кислот) на аминокислоты, спирты и другие соединения. Например, синтез ацетилхолина осуществляется с участием фермента холинацетилтрансферазы: 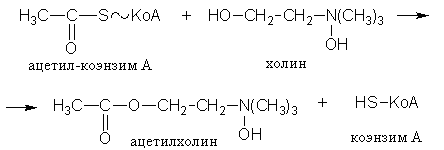 3) Фосфотрансферазы – ферменты, ускоряющие реакцию переноса остатка фосфорной кислоты. Донором фосфатных остатков чаще всего является АТФ. Например, гексокиназа ускоряет перенос остатка фосфорной кислоты на глюкозу: 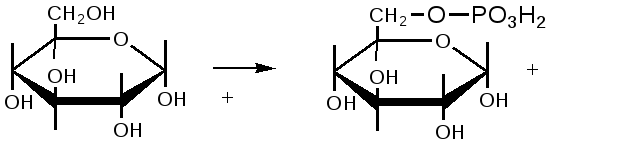 α-D -глюкоза глюкозо-6-фосфат 4) Метилферазы - ферменты, переносящие метильную группу с одного соединения на другое: например, при синтезе креатина донором метильной группы является метионин. 5) Глюкозилтрансферазы - переносчики глюкозидных остатков: 1  1(C6H12O6) + УДФ - глюкоза (n+1) (C6H12O6) + УДФ 1(C6H12O6) + УДФ - глюкоза (n+1) (C6H12O6) + УДФк ним относятся гликогенсинтазы, глюкозилтрансферазы, фосфорибозилтрансферазы и т.д. 6) Алкилтрансферазы – переносчики спиртовых остатков. К ним относятся холинтрансфераза, фосфатилдиэтаноламин-трансфераза и др. 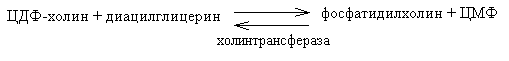 III класс. Гидролазы - разрывают внутримолекулярные связи путем присоединения элементов воды: R 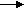 - R1 + HOH R - H + R1 - ОН - R1 + HOH R - H + R1 - ОНК ним относятся следующие подклассы: 1) Эстеразы - ферменты, гидролизирующие эфирные связи по схеме: R 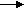 1-0-R2+ HOH R1-H+ R2-OH 1-0-R2+ HOH R1-H+ R2-OHНапример, фосфодиэстеразы - гидролизуют фосфорные эфиры: Д 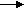 иацилглицерин 3-фосфорная кислота + HOH диацилглицерин + H3PO4. иацилглицерин 3-фосфорная кислота + HOH диацилглицерин + H3PO4.К этому подклассу относятся: фосфатазы (кислая, щелочная), глюкозо-6-глюкозо-1-фосфатаза, РНК-аза и др. Карбоксиэстеразы – гидролизуют сложные эфирные связи:  тристеарин глицерин стеариновая кислота К этим ферментам относятся липазы, лецитиназы, простые эстеразы и т.д. Сульфоэстеразы – гидролизуют сернокислые эфиры по следующей схеме: фенолсерная кислота фенол серная кислота 2) Гликозидазы – гидролизуют гликозидные связи, к ним относятся α- и β-амилазы, мальтаза, лактаза, сахараза. 3) Пептидазы. Различают эндопептидазы – пепсин, трипсин, хемотрипсин; экзопептидазы – аминопептидаза, карбоксипептидаза, дипептидазы, трипептидазы. Пептидазы гидролизуют пептидные связи по следующей реакции: 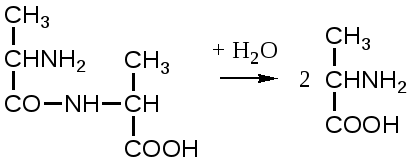 аланилаланин аланин В результате гидролиза образуется две молекулы аланина. 4) Амидазы – ферменты, гидролизующие амидные связи пуриновых и пиримидиновых оснований, амидов аминокислот и аргинина. Примеры: а 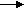 ) Аденин + H2O гипоксантин + NH3 ) Аденин + H2O гипоксантин + NH3пуриндезаминаза  глутаминовая глутамин кислота  аргинин мочевина орнитин 5) Полифосфатазы - гидролизуют фосфорноангидридные связи: АТФаза А  ТФ + H2O АДФ + H3PO4 ТФ + H2O АДФ + H3PO4К этой группе относятся Na+, K+, Mg2+-ATФaзa, и др. IV класс. Лиазы – ферменты, расщепляющие связи без Участия воды, разрывая при этом C-C связи, C-N связи, C-O связи. К ним относятся ферменты альдолаза, декарбоксилаза и другие. Например, альдолаза разрывает C-C связи гексозы (1,6 -дифосфофруктозы) с образованием двух триоз, фосфодиоксиацетона и фосфоглицеринового альдегида: 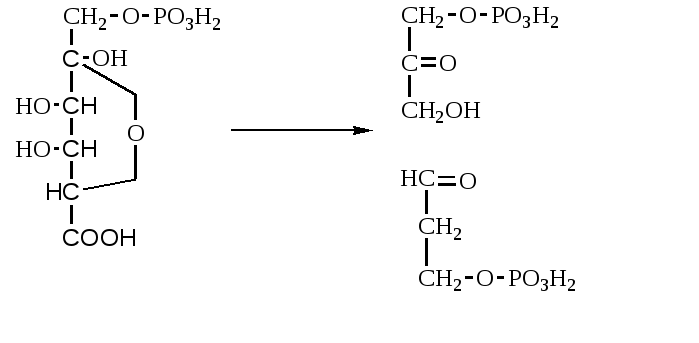 V класс. Изомеразы: катализируют изомеризацию, изомерные превращения молекул, например, молекулы глюкозы во фруктозу. Мутазы изменяют местоположение различных групп или атомов в молекуле. К ним относятся: фосфоглицеромутаза, фосфоглюкомутаза, фосфофруктомутаза и т.д. Например, фосфодиоксиацетон под действием изомеразы превращается в фосфоглицериновый альдегид: 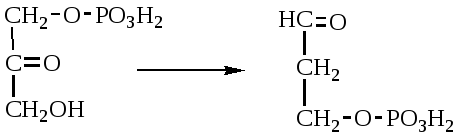 фосфодиоксиацетон фосфоглицериновый альдегид VIкласс. Лигазы (синтетазы) – ферменты, катализирующие присоединение молекул друг к другу. Например: а 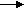 минокислота + тРНК аминоацил-тРНК минокислота + тРНК аминоацил-тРНКСюда относятся ферменты: ДНК-полимеразы, РНК-полимеразы, ферменты, катализирующие синтез белков и т.д. Применение ферментов. Ферменты получили широкое применение в животноводстве и ветеринарии или в виде свободных ферментных препаратов или же в виде иммобилизованных ферментов. Иммобилизацию ферментов производят путем прикрепления к структурам, не растворимым в воде. Иммобилизованные ферменты легко отделяются от реакционной среды, что позволяет вести процесс непрерывно. Носителем фермента могут быть селикагель, окись алюминия, активированный уголь, полисахариды, иониты, органические полимеры. Связывание фермента может осуществляться методом ковалентного связывания, электростатического связывания, сополимеризации или же фермент может быть включен в полимер, инкапсулирован, включен в липосомы. Для связывания фермента важно при этом сохранение активного центра фермента. В качестве мостика часто используют глутаровый альдегид, бромистый циан (CNBr). Молекулу фермента можно заключить в капсулы, ограниченные мембраной, фиксировать в полимерах, при этом наиболее удобным является полимеризация в полиэтиленгликоле (ПЭГ), в полиакриламиде (ПААГ). Сейчас добились функционирования фермента в течение одного месяца при 60-700C. Использоваться иммобилизованные ферменты могут для аналитических целей, для получения биологических продуктов или же для лечения (в медицине, ветеринарии). 1. Применение в аналитических целях. Существует два типа устройств с иммобилизованными ферментами, применяемые в аналитических целях – ферментные электроды и автоматические анализаторы. Ферментный электрод – это датчик, способный генерировать электрический потенциал в результате реакции, катализируемый иммобилизованным ферментом. Разработаны ферментные электроды для определения глюкозы, мочевины, аминокислот, спирта, пенициллина и ряда других веществ. Например, глюкозочувствительный ферментный электрод содержит иммобилизованную глюкозооксидазу, которая катализирует удаление протонов водорода из раствора со скоростью, зависящей от концентрации в среде глюкозы: 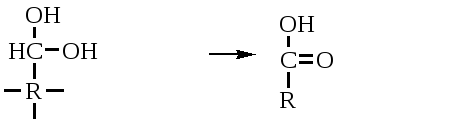 то есть, окисление альдегидов происходит путем дегидрирования. Альдегиды существуют в водных растворах в форме гидратов: 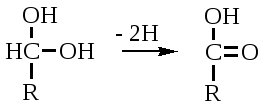 атом водорода затем переходит через пленку к платиновому электроду, меняет потенциал (рН), что и регистрируется прибором. По этому принципу разработан прибор для определения сахара в крови. Прибор напоминает авторучку, где имеется пластинка для нанесения пробы крови (каплю) и экран, указывающий содержание глюкозы в процентах в пробе. Результат получается через 30 секунд после нанесения пробы. В приборе иммобилизованный фермент реагирует с глюкозой, электрический ток (потенциал) показывает на экране процент глюкозы. По этому же принципу сейчас пользуются индикаторной бумагой, например, для определения глюкозы в моче больных сахарным диабетом: на индикаторную бумагу наносится капля мочи, и, если в ней содержится глюкоза, то под действием иммобилизованного фермента глюкоза окисляется в глюконовую кислоту, что в свою очередь изменяет рН. Показатель очень удобен для контроля состояния больных и назначения лечения. Разрабатываются подобные приборы для определения холестерина в крови (показатель атеросклероза) и других соединений. 2. Применение ферментов с лечебной целью. Для этого выпускаются ферментные препараты или свободные, или же иммобилизованные. Ферментные препараты, применяемые преимущественно при гнойно-некротических процессах: трипсин, химотрипсин, химопсин, террилитин (Asp.terricola), РНК-аза, ДНК-аза, коллагеназа, аспераза, лизоамидаза (бактериальный фермент), профезим, карипазин (из папайи), лекозим. Ферментные препараты, улучшающие процессы пищеварения: пепсин, сок желудочный, пепсидал, аболин, панкреатин, ораза, сализим, нигедаза (липолитический фермент). Для применения в ветеринарии выпускаются иммобилизованные ферменты: фермсорб – сополимер метакриловой кислоты и триэтиленгликоль – диметакрилата с сорбированными на нем литическими ферментами. Происходит лизис клеточной оболочки и сорбции полимерной матрицей патогенных микроорганизмов. При диарее телят различной этиологии препарат дают внутрь с кипяченой водой 3 раза в день. Полиферм – сополимер метакриловой кислоты и триэтиленгликоль диметакриловой кислоты с сорбированными в нем протеолитическими ферментами. При лечении желудочно-кишечных болезней молодняка успешно применяют протеолитические ферменты – пепсин, амилосубтилин, протосубтилин, иммобилизованные ферменты профезим, иммозим. Лизосубтилин – универсальный протеолитический фермент производится у нас в стране в больших объемах. Лизоцим, гликозидаза, коллитин – бактериолитические ферменты, применяют при желудочно-кишечных заболеваниях молодняка сельскохозяйственных животных. Фермент гиалуронидаза (лидаза) разрушает гиалуроновую кислоту, тем самым улучшает проницаемость тканей. 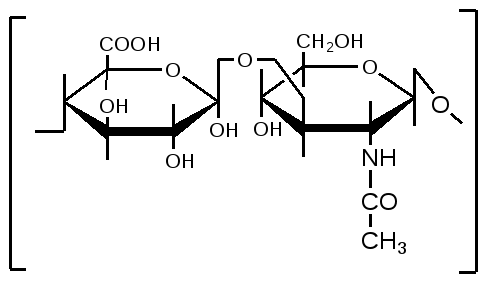 Гиалуроновая кислота Полимер из глюкуроновой кислоты + ацетилгюкозамина является межклеточным веществом, содержится в структуре кожи, связок, регулирует поступление различных соединений, питательных веществ. Ферменты – ДНК-аза, РНК-аза применяются для разложения слизистой массы дыхательных путей – для ингаляции, виде салфетки, пропитанной ферментами гиалуронидазой, ДНК-азой, РНК-азой. 3. Применение ферментных препаратов в кормлении животных. В настоящее время в кормлении животных и кормопроизводстве широкое распространение находят ферментные препараты, с помощью которых можно существенно улучшить переваримость и усвоение организмом питательных веществ корма, а также ускорить процессы пищеварения. Для этой цели промышленность выпускает различные ферментные препараты бактерий и грибков. Их получают путем глубинного (Г) или поверхностного (II) культивирования, затем высушивают путём распылительной сушки. Благодаря этому активность фермента повышается по сравнению с исходной в 3, 10, 15 раз, что обозначается как 3х, 10x, 15х. Широкое применение получили ферментные препараты амилосубтилин и протосубтилин, полученные выращиванием специальных штаммов Bacillussubtilis. Амилосубтилин ГЗх содержит альфа-амилазу, протеазы, бета-глюказу. Стандартизируется по альфа-амилазной активности. Протосубтилин ГЗх, содержит те же ферменты, но стандартизируется по нейтральной протеазе. Различные штаммы Aspergillusawamori служат продуцентами для глюкаваморина, пектаварина, ксилаваморина. Глюкаваморин П10х содержит альфа-амилазу декстриназу, мальтазу, глюкоамилазу, кислую протеазу, гемицеллюлазу, стандартизируется по декстриназе. Пектаваморин ГЗх содержит полигалактуроназу, полиметилгалактуроназу, пектинэстеразу, кислую протеазу, стандартизируется по общей пектолитической активности. Ксилаваморин ГЗх содержит гемицеллюлазу и пектиназу, стандартизируется по гемицеллюлазной активности. Из культуры Aspergillusoryzae получают препарат амилоризин П10х, который содержит альфа-амилазу, декстриназу, мальтазу, протеазу, стандартизируется по альфа-амилазе. Кроме того, производят ферментные препараты пектофоетидин ГЗх, пектоклостридин, пектонигрин и т.д. Добавление указанных ферментных препаратов в корм животных значительно улучшает переваримость грубых кормов, усвоение питательных веществ и увеличение продуктивности. Использование иммобилизованных ферментов для производства биологических соединений Иммобилизованные ферменты широко применяются для производства различных продуктов и лекарственных препаратов. Иммобилизованный фермент впервые в промышленном масштабе был использован для разделения рацемических смесей D- и L-аминокислот (Япония, 1969 г.). Сейчас реализовано получение L-аспарагиновой кислоты, L-тирозина, L-триптофана и других аминокислот путем присоединения к аминокислотам остатка уксусной кислоты (ацил) и воздействия аминоацилазой, которая гидролизует только ацил L-аминокислот. В промышленном масштабе получают инвертный сахар (смесь глюкозы и фруктозы, возникающая в результате гидролиза сахарозы) с помощью иммобилизованной β-фруктофуранозидазы (сахаразы). Этот фермент очень устойчив и за десять лет непрерывной работы одного из реакторов его активность снизилась всего на 10%. С помощью иммобилизованного фермента глюкозоизомеразы в больших объемах получают из кукурузного крахмала смесь глюкозы и фруктозы. Этот фермент глюкозу превращает во фруктозу. Такие установки функционируют в США (с 1972 г.), ФРГ, Дании, Голландии. В нашей стране изомеризацию глюкозы в фруктозу ведут в реакторе с помощью глюкозоизомеразы из Actinomycesolivocinereus, иммобилизованной на силохроме. Глюкозо-фруктозная смесь является очень важным продуктом для больных сахарным диабетом. Иммобилизованные ферменты широко применяются для синтеза аминокислот. Так, в 1974 г. в Японии начат промышленный синтез L-аспарагиновой кислоты с участием фермента аспартат-аммиаклиазы, иммобилизованный на фенол-формальдегидной смоле. Фермент осуществляет образование L-аспарагиновой кислоты из аммония и фумаровой кислоты. L-триптофан синтезируют из индола и серина при помощи фермента триптофан-синтетазы, L-тирозина с участием иммобилизованной тирозин-фенол-лиазы. Иммобилизованные ферменты применяются для производства антибиотиков и гормональных препаратов. Для производства некоторых продуктов удобнее пользоваться не иммобилизованными ферментами, а иммобилизованными микробными клетками – продуцентами ферментов. Так, этанол получают из глюкозы с помощью иммобилизованных в полиакриламидном геле клеток Saccharomycescerevisiae. Первый в мире промышленный реактор проточного типа объемом в одну тонну по синтезу L-аспарагиновой кислоты из фумарата аммония был запущен в Японии (1973 г.). В нем использованы иммобилизованные в полиакриламидном геле клетки кишечной палочки (Esherichiacoli), содержащие аспартат-аммиак-лиазу:  фумарат аспарагиновая аммония кислота Реактор давал около 2000 кг L-аспарагиновой кислоты в сутки при 95%-ном уровне превращения в нее введенного фумарата аммония. При подкислении элюата до рН 2,8 и охлаждении до 15оC аспарагиновая кислота выделялась в виде кристаллов. Иммобилизованные клетки E.coli сохраняли активность фермента в течение четырех месяцев, в то время как интактные клетки только в течение 10 дней. L-изолейцин синтезируют из треонина и глюкозы при посредстве иммобилизованных клеток Serratiamarcescens с выходом до 4 г/л элюата с колонки реактора. Таким же образом получают незаменимую аминокислоту L- лизин: 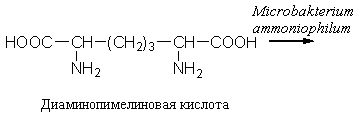 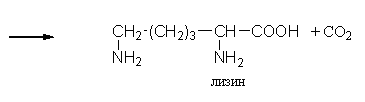 При помощи иммобилизованных клеток Corynobacteriumglutamicum производят L-глутаминовую кислоту из глюкозы; Ecoli – L-триптофан из индола, Streptococusfaecalis – L-орнитин из L-аргинина. С помощью иммобилизованных микроорганизмов синтезируют L-формы аминокислот – аланина, фенилаланина, метионина, треонина. Таким образом, производство L-аминокислот для питания человека и выращивания сельскохозяйственных животных и птиц осуществляется в основном в реакторах с иммобилизованными клетками. Отработаны способы получения яблочной кислоты из фумаровой, пропионовой, уксусной и пировиноградной кислот из глюкозы, лактозы или лактата натрия в проточной системе с клетками пропионовокислых бактерий, иммобилизованными в полиакриламидный гель. Иммобилизованные ферменты широко применяют для производства различных гормональных препаратов. Производится в больших масштабах аспартам – метиловый эфир аспартил-фенилаланина: 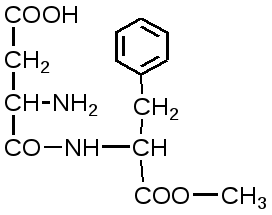 Аспартам Аспартам в 300 раз слаще сахара, безвреден, в организме расщепляется на аспарагиновую кислоту и фенилаланин, используется для детского питания, добавляется в диетическую кока-колу. Ферменты, синтезирующие аспарагиновую кислоту и фенилаланин, получены генно-инженерным методом. Иммуноферментный анализ и его использование в ветеринарии Для диагностики инфекционных болезней животных применяются различные методы исследований, в том числе серологические и иммунохимические, основанные на реакции антиген-антитело. Главным компонентом иммунохимической реакции являются антитела (иммуноглобулины) – белки сыворотки крови, которые синтезируются в организме как проявление защитной реакции при попадании чужеродного вещества – антигена. Антитела представляют собой крупные белковые молекулы, состоящие из двух легких (L) и двух тяжелых (H) полипептидных цепей с Мм 22000 и 50000-70000 Да соответственно. Различают 5 классов иммуноглобулинов IgM, IgG, IgA, IgD, IgE, которые отличаются по Мм, размерам Н-цепей, последовательности аминокислот, углеводными компонентами, положению и количеству дисульфидных связей. Все γ-глобулины (антитела) имеют вариабельные участки – активные центры антител. Одна молекула антител может иметь несколько активных центров, способных специфически связываться с антигеном. Активный центр имеет уникальную специфичность, обеспечивающую тесную связь с антигеном, напоминающий соответствие между рукой и перчаткой, или ключом и замком. В качестве антигенов могут выступать белки, полисахариды, а также низкомолекулярные соединения: антибиотики, пестициды. Антитела образуются не против всей молекулы чужеродного белка, а только к небольшим участкам на их поверхности – антигенным детерминантам. Антигенными детерминантами белковых молекул чаще всего являются лишь около 5 аминокислотных остатков, а в случае бактериальных клеток в качестве антигенных детерминант выступают короткие цепи из 3-5 остатков сахаров, образующих стенки бактериальных клеток. Низкомолекулярные соединения (гаптены) могут образовать антитела лишь после соединения с макромолекулами. Для получения специфических иммуноглобулинов (антител) применяются различные методы иммунизации мелких (мыши, морские свинки, кролики, куры) и крупных (овцы, козы, лошади) животных. Принципиально новый метод получения антител – это метод гибридом. Для диагностики инфекционных болезней разработаны высокочувствительные методы – радиоиммунный и иммуноферментный. Радиоиммунный метод требует сложной аппаратуры, радиоактивных соединений, в частности J125, что связано с рядом ограничений, а потому неприемлим в обычных условиях. Иммуноферментный метод не уступает по чувствительности радиоиммунному, может использоваться в различных лабораторных условиях, а некоторые варианты его могут быть применены непосредственно в условиях животноводческих ферм, например, для определения беременности у коров по уровню содержания прогестерона в молоке. Иммуноферментный метод анализа позволяет определить до 10-14 моля вещества. Принцип метода заключается в том, что при взаимодействии антигена с антителом получается комплекс антиген-антитело. Количество антигена или антитела, вошедшее в комплекс антиген-антитело, может быть определено с помощью фермента, использованного для мечения антигена или антитела в зависимости от поставленной задачи. Сейчас разработаны сотни различных вариантов иммуноферментного анализа на твердом носителе. В этом случае антитела, иммобилизованные на твердой фазе (на иммунологических планшетах из полистирола), реагируют вначале с искомым антигеном (немеченым), а затем остающиеся свободными иммобилизованные антитела связываются с меченным (ферментом) антигеном. Количество связанного с меченным ферментом антигена обнаруживают с помощью соответствующего субстрата. Здесь фермент играет роль маркера, и использование его основано на том, что одна молекула фермента производит много молекул продуктов ферментативной реакции, концентрацию которых можно обнаружить обычными физико-химическими методами или же визуально (по изменению цвета). Иммуноферментный метод используют для выявления иммуноглобулинов, гормонов, вирусных и бактериальных антигенов, лекарственных препаратов, пестицидов и т.д. Для диагностики инфекционных болезней животных разработаны специальные наборы для диагностики классической чумы свиней, бруцеллеза крупного рогатого скота, бешенства, сибирской язвы, хламидийной инфекции, ротавирусов, инфекционного ринотрахеита и ряда других болезней сельскохозяйственных животных. Использование моноклональных антител делает иммуноферментный анализ еще более ценным, так как при этом в несколько раз повышается его чувствительность и специфичность. |
