биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
 Скачать 14.38 Mb. Скачать 14.38 Mb.
|
|
Биохимия животных Электронный дидактический комплекс (ЭДК) Настоящий электронный дидактический комплекс (ЭДК) объединяет в себе несколько функций учебных материалов:
В текстовой части кратко изложены основные термины и понятия с выделением ключевых слов. В дополнительный блок ЭДК помещены краткие учебные пособия, методические разработки по биохимии животных. Составители: заведующий кафедрой органической и биологической химии Казанской государственной академии ветеринарной медицины доктор ветеринарных наук профессор Хазипов Нариман Залилович, доцент кафедры биохимии Казанского государственного университета Аскарова Альфия Наримановна, доценты кафедры органической и биологической химии Казанской государственной академии ветеринарной медицины доктор биологических наук Логинов Георгий Павлович, Тюрикова Раиса Павловна, Закирова Лилия Азатовна, ассистент кафедры Казанской государственной академии ветеринарной медицины Шилова Светлана Вячеславовна. Техническое исполнение осуществлено кандидатом ветеринарных наук ассистентом КГАВМ Усольцевым Константином Валерьевичем. При разработке ЭДК были использованы учебники «Биохимия животных» (Н.З.Хазипов, А.Н.Аскарова, 2003 г.), «Биохимия» (В.П.Козлов, В.Н.Шведова, 2004 г.), «Физическая и коллоидная химия» (М.М.Равич-Щербо, В.В.Новиков, 1975), «Методическое пособие по физической и коллоидной химии» (Р.П.Тюрикова, 2001 г.). ФИЗИЧЕСКАЯ ХИМИЯ ВОДА Как известно, жизнь зародилась в воде и по-прежнему остается тесно связанной с водой. Вода является источником кислорода в атмосфере Земли. Это происходит при фотосинтезе в растениях, при этом энергия света преобразуется в энергию химических связей молекул. Животный мир может использовать только энергию, освободившуюся из этих химических связей в форме АТФ и других трифосфатов. Вода составляет от 50 до 98% от общей массы организма. Каждая клетка и каждая ткань содержит определенное количество воды, так кожа содержит 72%, сердце – 79%, спинной и головной мозг – 70%, кровь – 79%, лимфа – 96%. С помощью воды осуществляется перенос питательных веществ и продуктов обмена веществ; вода играет важную роль в осмотических явлениях, в сохранении коллоидного состояния протоплазмы и т.д. Вода обеспечивает растворение веществ, процессы всасывания, передвижения, набухания, осмоса и многих других. Высокая теплоемкость, теплопроводность, теплота испарения воды способствует поддержанию температуры тела у теплокровных животных. Она участвует в реакциях гидролиза, вызывает диссоциацию молекул (электролитов). Вода – конечный продукт обмена веществ в организме Уникальные свойства воды Н2О становятся очевидными при сравнении с метаном (СН4). Обе молекулы одинаковы по массе и размерам. Тем не менее температура кипения воды на 250°С выше по сравнению с температурой кипения метана. В результате вода на поверхности Земли находится в жидком, а метан – в газообразном состоянии. Высокая точка кипения воды является следствием высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным распределением электронной плотности в молекуле воды. Молекула воды имеет форму тетраэдра, в центре которого расположен атом кислорода. Две вершины тетраэдра заняты свободными электронными парами атома кислорода, а остальные две – атомами водорода. Поэтому связи Н—О—Н расположены под углом друг к другу. Кроме того, из-за высокой электроотрицательности атома кислорода связь О—Н полярна. т. е. молекула воды представляет собой электрический диполь. 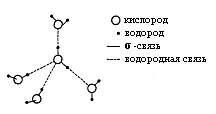 Каждая молекула тетраэдрически координирована с четырьмя другими молекулами воды, благодаря водородным связям энергия диссоциации водородной связи составляет 25 кДж/моль. Биполярное строение молекул воды благоприятствует образованию водородныхсвязей. Поэтому у воды в жидком состоянии многие молекулы связаны между собой водородными «мостиками». Часто образуются тетраэдрические структуры, так называемые "кластеры" воды. Поскольку в твердом состоянии расстояние между молекулами в среднем больше, чем в жидкости, плотность льда меньше по сравнению с плотностью воды. Это свойство воды очень важно в экологическом отношении, т.к. зимой на поверхности водоемов образуется слой льда, и они редко промерзают до дна. Вода имеет высокую константу диэлектрической проницаемости, т.е. в воде электростатическое притяжение двух противоположно заряженных ионов снижается примерно в 80 раз. В этом полярном растворителе (воде) хорошо растворяются полярные молекулы. Они окружаются молекулами воды, происходит гидратация молекул. Электростатические силы притяжения удерживают молекулы воды, тем самым разрушая межионные или внутримолекулярные связи самой гидратированной молекулы. 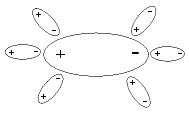 Рис.1.1. Электростатические силы притяжения АКТИВНАЯ РЕАКЦИЯ ВОДНЫХ РАСТВОРОВ Под активной реакцией среды понимают концентрацию водородных ионов. В числе различных физико-химических защитных констант организма таких, как изотермия, изотония и другие постоянство концентрации водородных ионов – изогидрия – имеет особо важное значение для биологических процессов организма. Физико-химическое состояние белков, каталитическая функция ферментов, активность солевых ионов зависят от концентрации ионов водорода. Ионное произведение воды. Водородный показатель Точные измерения показывают, что чистая дистиллированная вода в незначительной степени электропроводна. Следовательно, вода в некоторой степени диссоцирована, что можно представить уравнением: Для обратимых процессов константа диссоциаций (К) выражается уравнением: 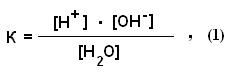 где [Н+ и [OH-] - концентрации ионов Н+ и ОН- при установившемся равновесии диссоциированных и недиссоциированных: молекул воды. Выражается эта концентрация в г-ионах на литр (г-ион/л), 1 г-ион Н+ = I г, I г-ион ОН- = 17 г. [Н2О] - равновесная концентрация недиссоцированных молекул воды, моль/л. Принимая во внимание, что из 555 млн. молекул воды диссоцирует только одна, можно допустить, что концентрация недиссоцированных молекул воды практически равна общей концентрации воды. Концентрация воды определяется количеством г-молей воды в I л. Таким образом, зная значения К и [H2O], из уравнения I можно определить величину произведения |Н+] и [OH-]: |Н+].[OH-] = К . [H2O] = 1,8.10-16 . 55,56 = 1 . 10-14, т.е. |Н+].[OH-] = 10-14 (2) Произведение концентрации ионов водорода и ионов гидроксида для воды при постоянной температуре есть величина постоянная и называется ионным произведением воды. Таким образом, связанные между собой концентрации гидроксид-ионов и ионов водорода являются величинами сопряженными. Следовательно, если добавлением кислоты увеличить концентрацию ионов водорода, то одновременно во столько же раз уменьшится концентрация гидроксид-ионов. Следовательно, по концентрации ионов водорода можно судить о характере среды: |Н+]= [OH-] = 10-7 - среда нейтральная; |Н+] > [OH-] > 10-7 - среда кислая; |Н+] < [OH-] < 10-7 - среда щелочная. Следует отметить, что характеризовать кислотностъ и щелочность раствора числами с отрицательными показателями степени очень неудобно. Поэтому степень кислотности растворов принято выражать не концентрацией ионов Н+, а ее десятичным логарифмом, взятым с обратным знаком. Эту величину называют водородным показателем и обозначают через рН: рН = -lg |Н+] (3) Следовательно, диапазон концентраций ионов водорода, выраженных через рН, будет представлен рядом натуральных чисел по схеме: 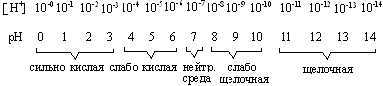 Рис. 1.2. Диапазон концентраций ионов водорода и значений рН среды При переводе сН+ в рН следует пользоваться таблицами логарифмов. Методы определения рН среды Кислотность среды оценивают рН-метрией. Один из способов определения рН основан на способности некоторых веществ, называемых индикаторами, изменять свою окраску в зависимости от рН среды. Каждый индикатор характеризуется определенным интервалом перехода окраски. Так, фенолфталеин меняет свою окраску от бесцветной до красной в пределах рН 8,2-10,0, а метилоранж – в пределах 3,1-4,4. Методы определения рН среды, основанные на изменении окраски индикаторов, называют колориметрическими. В настоящее время чаще всего используют универсальные индикаторы. Это смесь обычных индикаторов, изменяющая окраску в пределах рН от 2,0 до 10. При определении рН раствора универсальным индикатором каплю индикатора вносят в исследуемый раствор. Появившуюся окраску сравнивают с прилагаемым к индикатору спектром цветов, соответствующих определенным значениям рН. Точность измерения pН среды колориметрическим методом ± 0,1. В качестве индикатора может служить и бумага, пропитанная индикатором (бумажные индикаторы). Другим более точным методом определения рН является электрометрический метод, для определения концентраций водородных ионов в растворе злектрометрическим методом используются гальванические элементы, составленные из двух электродов – электрода сравнения с устойчивым и известным потенциалом и индикаторного (электрода измерения), потенциал которого зависит от концентрации ионов Н+ в растворе. В качестве электродов сравнения часто применяют водородный, хингидронный, сурьмяный и стеклянный электроды. Стеклянный электрод хорошо работает в агрессивных средах, потенциал его быстро устанавливается. Электродвижущая сила гальванического элемента может измеряться либо включением в цепь вольтметра, либо компенсационным методом. На практике пользуются только вторым из указанных методов. Сущность его состоит в том, что э.д.с. исследуемого гальванического элемента уравновешивается разностью потенциалов, которая получается на части реохорда компенсационной установки, питаемой двухвольтовым аккумулятором. Оба элемента присоединяются друг к другу одноименными полюсами. Роль активной реакции среды в биологических процессах Ионы Н+ и ОН– занимают особое место среди других ионов в связи со значительным влиянием их на течение многих химических реакций. Многие процессы в живом организме протекают при строго определенном значении рН среды. Так, желудочный сок животных имеет рН 0,9-1,5. Повышение и понижение кислотности его вызывает болезненные изменения в организме. Амилаза слюны оптимально работает при рН 6,8. Снижение рН крови даже на десятые доли рН существенно влияет на общее состояние организма. Таким образом, рН жидких сред организма входит в понятие гомеостаза, т.е. является одной из констант организма. Так, рН крови человека равен 7,36. Смещение этого значения в кислую сторону вызывает ацидоз, а в щелочную – алкалоз. Ниже приводится показатели концентрации водородных ионов крови животных, а также жидкостей организма.
Следует отметить, что рН среды играет большую роль в хлебопечении, сыроварении, изготовлении чая, кожи и многих других процессах Буферные pacтворы, состав, механизм действия Постоянство концентрации ионов водорода, являющейся одной из важнейших констант организма, поддерживается так называемыми буферными системами или растворами. Буферными системами (буферами) называют растворы, обладающие свойством поддерживать (в определенных пределах) постоянное значение рН как при добавлении к ним кислот или оснований, так и при разбавлении их водой. По своему составу буферные растворы бывают двух типов: кислые (состоят из слабой кислоты и её соли, полученной при взаимодействии с сильным основанием) и основные (состоят из слабого основания и его соли, образованной с сильной кислотой). Примером кислой буферной системы является ацетатный буфер :CH3COОH + CН3COONa, основного буферного раствора – аммиачный буфер:NH4OH + NH4Cl. Механизм действия буферных растворов можно рассмотреть на примере ацетатного буфера. В этом растворе происходят следующие реакции электролитической диссоциации: 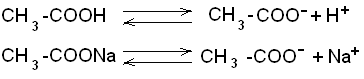 Так как степень диссоциации слабой уксусной кислоты очень мала, практически её можно считать недиссоциированной. Следовательно, кислотность буферной смеси мала. Натриевая соль уксусной кислоты, являясь сильным электролитом, диссоциирует практически полностью на ионы CH3COO– и Na+. Следовательно, концентрация ионов CH3COO– практически равна концентрации раствора соли (СН3СООNa), а концентрация недиссоциированной кислоты (СН3СООН) равна концентрации всей кислоты в растворе. Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система стремится сохранить при добавлении к ней кислоты или основания. Рассмотрим это на примере ацетатного буфера. В соответствии с законом действующих масс константа диссоциации уксусной кислоты равна: [H+] . [COO–] К = ——————— , (1) [CH3COOH] Так как концентрация недиссоциированной кислоты ([СН3СООН]) практически равна концентрации всей кислоты в растворе, а концентрация ионов CH3COО– равна концентрации соли (СН3СООNа ), получим: 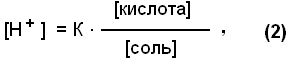 Если растворы кислоты и соли приготовлены в равных концентрациях, то 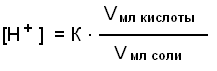 т.е. концентрация ионов водорода буферов зависит от соотношения объёмов кислоты и соли, взятых для приготовления буфера. Из уравнения (2) видно: 1) что разбавление буферных растворов водой не изменит соотношения концентраций кислоты и соли, а значит и значения [H+] и pН соответственно; 2)что при добавлении в буферный pacтвоp сильной кислоты, ионы Н+, образованные при её диссоциации, будут нейтрализованы (связаны) ионами СН3СОО– с образованием слабодиссоциирующей уксусной кислоты (СН3СООН); 3) при добавлении в буфер щелочи, её ионы ОН– будут связаны ионами Н+ с образованием Н2О – также слабодиссоциирующих молекул. И хотя этих ионов (Н+) образуется при диссоциации кислоты мало, выведение их из реакции смещает равновесие диссоциации кислоты в сторону образования ионов Н+ (принцип Ле-Шателье). Таким образом, добавление кислоты или щелочи незначительно изменит концентрацию ионов водорода буферной системы. Буферная емкость Предел, в котором проявляется буферное действие, называется буферной ёмкостью. Её выpaжaют количеством грамм-эквивалентов сильной кислоты или сильного основания, которые следует добавить к 1 л буферного раствора, чтобы сместить его рНна 1 единицу. 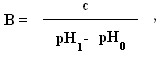 Где В – буферная емкость; с – количество грамм-эквивалентов; рНо – водородный показатель до добавления сильной кислоты или основания; рН1 – водороднй показатель после добавления. Наибольшей буферной емкостью обладают концентрированные буферные растворы. Из буферных растворов с равной концентрацией наибольшей емкостью будут обладать те, которые составлены из равного количества компонентов. Биологическое значение буферных систем Буферные системы в живых организмах поддерживают постоянство рН в крови и тканях. Исследования показали, что в процессе обмена веществ в организме образуется большое количество кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20-30 л I н. сильной кислоты. Сохранение постоянства рН среды в организме обеспечивается наличием в нем мощных буферных систем. Большую роль при этом играют белковый, бикарбонатный и фосфатный буферы. Буферной системой крови являются бикарбонатный и фосфатный буферы: Н2С03 + NaHCO3; NaH2P04 + Na2НРО4соответственно. Однако наиболее мощной буферной системой крови является гемоглобиновый буфер (75% всей буферной ёмкости крови), который удаляет из организма большое количество углекислоты. Большое значение в поддержании постоянного рН в клетках тканей имеет белковый буфep. Он состоит из протеина (белка) – Pt и его соли. Компоненты этого буфера можно представить как: 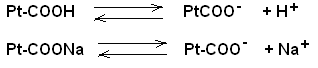 КОЛЛОИДНАЯ ХИМИЯ Коллоидная химия изучает физическую химию гетерогенных высокодисперсных систем и растворов высокомолекулярных соединений. Дисперсные системы – это системы, состоящие из вещества, раздробленного или размельченного до частиц определенной величины, равномерно распределенного в другом веществе. Распределяемое вещество – дисперсная фаза, а вещество, в котором распределена дисперсная фаза – дисперсионная среда. Классификация дисперсных систем А. По величине частиц дисперсной фазы все дисперсные системы дeлят на 3 группы:
К истинным растворам принадлежат и растворы высокомолекулярных веществ, молекулярная масса которых достигает сотен тысяч дальтон. Это тоже гомогенные системы. Но так как размеры их частиц сравнимы с таковыми коллоидных растворов, то они обладают целым рядом свойств коллоидных растворов. Б. Дисперсные системы классифицируют также и по агрегатному состоянию дисперсной фазы и дисперсионной среды:
С. По степени взаимодействия дисперсной фазы и дисперсионной среды различают: лиофильные (гидрофильные) с сильным взаимодействием фазы и среды и лиофобные со слабым взаимодействием их. Таким образом, коллоидные растворы представляют coбой частный случай дисперсных систем. Процессы, протекающие с участием коллоидных систем, играют большое значение для жизнедеятельности организма, а также в металлургии, сельском хозяйстве, производстве бумаги, пластических масс а др. Поверхностные явления Поверхностные явления в коллоидах играют первостепенную роль, т.к. являясь микрогетерогенными системами, они обладают колоссальной поверхностью раздела между частицами дисперсной фазы и дисперсионной среды. Наличие сильно развитой поверхности в коллоидных растворах объясняет многие физико-химические особенности этих систем. Поэтому можно сказать, что коллоидная химия – это физическая химия дисперсных систем и поверхностных явлений. Адсорбция Концентрирование вещества, равномерно распределенного в одной из фaз дисперсной системы, на границе раздела фаз называется адсорбцией. Адсорбция обусловлена наличием адсорбционных сил, имеющих различную природу. Различают межмолеклярные (ван-дер-ваальсовы) ихимические (ионные, ковалентные) силы. Иногда адсорбция, начавшись на поверхности, распространяется в глубь частицы. Такой процесс называют абсорбцией, если такое поглощение сопровождается химическим взаимодействием, то такой процесс носит название хемосорбции. Вещество, способное адсорбировать на своей поверхности другое вещество или ионы, называется адсорбентом. Адсорбируемое вещество называется адсорбтивом. Явления адсорбции, абсорбции и хемосорбции объединены общим понятием сорбции. Процесс адсорбции обратим. Частицы в адсорбционных слоях совершают колебательные движения, то приближаясь к адсорбенту, то удаляясь от него. Некоторые из них могут выходить за пределы действия сил притяжения адсорбента. В этом случае наблюдается обратный процесс – десорбция, Со временем система приходит в состояние адсорбционного равновесия: Адсорбция носит избирательный характер. Так, например, активированный уголь хорошо поглощает хлор, но не адсорбирует окись углерода. Процесс адсорбции экзотермичен и, следовательно, в соответствии с принципом Ле-Шателье, с ростом температуры адсорбция падает, и равновесие сдвигается в сторону процесса десорбции. Все растворимые вещества по их способности адсорбироваться на границе раздела фаз делятся на две группы: поверхностно-активные (ПАВ) вещества и поверхностно-неактивные. Характерной особенностью ПАВ является то, что молекулы их содержат две части: полярную гидрофильную (растворимую в воде) и неполярную гидрофобную (в воде нерастворимую). При растворении таких веществ в воде они погружают свои гидрофильные группы в воду, а гидрофобная часть располагается выше уровня воды, т.е. как бы «торчит» из воды. 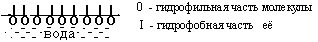 Рис.1.3. Ориентация ПВА на границе раздела фаз Если же поверхностно-активное вещество равномерно распределено в одной из двух неcмешивающихся жидкостей, то оно концентрируется на границе раздела этих двух фаз: 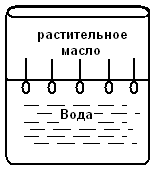 Рис.1.4. Концентрация частиц на границе раздела фаз (адсорбция) Обычно углеводородный радикал гидрофобный, а функциональные группы -ОН, -CООH, -NH2 и т.д. – гидрофильные Чем длиннее углеводородный радикал, тем меньше растворимость его в воде, но тем выше становится его способность к адсорбции. Эта закономерность получила название правила Траубе-Дюкло. Это правило применимо к разбавленным растворам. Процессы адсорбции происходят ив живых организмах. Роль твердого тела играют здесь мембраны и коллоидные частицы. Так, вещества, образующиеся после переваривания в желудочно-кишечном тракте белков, углеводов и т.д. (это соответственно аминокислоты, глюкоза и т.д.), попадают в кровь и адсорбируются из крови на внешней мембране клеток. Только после этого процесса клетка поглощает эти питательные вещества (служащие либо источником энергии, либо строительным материалом клеток). Одним из главных свойств абсорбции является её избирательность. На способности избирательного поглощения адсорбентами растворенных веществ основаны хроматографические методы анализа, позволяющие разделять сложные смеси на отдельные фракции. Впервые это метод был использован русским ботаником М.С.Цветом (1903 г.) для разделения зеленого вещества растений – хлорофилла на составные части. Хроматография широко применяется при разделении и очистке лекарственных веществ, витаминов, аминокислот, ионов, углеводородов нефтяных фракций и др. Впоследние годы широкое распространение получили методы ионообменной хроматографии. КОЛЛОИДНЫЕ РАСТВОРЫ (ЗОЛИ) Методы получения Коллоидные системы по степени дисперсности занимают промежуточное положение между грубодисперсными системами и истинными растворами. Поэтому их можно получать двумя путями: а) методами диспергирования – дроблением более крупных частиц доколлоидной степени дисперсности – механическим, электрическим, ультразвуком, пептизацией (превращение осадков в коллоидный раствор под влиянием химических веществ – пептизаторов); б) методами конденсации – укрупнением частиц в агрегаты коллоидной степени дисперсности (получение нерастворимых веществ в результате реакций различных типов); в) ультрафильтрацией через полупроницаемые мембраны. Строение коллоидных частиц Образование нерастворимого вещества в результате химической реакции – это лишь одно из условий получения коллоидного раствора. Другим не менее важным условием является неравенство исходных веществ, взятых в реакцию. Следствием этого неравенства является ограничение роста величины частиц коллоидах растворов, которое привело бы к образованию грубодисперсной системы. Механизм образования коллоидной частицы рассмотрим на примере образования золя иодистого серебра, который получается при взаимодействии разбавленных растворов азотнокислого серебра и йодистого калия. AgNO3 +KI = AgI + KNO3 Ag+ + NO3¯ +K+ + I¯ = AgI ↓ + NO3¯ + K+ Нерастворимые нейтральные молекулы йодистого серебра образуют ядро коллоидной частицы. Сначала эти молекулы соединяются в беспорядке, образуя аморфную, рыхлую структуру, которая постепенно превращается в высокоупорядоченную кристаллическую структуру ядра. В рассматриваемом нами примере ядро это кристаллик йодистого серебра, состоящий из большого числа (m) молекул AgI: m[Agl] - ядро коллоидной частицы На поверхности ядра происходит адсорбционный процесс. По правилу Пескова-Фаянса, на поверхности ядер коллоидных частиц адсорбируются ионы, входящие в состав ядра частицы, т.е. адсорбируются ионы серебра (Аg+) илиионы иода (I–). Из этих двух видов ионов адсорбируютcя те, которые находятся в избытке. Так, если получать коллоидный раствор в избытке йодистого калия, то адсорбироваться на частицах (ядрах) будут ионы иода, которые достраивают кристаллическую решетку ядра, естественно и прочно входя в его структуру. При этом образуется адсорбционный слой, который придает ядру отрицательный заряд: m{Ag] . nI-. Ионы, адсорбирующиеся на поверхности ядра, придавая ему соответствующий заряд, называются потенциалобразующими ионами. При этом в растворе находятся и противоположно заряженные ионы, их называют противоионами. В нашем случае это ионы калия (K+), которые электростатически притягиваются к заряженному ядру (величина заряда может достигать I в). Часть противоионов К+ прочно связывается электрическими и адсорбционными силам и и входит в адсорбционный слой. Ядро с образовавшимся на нем двойным адсорбционным слоем ионов называется гранулой. {m [AgI] . nI– . (n-x) K+}x– (структура гранулы) Оставшаяся часть противоионов (обозначим их числом "х К+") образует диффузный слой ионов. Ядро с адсорбционным и диффузным слоями называется мицеллой: {m [AgI] . nI–. (n-x) K+}x– . х К+ (структура мицеллы) При пропускании постоянного электрического тока через коллоидный раствор гранулы и противоионы двинутся к противоположно заряженным электродам соответственно. Наличие одноименного заряда на поверхности частиц золей является важным фактором его устойчивости. Заряд препятствует слипанию и укрупнению частиц. В устойчивой дисперсной системе частицы удерживаются во взвешенном состоянии, т.е. не происходит выпадения в осадок коллоидного вещества. Это свойство золей называется кинетической устойчивостью. Строение мицелл золя иодистого серебра, полученного в избытке AgNO3, представлено на рис. 1а, в избытке KCI - 1б. 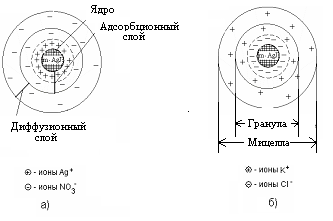 Рис.1.5. Строение мицелл золя иодистоого серебра, полученного в избытке: а) азотнокислого серебра; б) хлорида калия. Коагуляция. Седиментация. Пептизация Коллоидные растворы вследствие большой удельной поверхности обладают большой поверхностной энергией и поэтому, согласно второму закону термодинамики, характеризуются относительно малой устойчивостью. Такие системы стремятся самопроизвольно перейти в устойчивое состояние путем уменьшения запаса свободной поверхностной энергии, что достигается слипанием частиц золей с образованием крупных агрегатов. Золи обладают различной устойчивостью. Некоторые из них живут секунды, но есть и такие, которые существуют годы. Так, золи золота, приготовленные Фарадеем более 140 лет назад, сохранили свою устойчивость до настоящего времени. Устойчивость золей обусловлена тем, что при сближении одноименно заряженных частиц золя происходит отталкивание их друг от друга. Таким образом, одним из факторов устойчивости золей является наличие заряда гранул. Другим факторов является образование гидратной оболочки у ионов диффузного слоя. Гидратная оболочка препятствует проникновению ионов диффузного слоя в адсорбционный слой, т.е. мешает нейтрализации заряда гранулы. Если каким-либо способом разрушить эту оболочку (т.е. вызвать дегидратацию ионов, то произойдет полная нейтрализация зарядов потенциалобразующих ионов), т.е. потеря заряда коллоидной частицей. Такое состояние золя называется изоэлектрическим состоянием. В этом состоянии коллоидные частицы легко слипаются в большие агрегаты (коагуляция) и выпадают в осадок (седиментация). Дегидратацию, также как и коагуляцию можно вызвать повышением температуры, добавлением электролитов, механическим воздействием, ультразвуком и др. Наименьшее количество электролита, которое вызывает начало явной коагуляции, определяет порог коагуляции золя. Коагуляцию вызывают ионы, противоположные по знаку потенциалобразующим ионам. По правилу Шульце-Гарди, чем выше заряд коагулирующего иона, тем сильнее выражена его коагулирующая способность. Коагуляцию можно наблюдать и в том случае, если к одному золю добавить другой золь с противоположным зарядом (взаимная коагуляция.). При этом в осадок выпадают оба золя. Устойчивость коллоидного раствора можно увеличить, добавляя к нему небольшое количество раствора высокомолекулярного вещества. Это явление называется коллоидной защитой. Молекулярно-кинетические свойства коллоидных растворов Молекулярно-кинетические свойства золей связаны с движением частиц дисперсной фазы. Особенности молекулярно-кинетических свойств золей зависят в основном от степени дисперсности частиц (от величины их) и проявляются в сотни и тысячи раз слабее, чем у истинных растворов. Броуновское движение выражается в том, что частицы дисперсной фазы под влиянием ударов молекул растворителя находятся в состоянии непрерывного хаотического движения. Впервые его обнаружил английский ботаник Р.Броун, наблюдая за пыльцой растений в воде. Чем меньше размер частиц, тем интенсивнее их броуновское движение. Следовательно, броуновское движение золей замедленно по сравнению с таковым истинных растворов. С повышением температуры интенсивность броуновского движения возрастает. Диффузия – это самопроизвольный процесс выравнивания концентрации дисперсной фазы по всему объему дисперсионной среды за счет броуновского движения. Скорость диффузии прямо пропорциональна степени невыравненности концентрации и зависит также от величины и формы частиц, температуры и обратно пропорциональна размеру частиц и вязкости дисперсионной среды. Таким образом, при одинаковой температуре скорость диффузии в коллоидных растворах будет в сотни и тысячи раз меньше, чем в истинных. Процессы диффузии играют важную роль в организме, прежде всего, участвуя в перемещении питательных веществ, продуктов обмена и т.д. Так, продукты переваривания пищи попадают в капилляры кровеносных сосудов путем диффузии их из латеральных клеток стенки кишечника в указанные капилляры. Скорость многих процессов в организме зависит от скорости диффузии реагирующих веществ, а не от химических реакций, которые при участии ферментов (биологических катализаторов) происходят с огромной скоростью. Осмотическое давление В природе растворы часто разделены мембраной, проницаемой только для молекул растворителя. В таких случаях между ними возникает явление, называемое осмосом. Осмос – это самопроизвольное проникновение молекул растворителя через мембрану из растворителя в раствор или из раствора с низкой концентрацией в раствор с более высокой концентрацией вещества. Для возникновения осмоса необходимо растворы разных концентраций привести в соприкосновение через полупроницаемые мембраны, роль которых для водных растворов могут выполнять как животные и растительные мембраны (оболочка бычьего пузыря, стенки кишечника, оболочки клеток), так и искусственные мембраны (пленки из коллодия, целлофана, железистосинеродистой меди). Простейший способ измерения избыточного гидростатического давления представлен на рис.1.6. 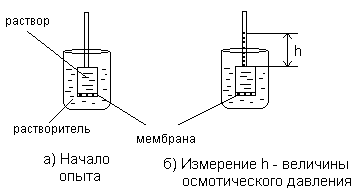 Рис. 1.6. Измерение избыточного гидростатического давления Высота столба жидкости в цилиндрической трубке прибора (площадь сечения берется равной 1 см2), при которой устанавливается динамическое равновесие, определяет осмотическое давление раствора. Осмотическое давление прямо пропорционально числу молекул или коллоидных частиц, содержащихся в единице объема раствора, т.е. оно прямо пропорционально концентрации раствора. Кроме того, осмотическое давление прямо пропорционально температуре. Вант-Гофф объединил две эти закономерности, сведя их в одну формулу (уравнение Вант-Гоффа): π = с. R. T , где π – осмотическое давление; с – концентрация раствора, моль/л; R – коэффициент пропорциональности (универсальная газовая постоянная). Если концентрация раствора равна 1 моль/л, то согласно закону Вант Гоффа осмотическое давление этого раствора при Оо С будет равно: π = 0,082 . 273 = 22,4 атм. Если учесть, что коллоидные частицы во много раз крупнее частиц истинных растворов, то при одной и той же весовой концентрации этих растворов в единице объема золя частиц содержится намного меньше, чем в таком же объеме истинного раствора. Следовательно, осмотическое давление в золях очень мало по сравнению с таковым истинных растворов. Так, осмотическое давление 1%-го раствора глюкозы равно 509 мм ртутного столба, тогда как давление 1%-го золя оксида мышьяка (Аs2О3) – 0,026 мм рт. ст. Пример. Вычислить осмотическое давление 0,5 М раствора сахарозы при 37о С. Осмотическое давление вычисляем по формуле: π = с. R. T π = 0,5 . 0,082 . (273+37) = 0,5 . 0,082 . 310 = 12,7 (атм.) Кроме того, золи характеризуются очень малым понижением температуры замерзания и повышением температур кипения по сравнению с этими свойствами истинных растворов. Биологическое значение явления осмоса Благодаря осмосу происходят оводнение клеток, что придает им форму, обусловливает тургор, способствуя поддержанию эластичности и упругости. Вода необходима клеткам для осуществления множества реакций – гидролиза, гидратации, окисления и др. Для ионов натрия и калия мембраны клеток непроницаемы (существуют «насосы» для переноса их через мембрану). Если осмотическое давление раствора равно таковому стандартного раствора, то раствор этот называется изотоническим; если давление раствора больше давления стандартного раствора, то это гипертонический раствор, и если оно меньше, чем давление стандартного раствора – гипотонический раствор. В качестве стандартного раствора принято считать жидкие системы организма. Кровь, лимфа, тканевые жидкости – это водные растворы многих различных молекул и ионов. Их суммарное осмотическое давление при 37°С равно 7,7 атм., что способствует достаточному оводнению клеток и межклеточных структур и нормальному течению многообразных физических и химических процессов. Такое же давление имеет 0,9% (или 0,15 М) раствор хлорида натрия. Этот раствор называется физиологическим. Сейчас туда добавляют и другие соли, белки и т.д. Если живую клетку поместить в гипотонический раствор, например в воду, то она набухнет от поступающих в нее молекул воды и лопнет. Это явление называют лизисом. В случае эритроцитов, лизис получил название гемолиз, т.к. при этом из клетки выходит гемоглобин, и вода окрашивается в красный цвет, В гипертонических растворах вода, наоборот, уходит из клетки, и она сморщивается. Это явление – плазмолиз. У высокоорганизованных животных и человека осмотическое давление весьма постоянно. Это явление называется изоосмией, оно входит в понятие гомеостаза. Понижение осмотического давления путем введения больших количеств воды или в результате интенсивной потери солей с потом, мочой может вызвать рвоту, судороги и даже гибель. Повышение же осмотического давления введением больших количеств солей приводит к перераспределению солей. Вода скапливается в тех тканях, в которых откладываются избыточные количества солей, вызывая их отеки, в то же время обезвоживание слизистых оболочек вызывает чувство жажды, нарушает нормальную деятельность нервной системы идругих органов. Механизмы, участвующие в сохранении изоосмии: 1) свойства некоторых тканей (печень, подкожная клетчатка) задерживать в себе избыточные количества солей; 2) способность организма быстро выводить соли с мочой и потом; особую роль в этом играют почки. Эти процессы регулируются нервной системой и железами внутренней секреции. В ограниченных участках тканей изменения осмотического давления могут быть большими. Так, при локальном воспалении происходит распад белка на мелкие фрагменты и, следовательно, увеличение концентрации веществ в этой зоне. Вода устремляется в этот очаг, повышая осмотическое давление, которое вызывает ощущение боли. Разрез воспаленного участка снимает боль, так как жидкость при этом вытекает. В хирургии применяют гипертонические повязки – марлевые полоски, смоченные в гипертонических растворах NaCl и введенные в гнойные раны. Ток жидкости в ране направляется по марле наружу, выводя с собой гной, микроорганизмы и т.д. Применение при консервировании больших количеств сахара или соли приводит к плазмолизу микроорганизмов. Создание изотонической среды необходимо при экспериментальных исследованиях нa выделенных из организма органах и тканях. Оптические свойства коллоидных систем Наиболее характерным оптическим свойством коллоидных растворов является опалесценция. Выражается она в некоторой мутноватости и в изменении окраски золя в проходящем и отраженном свете. В основе этих процессов лежит рассеяние света коллоидными частицами. В истинных растворах молекулы и ионы не препятствуют прохождению лучей света (растворы оптически пусты). В коллоидных растворах размер частиц соизмерим с длиной волн видимого света. Поэтому лучи, проходя через золи, не могут обойти такие частицы. Они беспорядочно отражаются и преломляются на границе раздела частиц со средой, обусловливая мутность коллоидных растворов и грубо дисперсных систем. При этом отраженный свет – голубоватый. Объясняется это тем, что лучи с меньшей длиной волн (голубые и синие) рассеиваются больше, чем длинноволновые красные лучи. Так, голубоватый оттенок имеет разбавленное молоко, морская волна, табачный дым. 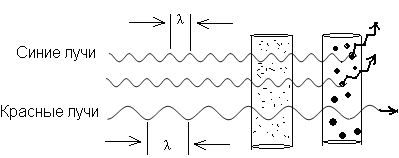 Рис. 1.7. Рассеивание синих лучей Если луч света пропустить через коллоидный раствор в темноте, то возникнет светящейся след светового потока в виде конуса. Такой же след возникает при прохождении луча прожектора в ночном небе, при свете фap в туманную погоду и т.д.Впервые явление рассеяния света коллоидными растворами наблюдал М.Фарадей. Позднее Д.Тиндаль исследовал это явление более подробно. Поэтому этот эффект носит название эффект Фарадея-Тиндаля (рис. 10). 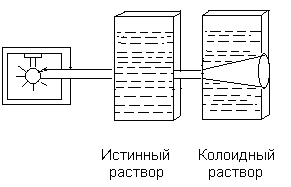 Рис. 1.8. Эффект Фарадея-Тиндаля Сосуд, ближайший к свету, содержит концентрированный раствор сахара. Второй сосуд содержит коллоидный раствор. Световой поток в виде конуса виден во втором сосуде, через первый сосуд свет проходит нерассеянным. В истинных растворах это явление не наблюдается. Этим эффектом пользуются для того, чтобы решить вопрос с том, относится ли система к коллоидным растворам. Растворы высокомолекулярных соединений Вещества, молекулярная масса которых выше 10 тыс. дальтон, называются высокомолекулярными (ВМС) или полимерами. К числу важнейших природных ВМС относятся белки и полисахариды растительного и животного происхождения (желатин, альбумин, крахмал, агар-агар), натуральный каучук и др. Растворению полимеров предшествует их набухание – проникновение молекул растворителя в среду полимера и связанное с этим увеличение его массы и объема. По мере дальнейшего набухания расстояния между макромолекулами увеличиваются настолько, что они начинают отрываться друг от друга и переходить в растворитель и вконце концов все молекулы полимера в силу диффузии равномерно распределяются по всему объему растворителя, образуя истинный раствор. Различают неограниченное и ограниченное набухание, В первом случае оно заканчивается растворением полимера. Во втором случае набухание не доходит до растворения и образуется студень (набухание желатина в воде при комнатной температуре). Причина ограниченного набухания – в наличии химических связей между макромолекулами, которые не дают им возможности переходить в растворитель. Свободная и связанная вода в коллоидных pacтвopax Молекулы воды электронейтральны. Однако, помещенные во внешнее электрическое поле, они проявляют дипольный характер, ориентируясь при этом соответственно электрическим силовым линиям. Аналогично этому гидратация гидрофильных коллоидов обусловливается электрическими зарядами высокомолекулярных веществ. Таким образом на поверхности этих молекул образуются оболочки из диполей молекул воды, ориентированных в зависимости от знака заряда ВМС. Те слои диполей воды, которые расположены в непосредственной близости к поверхности макромолекулы, наиболее прочно связаны с ней и наиболее упорядоченно ориентированы. Этот слой образует так называемую связанную воду (или структурированную). Остальная часть воды свободная. Исследования показали, что свойства связанной воды резко отличаются от свойств свободной воды. По степени упорядоченности структуры связанная вода приближается к свойствам твердого тела и имеет бóльшую плотность, чем вода свободная. Гидратная оболочка не обладает растворяющими свойствами, поэтому ВМС растворяются в свободной воде. Свойства растворов ВМС Различают две группы коллоидных систем - лиофобные, частицы которых не имеют сольватной оболочки, и лиофильные, частицы которых сильно сольватизированы. К лиофильным коллоидам до недавнего времени относили и растворы ВМС. Однако исследования показали, что растворы ВМС – это растворы истинные, хотя и обладающие многими свойствами коллоидных растворов. Раствори ВМС обладают малой диффузионной способностью, не проникают через полунепроницаемые мембраны, pacсеивают лучи света. Однако растворение биополимеров ведет к образованию истинных растворов, так как между дисперсной фазой (молекулы ВМС) и дисперсионной средой нет поверхности раздела, т.е. системы эти гомогенные и, следовательно, обладают агрегативной устойчивостью. Молекулы белков, как известно, имеют либо спиралевидную (фибриллярные белки), либо глобулярную структуру (глобулярные белки). И та и другая структура несет на своей поверхности заряженные группы (-NH3+ и -СОO–). Общий заряд ВМС зависит от соотношения этих групп в молекуле (табл. ). Состояние, при котором число групп -NH3+ равно числу групп СОО¯ в молекуле белков, называется изоэлектрическим состоянием. Заряд молекулы при этом равен нулю. рН, при котором белок находится в изоэлектрическом состоянии (ИЭС), называется изоэлектрической точкой (ИЭТ). Изменение ИЭС белка в зависимости от рН
Перезарядка групп -NH2 и -COOH при изменении рН среды существенно изменяет вид спирали и глобулы, т.е. меняют конфигурацию белковой молекулы, а это существенно сказывается на функциональной способности молекулы. Введение в раствор сильных электролитов (например, солей) приводит к конкуренции их за молекулы воды у ВМС, а это снижает растворимость их и облегчает процесс нейтрализации заряда полимера. В итоге ВМС выпадает в осадок. Осаждение полимеров солями называетея высаливанием. По степени высаливающей способности вводных растворах ионы располагают в так называемые лиотропные ряды: С4Н4О62– >SO42–>CH3COO–>CI–>NO3–CNS– и Li+>Na+>K+>Rb+>Cs+>Mg2+>Ca2+>Sn2+>Ba2+ Расположение ионов в лиотропных рядах связано не столько с зарядом иона, сколько со степенью его гидратации. После отмывки полимера от электролита (например, диализом), он снова может быть переведен в растворимое состояние, т.е. процесс высаливания обратим. Денатурация Потеря ВМС своих первоначальных свойств (нативных свойств) за счет изменения пространственной структуры полимера называется денатурацией. Это можно наблюдать при нагревании (но не выше 70°) и охлаждении, высаливании, при действии кислот (органических), алкалоидов и т.д. Денатурация может быть обратимой (условия указаны в скобках) и необратимой (при нагревании выше 70о С, при действии сильных минеральных кислот, солей тяжелых металлов, алкалоидов). Этот факт следует, прежде, всего учитывать при работе с растворамибелков. Студни Растворы высокомолекулярных соединений (и некоторые коллоидные системы) способны при определенных условиях терять текучесть и застудневать, образуя при этом студни. В студнях частицы дисперсной фазы связаны между собой в сетчатый каркас, а дисперсионная среда заключена в промежутки между ними. Таким образом, студни – это структурированные системы со свойствами эластичных твердых тел. Студнями являются хлеб, джем, желе, мармелад, кисель, сыр, простокваша и т.д. Студни делят на две группы: а) эластичные ( или обратимые), получаемые из ВМС; б) хрупкие (необратимые), получаемое из неорганиче- ских гидрофобных золей. Для студней характерен ряд свойств твердых тел: они сохраняют форму, обладают упругими свойствами иэластичностью. Однако их механические свойства определяются концентрацией и температурой. При нагревании студни переходят в вязкотекучее состояние. Этот процесс называется плавлением. Он обратим, т.е. при охлаждении раствор снова застудневает. Студни, полученные из растворов ВМС, при высушивании могут уменьшаться в объеме. Свежеприготовленные студни с течением времени подвергаются изменениям, т.к. процесс структурирования в студне продолжается. При этом на поверхности студня появляются капельки жидкости, которые, сливаясь, образуют жидкую среду. Такой самопроизвольный процесс разделения студня на две фазы, сопровождающийся изменением объема студня, называется синерезисом. Чаще всего процесс этот нежелателен, но при производстве творога, созревания сыра он играет положительную роль. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
