биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
 Скачать 14.38 Mb. Скачать 14.38 Mb.
|
|
А. В глобулярных белках полипептидная цепь свернута так, что образуется компактная структура. Эти белки обычно растворимы в водной среде. Б. В кератине, фибриллярном белке шерсти, полипептидные цепи вытянуты вдоль одной оси. На рисунке показаны три молекулы кератина, навитые одна на другую наподобие каната. Фибриллярные белки нерастворимы в воде. Большинство белков растворяется в воде. Они образуют лиофильные коллоидные растворы. Молекулы белков имеют большие размеры и не проходят через поры полупроницаемых мембран. Молекулярно-кинетические свойства коллоидных растворов белков связаны с размерами и перемещением мицелл в среде, рН раствора и т.д. Белки имеют низкий коэффициент диффузии, низкое осмотическое давление, высокую относительную вязкость и большую степень набухания – белки связывают до 80-90% всей воды организма. Вода обеспечивает формирование структуры белков. Общее количество связанной воды составляет в миоглобине, лизоциме, цитохроме около 22% от общей массы белка. Под влиянием различных факторов белки могут выпадать из коллоидных растворов в осадок (коагулировать); это легче происходит в изоэлектрической точке белка. Коагуляция бывает обратимая, когда нарушается в коллоидной частице только сольватная оболочка и необратимая, когда произошли глубокие нарушения структуры белковой молекулы. Необратимую коагуляцию называют денатурацией. Она вызывается кипячением, действием солей тяжелых металлов, алкалоидов, минеральных кислот и т.д. Кислотно-щелочные свойства белков связаны с катионообразующими (-NH3+) и анионобразующими (-COO-) группами. Суммарный заряд молекулы можно представить как:  Знак заряда зависит от соотношения аминных и карбоксильных групп, соответственно различают белки кислые, нейтральные и щелочные (основные). Аминокислоты Для изучения аминокислотного состава белков пользуются кислотным (HCl), щелочным (NaOH) и ферментативным гидролизом. При гидролизе чистого белка высвобождается до 20 различных α-аминокислот. Все другие аминокислоты, открытые в тканях животных, растений и микроорганизмов, их свыше 200, существуют в свободном состоянии или же в составе коротких пептидов или комплексов с другими органическими веществами. Способы получения аминокислот: 1.Гидролиз из соответствующих белков. 2.Методом химического синтеза, в том числе с использованием иммобилизованных ферментов. 3.Методом микробиологического синтеза. Таким способом производят аминокислоты для нужд животноводства, – это многотоннажный промышленный способ. α-аминокислоты представляют собой производные карбоновых кислот, у которых один атом водорода, у α-углерода замещен на аминогруппу (-NH2): жирная кислота α-аминокислота Все аминокислоты, входящие в состав природных белков, являются α-аминокислотами. Общим свойством аминокислот является их амфотерность, т.е. каждая из них содержит, как минимум, одну кислую и одну основную группу (исключение составляет пролин и его производное гидроксипролин, являющиеся иминокислотами). Общий тип строения α-аминокислот может быть представлен в виде следующей формулы:  Аминокислоты отличаются друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковой молекулы связано с химической природой и физико-химическими свойствами радикалов аминокислот. Все аминокислоты – бесцветные кристаллические вещества, на вкус сладковатые или кисло-сладкие. Большинство аминокислот хорошо растворимо в воде. В тканях организма, в клетках, в крови среда слабощелочная – рН 7,3, поэтому карбоксильные группы находятся в форме R-COO- , а аминные – в форме R-NH3+ (в протонированной форме), поэтому правильная ионная форма аминокислоты: 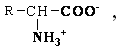 то есть амфиона (цвитериона) (в пределах рН 4-9). Аминокислоты в виде недиссоциированных молекул:  т.е. в неионизированной форме приводятся для удобства восприятия. В кислой среде аминогруппа присоединяет протон, получает положительный заряд и под действием электрического тока движется к катоду: 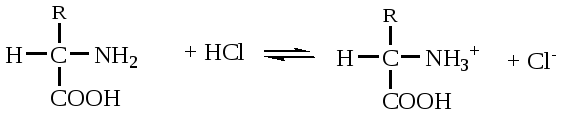 В щелочной среде аминокислота ведет себя как кислота и диссоциирует по такой схеме: 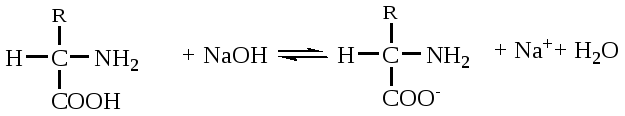 В этом случае при пропускании тока через раствор ионизированная молекула аминокислоты движется к аноду. Для каждой аминокислоты существует своя изоэлектрическая точка (ИЭТ), т.е. такое состояние, при котором сумма положительных зарядов равна сумме отрицательных зарядов и под действием электрического тока аминокислота не движется ни к аноду, ни к катоду. Для моноаминомонокарбоновых кислот ИЭТ будет близка к реакции нейтральной среды, моноаминодикарбоновых - к кислой и диаминомонокарбоновых – к щелочной. Для определения количественного содержания аминокислот важное значение имеют следующие методы: 1. Формольное титрование – оно основано на способности формальдегида реагировать с аминогруппой в результате чего аминокислота превращается в основание Шиффа. В этой реакции аминогруппа аминокислоты блокируется остатком формальдегида, а карбоксильная группа не затрагивается и может быть оттитрована щелочью: 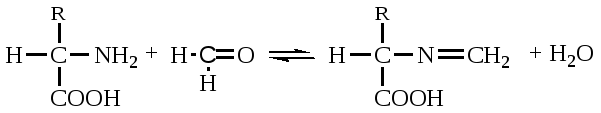 2. Реакция с азотистой кислотой – при действии азотистой кислоты аминогруппа разрушается, при этом выделяющийся азот собирают и по его количеству рассчитывают содержание аминокислоты (метод Ван-Слайка) - газометрический метод:  диазосоединение оксикислота 3. Нингидриновый метод определения широко применяется: а) при хроматографическом разделении аминокислот на бумаге; б) в автоматических анализаторах аминокислот; в) для определения аминного азота. 4. Существуют реакции для обнаружения и полуколичественного определения аминокислот: • реакция Миллона (тирозин); • ксантопротеиновая реакция (фенилаланин, тирозин) • реакция Сакагучи (аргинин). Аминокислоты природных белков (кроме глицина) обладают оптической активностью, т.е. способностью вращать плоскость поляризованного света. Различают D- и L-формы аминокислот, например:  D (-) - Аланин L (+) - Аланин Все природные белковые аминокислоты относятся к L-ряду. Лишь в белках некоторых микроорганизмов встречаются некоторые D-аминокислоты (также в грибах, антибиотиках). Аминокислоты D-ряда или совершенно не усваиваются организмом или же усваиваются плохо, т.к. ферментные системы животного организма специфически приспособлены к обмену L-аминокислот. Это важно при учете балансирования рациона животных по незаменимым аминокислотам синтетическими аналогами, которые, как правило, содержат в равных количествах L- и D- формы (рацематы). Аминокислоты обозначают трехбуквенными символами, например: Алании Ала, Гистидин Гис, Аргинин Apr, и т.д. Кроме того, принято однобуквенное обозначение аминокислот; например, глицин - G, аланин - А, валин - V, лейцин - L и т.д. Важным свойством аминокислот является их способность синтезироваться в тканях организма животных. Различают аминокислоты заменимые, которые могут синтезироваться в тканях животного организма и незаменимые, которые не могут синтезироваться в организме, а должны поступать с кормом. Ациклические аминокислоты Моноаминомонокарбоновые кислоты Глицин (гликокол или аминоуксусная кислота): Это единственная α-аминокислота, не содержащая асимметрического атома углерода и не имеющая в связи с этим оптического изомера. Глицин входит в состав всех растительных и животных белков. Он синтезируется в организме животных из других аминокислот, не является незаменимой аминокислотой. L(+)-аланин (α-аминопропионовая кислота) – является производной пропионовой кислоты; заменимая аминокислота: Впервые выделена из фиброина шелка при его кислотном гидролизе. Аланин и его производные жирного и циклического ряда составляют 55-60 % всех аминокислот, входящих в состав белков: L-серин (α-амино- β-оксипропионовая кислота): Эта аминокислота имеет 3 функциональные группы α-аминогруппу, карбоксильную и гидроксильную. В связи с этим может вступать в химические реакции чаще, чем аланин и глицин; заменимая аминокислота. L-Цистеин (α-амино- β-тиопропионовая кислота): Входит в состав многих белков, особенно в состав кожи (эпидермиса), шерсти, рогов, копыт. Значительно в составе ферментов. Наличие -SH сульфгидрильной (тиоловой) группы в составе ферментов дало им название тиоловых; заменимая аминокислота. L-цистин (α,α'-диамино- β,β'-дитиопропионовая кислота): 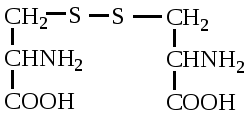 Образуется в результате окисления цистеина, две молекулы которой соединяются через атомы серы. Цистин можно рассматривать как дицистеин. Плохо растворяется в воде, несколько лучше в слабых кислотах и щелочах. L-Метионин (α-амино-γ-метилтиомасляная кислота):  Открыт в 1922 г. в составе белка казеина. Незаменимая аминокислота, в тканях организма животных не синтезируется, является донором метальных групп и серы для образования некоторых биологически активных веществ, в т.ч. серосодержащих аминокислот (цистеин, цистин, гомоцистеин), холина, креатина и др. L-Треонин (α-амино-β-гидрооксимасляная кислота): Незаменимая аминокислота. L-валин (α-амино- β-метилмасляная кислота):  Валин широко распространен в белках тканей, незаменимая аминокислота. L-лейцин (α-аминоизокапроновая кислота): 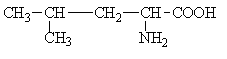 В клетках организма не синтезируется, незаменимая аминокислота. L-Изолейцин (α-амино - β-метил-валериановая кислота): 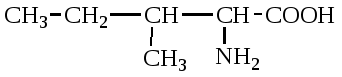 Незаменимая аминокислота, входит в состав многих белков. Моноаминодикарбоновые кислоты. Аспарагиновая кислота (α-аминоянтарная кислота): Входит в состав белков тканей, много в составе кислых белков, заменимая аминокислота. Глутаминовая кислота (α-аминоглутаровая кислота): Входит в состав белков, особенно много в составе кислых белков. Заменимая аминокислота. Диаминомонокарбоновые кислоты. Это производные валериановой и капроновой кислот (5 и 6 атомов углерода). L-Аргинин (α-амино-δ-гуанидилвалериановая кислота): 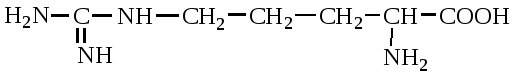 Является частично заменимой аминокислотой. Содержит 2 аминогруппы – относится к основным аминокислотам. Входит в состав гистонов, протаминов. Является важным промежуточным продуктом при синтезе мочевины: 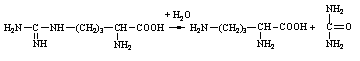 аргинин орнитин мочевина Орнитин не является составной частью белков, является диаминовалериановой кислотой, образуется в процессе обмена при гидролизе аргинина. L-Цитруллин образуется при синтезе мочевины. В состав белков не входит.  L-Лизин (α,ε-диаминокапроновая кислота): 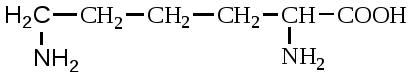 Много лизина в ядерных белках протаминах и гистонах. Незаменимая аминокислота. Ароматические аминокислоты L-Фенилаланин (α-амино-β-фенилпропионовая кислота): 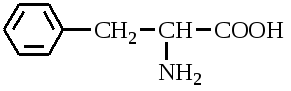 Незаменимая аминокислота. L-Тирозин (α-амино-β-параоксифенилпропионовая кислота): 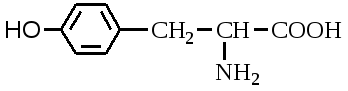 Распространенная аминокислота. Является основным субстратом при синтезе гормонов щитовидной железы и мозгового слоя надпочечников. Заменимая аминокислота. Гетероциклические аминокислоты Триптофан (α-амино-β-индолилпропионовая кислота):  Содержит гетероциклическое пиррольное кольцо, из него образуется биологически активный амин – триптамин, который повышает кровяное давление; незаменимая аминокислота. L-Гистидин (α-амино-β-имидозолилпропионовая кислота):  Незаменимая аминокислота. Содержит имидазольный цикл с двумя атомами азота. Гистидин, как и триптофан, входит в состав многих белков организма. При декарбоксилировании образуется биологический активный амин – гистамин. L-Пролин(пирролидин – Оксипролин (4-гидроксипирро- α-карбоновая кислота): лидин-2-карбоновая кислота). 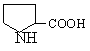 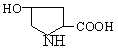 Пролин и оксипролин могут превращаться в другие аминокислоты, принимают участие в обмене веществ, они иминокислоты, т.к. содержат =NH группу; относятся к заменимым аминокислотам. Структура белковой молекулы Способы связи аминокислот в белковой молекуле Основной структурной единицей белка являются α-аминокислоты. Впервые, еще в 1888 г. А.Я.Данилевский установил, что аминокислоты в белковой молекуле соединяются -COOH и -NH2 группами, образуя связи, в последующем названные пептидными связями. Пептидная связь образуется при взаимодействии карбоксильной группы первой аминокислоты с аминогруппой при α-углероде второй аминокислоты. При этом отщепляется молекула воды: например, из двух молекул аланина образуется дипептид аланил-аланин: Соединение из двух аминокислот называют дипептидом, из трех – трипептидом и т.д. Связь –CO-NH- называется пептидной связью. Если число аминокислотных остатков больше 10, то называют полипептидом, свыше 50 – белками. Различают N-конец, где имеется свободная -NH2 группа и С-конец пептида, где свободная -COOH группа аминокислоты. Кроме -COOH и -NH2 групп, участвующих в образовании пептидной связи, аминокислоты содержат другие функциональные группы, размещенные в боковых ответвлениях белковой молекулы:
Группу атомов в молекулах аминокислот, не принимающих участие в образовании пептидной связи, называют радикалами аминокислот. Различают аминокислоты с ионами-радикалами. К этой группе относятся 7 аминокислот с радикалами, обладающими отрицательными или положительными зарядами, в т.ч. аспарагиновая и глутаминовая кислоты с "-" зарядом, тирозин и цистеин также могут нести "-" заряд; лизин, аргинин и гистидин несут "+" заряд. Полярные радикалы имеют серии и треонин (-ОН). Сюда же относятся аспарагин, глутамин. Третья группа аминокислот имеет неполярные алифатические или ароматические радикалы (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, оксипролин). Таким образом, в построении структуры белковой молекулы кроме образования пептидной связи имеют значение свойства радикалов аминокислот. Пептиды - имеют Мм до 5000 дальтон (50 аминокислотных остатка), проходят через полупроницаемую мембрану. В природе известно свыше 200 пептидов, в том числе в организме животных и человека различают: 1.Пептиды-гормоны: вазопрессин, окситоцин, кортикотропин, глюкагон, кальцитонин, меланостимулирующий гормон. 2.Пептиды, принимающие участие в пищеварении, – гастрин, секретин – всего 12 пептидов. З.Ангиотензин (сосудосуживающий), брадикинин. 4.Нейропептиды. 5.Пролинсодержащие ди- и трипептиды, образующиеся из коллагена и эластина путем гидролиза, обладающие антикоагулянтным действием, защищающие слизистую оболочку желудка. б.Низкомолекулярные (Мм 4 кДа) пептиды, обуславливающие устойчивость животных к разным инфекциям, обладающие широким спектром антимикробной активности. Существуют пептиды, полученные путем синтеза. Например, синтетическая пептидная вакцина против ящура получена из 16-ти аминокислотных остатков. Небелковая часть фермента окислительно-восстановительных реакций является трипептидом: это глутатион (γ-глутамил-цистеинил-глицин): Карнозин: β-аланил-гистидин и ансерин – метил-карнозин являются дипептидами: они усиливают мышечные сокращения, обладают антиоксидантными и мембраностабилизирующими свойствами. Пептиды из глицина и пролина влияют на свертывание крови, защищают слизистую оболочку желудка, влияют на головной мозг. Пептиды эндотелины регулируют тонус сосудов. Дипептид аспартам (аспарагин + фенилаланин) получают методом генной инженерии. Он в 300 раз слаще сахара, его добавляют в напитки вместо сахара (кока-кола). Различают 4 уровня структуры белковой молекулы. Первичная структура белка – это последовательность (чередование) аминокислотных остатков в пептидной цепи. В образовании этой структуры участвуют пептидные связи, частично дисульфидные. Первичная структура закодирована в генах, она определяет остальные уровни организации белка. Впервые первичная структура белка инсулина была определена Сэнджером (1953 г.). Сейчас изучена первичная структура большого числа белков. Например, молекула инсулина состоит из двух частей: А-21, В-30 аминокислотных остатков. Строение его можно представить в следующем виде: 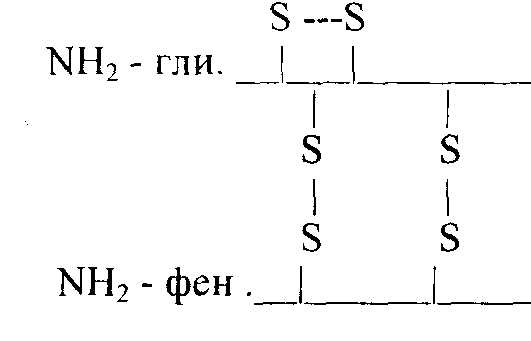 асп. COOH А цепь (21 аминокислотный остаток) асп. COOH А цепь (21 аминокислотный остаток)..... COOH В цепь (30 аминокислотных остатков) Между цепями А и В и внутри А-цепи возникают дисульфидные связи. Первичная структура РНКазы из 124 аминокислотных остатков показана на рис. 2.2. Исследование первичной структуры гемоглобина позволило установить, что серповидная анемия (рис.2.3.) – болезнь крови – обусловлена заменой лишь одной единственной аминокислоты в В цепи из 146 аминокислотных остатков. Если в 6-положениии от N-конца находится валин вместо глутаминовой кислоты, то такой гемоглобин не выполняет функцию транспорта кислорода: 4 5 6 7 - положение аминокислот - тре - про - глу - лиз - норма - тре - про - вал - лиз - патология Вторичная структура белка – это способ укладки полипептидной цепи в спиральную конфигурацию. Эта укладка происходит по программе, заложенной в первичной структуре. 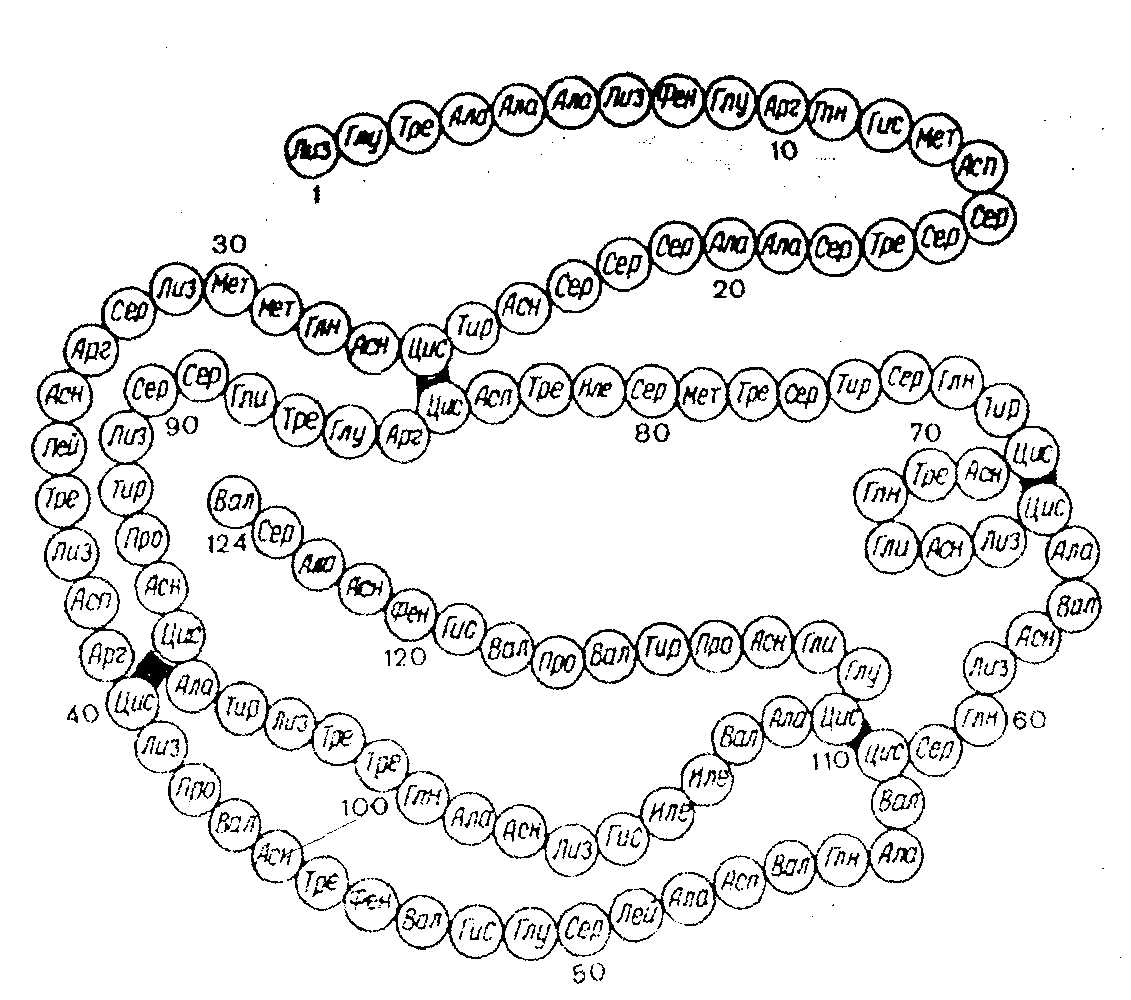 Рис 2.2. Первичная структура РНКазы. Цветом выделены четыре дисульфидные связи. 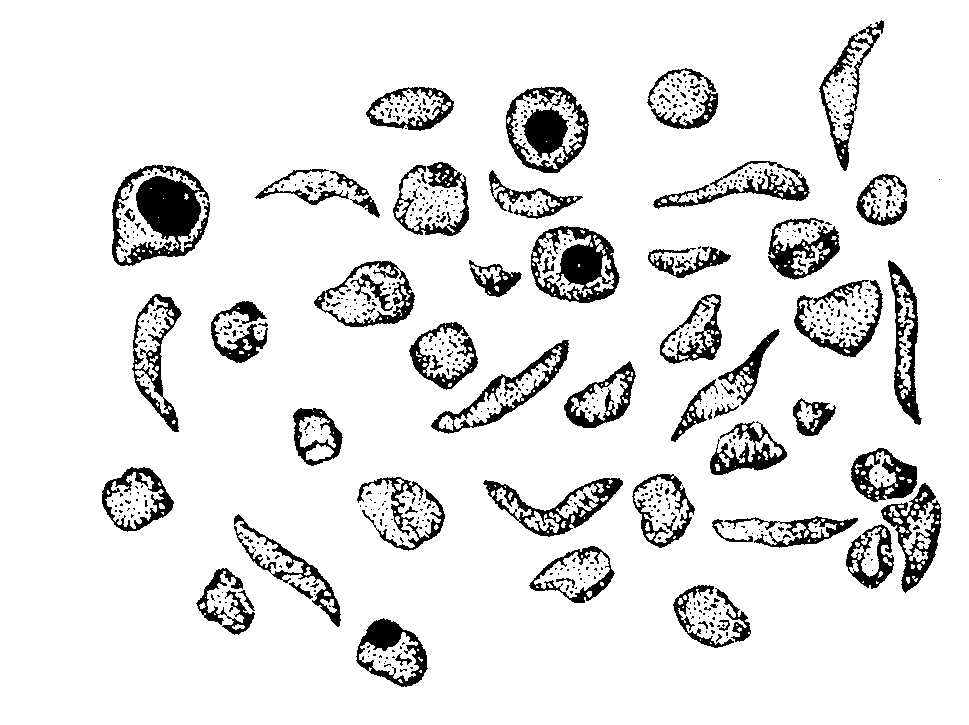 Рис 2.3.Нормальные и серповидные эритроциты Полинг и Кори установили, что глобулярные белки образуют α-спираль за счет водородных связей между радикалами аминокислот. Водородная связь возникает за счет карбонильной группы одного радикала и аминной группы другого радикала, между атомами кислорода и водорода, азота и водорода: Карбонильная группа и NH-группа способны образовывать водородную связь между собой. Атомы кислорода и водорода пептидной группы занимают транс-положение, а вокруг - CH возможно свободное вращение:  В результате этого образование водородных связей обуславливает определенную форму пептида. Различают три типа вторичной структуры пептидных цепей: α-спираль, β-структура (складчатый слой), беспорядочный клубок. α-спираль – это виток по часовой стрелке (рис.2.4). Каждый виток содержит 3,6 аминокислот 5,4 А (1,5 А на 1 аминокислоту), через каждые 5 витков (18 аминокислотных остатков) структурная конфигурация повторяется, α-спиральную структуру имеют фибриллярные белки – кератины волос, шерсти, кожи, где -S-S- связи придают высокую прочность. В складчатом слое (β-структура) пептидные цепи расположены параллельно друг другу в один слой, образуя фигуру гармошки или листа. Слой может быть образован двумя или большим числом пептидов. Домены представляют собой надвторичную структуру (рис.2.5). Водородная связь может образоваться не только между карбонильной группой (отрицательный заряд кислорода) и атомом водорода иминогруппы =NH другой полипептидной цепи, но и между двумя гидроксильными группами и гидроксильной группой серина и тирозина. Вторичная структура коллагена. Количество коллагена в организме составляет 1/3 (сухожилия, связки, суставные капсулы и т.д.) от общего количества белков. 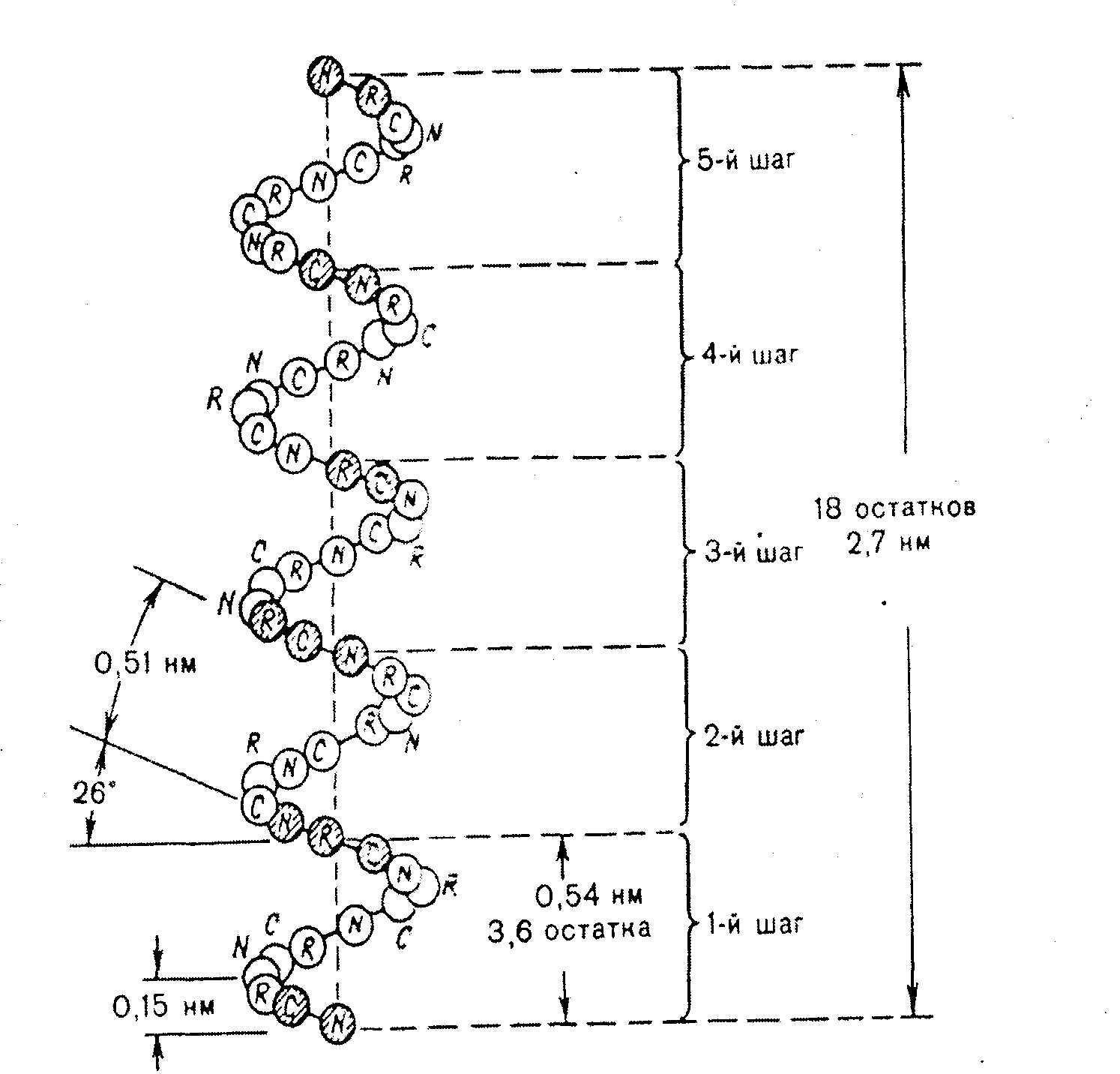 Рис. 2.4. Структура и параметры α-спирали. В отличие от α- спирали кератинов коллаген плохо поддается растяжению. В составе коллагена много глицина - 1/3 из общего количества аминокислотных остатков, 1/4 и более составляют пролин и оксипролин. Эти аминокислоты нарушают способность полипептидных цепей образовывать α-спираль. В коллагене каждые 3 полипептидные цепи скручены и образуют тройную спираль. Третичная структура белка. Это пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, третичная структура которого была выяснена англичанином Дж. Кендрью. Это миоглобин кашалота, молекулярная масса 16700 Да, содержит 153 аминокислотных остатка. Имеет одну полипептидную цепь. Полипептидная цепь представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелкового компонента, содержащего железо). В настоящее время благодаря повышению эффективности рентгеноструктурного анализа расшифрована третичная структура многих белков.  Складчатый слой Домены Рис. 2.5. Схема складчатого слоя и доменов. Некоторые типы связей, стабилизирующих третичную структуру представлены на рис.2.6. пептид  Рис.2.6. Связи, стабилизирующие вторичную и третичную структуру. Третичная структура обеспечивается за счет пептидных и дисульфидных связей, но основную роль играют нековалентные связи – водородные, межмолекулярные силы Ван-дер-Ваальса-Лондона, гидрофобные взаимодействия и т.д. Третичная структура белка возникает после завершения синтеза его на рибосомах, автоматически. Она определена первичной структурой – последовательностью аминокислотных остатков в полипептидной цепи. Третичная структура связана с биологической активностью белковой молекулы (каталитической, гормональной, антигенной и т.д.). Любые физико-химические воздействия, приводящие к разрыву водородных связей, а также других некоторых связей, и тем самым разрушающие нативную конформацию молекулы, сопровождаются частичной или полной потерей белком его биологических свойств (рис. 2.7.). Четвертичная структура белка. Это укладка в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной и третичной структурой, и формирование единого макромолекулярного образования. Каждая отдельная полипептидная цепь (протомер) чаще всего не обладает биологической активностью. Эту способность биологическая молекула приобретает при определенном способе пространственного объединения входящих в его состав протомеров, при этом образуется мультимер.  Рис.2.7. Денатурация и ренатурация рибонуклеазы (по Анфинсену). а - развертывание (мочевина + меркаптоэтанол); б - повторное свертывание Например, молекула гемоглобина состоит из α- и β- субчастиц, каждая из которых состоит из двух полипептидных цепей. Каждая из 4-х полипептидов окружает группу гема, содержащего атом двухвалентного железа. При определенных условиях в присутствии солей, мочевины, изменении рН, молекул; гемоглобина обратимо диссоциирует на 2 α- и 2 β-цепи, что связано с разрывом водородных связей. После удаления солей, мочевины при изменения рН происходит автоматическое восстановление исходной молекулы (рис.2.8).  Рис.2.8. Обратимая диссоциация молекулы гемоглобина. Белок вируса табачной мозаики имеет гигантскую молекулу с молекулярной массой около 40 х10б Да, вирус состоит из 1 молекулы РНК и 2130 белковых субъединиц с молекулярной массой каждой 17500 Да. Вокруг РНК расположены белковые субъединицы, образующие спиральную структуру, которая имеет 130 витков. После добавления детергентов РНК может быть удалена; что самое удивительное - вирусная частица вновь может быть собрана автоматически после удаления детергентов. При этом восстанавливаются и биологические свойства вируса инфекционность, антигенная активность и т.д. (рис. 2.9.). 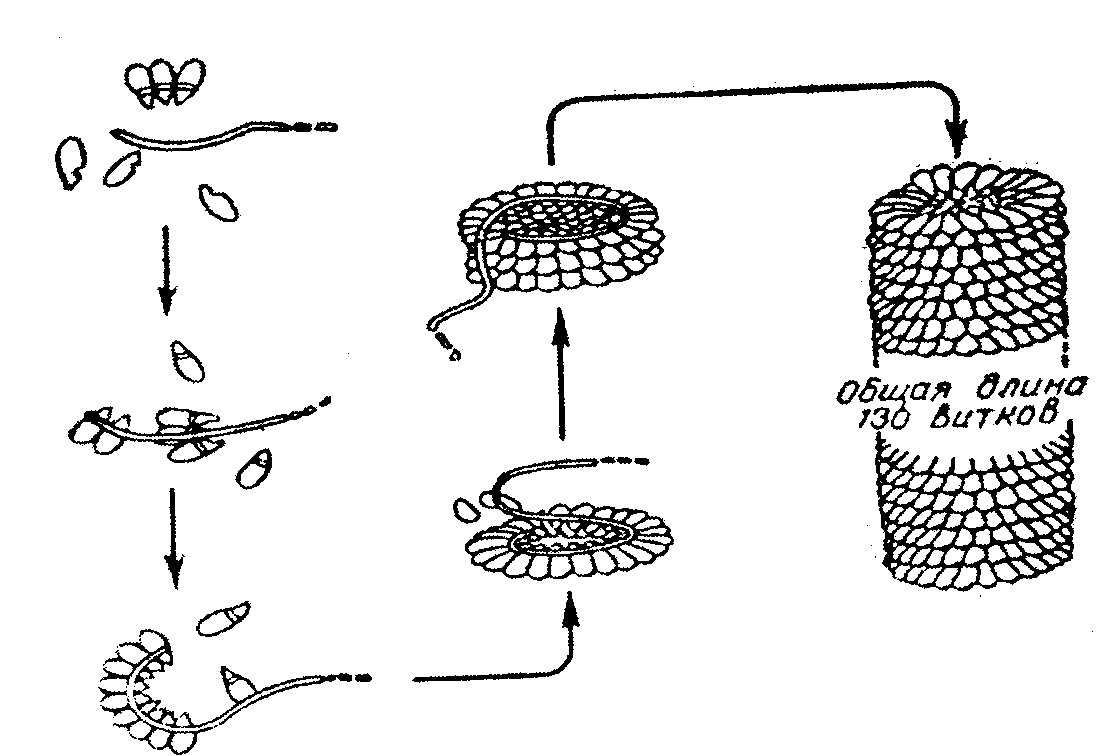 Рис. 2.9. Самосборка вируса табачной мозаики. Микротрубочки имеются во всех клетках. Постоянно то распадаются, то вновь образуются, принимают участие во внутриклеточном транспорте веществ, в движении хромосом при делении клеток. Они построены из тубулина, который состоит из двух пептидов с Мм 111500 Да. Их можно выделить из клеток; под действием Mg 2+ образуются микротрубочки. Рибосомы, клеточные мембраны также образованы из нескольких полипептидов (протомеров), которые взаимно укладываются и создают четвертичную структуру. В середине 80-х годов было обнаружено, что в клетке существует особая категория белков, основной функцией которых является обеспечение правильного характера сворачивания полипептидных цепей в нативную структуру. Эти белки получили название "молекулярные шапероны". Они состоят из полипептидов, организованных в два семичленные кольца, лежащих одно под другим. В центре построенного таким образом цилиндра имеется полость – канал (диаметром 45 ангстрем), в котором происходит сворачивание полипептидной цепи. Кроме того, в укладке белковой молекулы участвуют ферменты фольдазы, катализирующие образование дисульфидных связей и изомерные превращения некоторых стабильных транс-пептидил-пролильных связей в цис-конфигурацию, необходимую для функциональной активности. Классификация белков В зависимости от химического состава различают простые белки – протеины, сложные белки – протеиды. Простые белки (протеины) построены из α-аминокислот и при гидролизе распадаются только на α-аминокислоты. Сложные белки (протеиды) состоят из белка (простого) и небелкового компонента, который называется простетической группой. При гидролизе сложных белков, кроме аминокислот, обнаруживают небелковую часть или продукты ее распада – углеводы, фосфорная кислота, липиды, гетероциклические соединения, металлы и т.д. К простым белкам относятся: протамины, гистоны, альбумины, глобулины, проламины, глютелины, протеноиды. Гистоны – белки с выраженными свойствами основного характера, содержат от 10 до 30% диаминомонокарбоновых кислот – лизина, аргинина, гистидина. Гистоны растворимы в воде, в разбавленных кислотах, но не растворимы в разбавленных щелочах. Молекулярная масса 5000-37000 Да. Входят в состав ядерных белков – ДНК-протеидов, играют важную роль в регуляции метаболической активности генома. Протамины – белки основного характера. Молекулярная масса около 5000 Да, т.е. относятся к пептидам. Содержание аргинина составляет 60-65%. Входит в состав ДНП-нуклеопротеидов. Проламины – белки, нерастворимые в воде, не свертываются при кипячении. Входят в состав белков злаков: глиадин – содержится в зерне пшеницы, ржи, гордеин – содержится в семенах ячменя, зеин - содержится в семенах кукурузы, содержат до 30% глутаминовой кислоты, 10-15% пролина. Глютелины – растительные белки, нерастворимые в воде, содержатся в семенах злаков (фр.gluten -клейковина). Определяют хлебопекарные качества муки (зерна). Протеиноиды (коллагены, кератины) – опорные белки, α-кератины основной тип фибриллярных белков, из которых образуются наружные защитные покровы позвоночных. На их долю приходится почти весь сухой вес волос, шерсти, рогов, перьев, ногтей, чешуи, копыт, значительная часть сухого веса наружного слоя кожи.  α-Кератины богаты остатками цистина, способного образовывать поперечные связи между соседними полипептидными цепями. Коллаген и эластин – главные фибриллярные белки соединительной ткани сухожилий, связок. На долю коллагена приходится почти 1/3 всей массы белков позвоночных. В количественном отношении коллаген содержится в организме животных в наибольшем количестве; фибриллы коллагена могут выдержать вес в 10000 раз больше собственного веса, т.е. по прочности превосходят стальную проволоку равного поперечного сечения (рис.2.10.).  Рис.2.10. Электронная микрофотография коллагеновых фибрилл соединительной ткани. Видна периодичность поперечных полос в фибриллах. В коллагенах многих тканей эти полосы повторяются примерно через каждые 64 нм (по Ленинджеру). Коллаген при кипячении в воде превращается в желатин – растворимую смесь полипептидов (используют для приготовления желе, столярного клея). В ходе этого превращения происходит гидролиз некоторых ковалентных связей коллагена, одна из главных причин, по которой мясо приходится переваривать, т.к. именно коллаген соединительной ткани и эластин кровеносных сосудов делают мясо жестким. Коллагены содержат ≈ ЗЗ% остатков глицина и ≈ 11% аланина, 21% пролина, 4-гидроксипролина (только в коллагене!). Поэтому питательная ценность коллагена низкая. Альбумины и глобулины относятся к белкам широко распространенным в органах и тканях животных. Наиболее богаты этими белками сыворотка крови, молоко, яичный белок, мышцы и т.д. В плазме крови в норме содержится 7% белков, из которых на долю альбуминов приходится больше половины, остальные на долю глобулинов. Эти белки различаются по растворимости в дистиллированной воде, NaCl, (NH4)2SO4. Альбумины высаливаются сульфатом аммония и другими нейтральными солями при 80-100% насыщении раствора. Хорошо растворяются в воде и растворах солей. Выполняют пластические функции в тканях и клетках. Глобулины в дистиллированной воде нерастворимы, растворяются в солевых растворах. Их способность по различному растворяться в полунасыщенном растворе сульфата аммония используется для получения препаратов гамма глобулина. Для характеристики белков крови широко применяют разделение их методом электрофореза в геле (полиакриламидном) или на бумаге. При этом альбумины, имеющие молекулярную массу около 35000-69000, продвигаются быстрее, а глобулины, имеющие молекулярную массу 150000 Да и более, – медленнее. Альбумины принимают участие в создании нормального осмотического давления крови, около 75-80% осмотического давления белков приходится на долю альбуминов. Они же транспортируют жирные кислоты, гормоны, Ca2+ и т.д. Глобулины – по форме молекул относятся к глобулярным белкам. Различают сывороточные, молочные, яичные глобулины. Глобулины имеют несколько фракций: α, β, γ. Гамма-глобулины являются носителями иммунитета: антитела относятся к γ-глобулинам. Химия сложных белков Молекула сложного белка состоит из простого белка и небелкового вещества – простетической группы (греч. prostheto – присоединяю). Хромопротеиды – (chroma – краска), состоят из белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеиды, магний-порфирины, флавопротеиды. Они участвуют в фотосинтезе, дыхании клеток и целостного организма, транспорте кислорода и углекислоты, окислительно-востановительных реакциях и т.д. Таким образом, они играют исключительно важную роль в процессах жизнедеятельности. Гемопротеиды – к ним относятся гемоглобин и его производные, миоглобин, хлорофилсодержащие белки и ферменты. Все они содержат в качестве небелкового компонента структурно сходные железо- или магнийпорфирины. Гемоглобин содержится в эритроцитах, белковая часть – глобин, а небелковая часть – гем. Видовые различия гемоглобина обусловлены глобином, а гем одинаков у всех видов. Доля гема составляет 4%, глобина- 96%. Гем состоит из четырех пиррольных колец: 1,3,5,8 -тетраметил, 2,4 -дивинил, 6,7 дипропионовый порфин (рис.2.11). 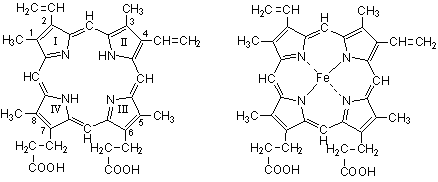 Протопорфирин IX Гем (1,3, 5, 8 - тетраметил - 2, 4 - дивинил – 6,7 - дипропионовокислый порфин) Рис. 2.11. Гем Атом железа связывается с порфирином, а также с белковым компонентом (имидазольной группой гистидина). Белковая часть состоит из двух α-цепей, состоящих из 141 аминокислотного остатка, β-цепей, состоящей из 146 аминокислотных остатков. Серповидная анемия связана с глобином, где в шестом положении пептида глутаминовая кислота в норме заменена валяном (рис.2.3). Производные гемоглобина: Оксигемоглобин HbO2, где кислород соединен координационной связью с атомом железа, что обеспечивает оксигенизацию - насыщение кислородом, это не химическая связь. Карбоксигемоглобин HbCO – гемоглобин связан с оксидом углерода (угарным газом). При этом Hb теряет способность связывать кислород. Метгемоглобин HbOH – окисленный гемоглобин. Образуется при отравлении оксидом азота, парами нитробензола и другими соединениями, железо трехвалентное; не способен к оксигенизации. Карбгемоглобин HbCO2 – гемоглобин, насыщенный углекислым газом CO2. Миоглобин имеет Мм 17000 Да, имеет гем и одну полипептидную цепь, содержится в мышечной ткани. Каталаза – гемсодержащий фермент, имеет Мм 225000 Да, катализирует разрушение перекиси водорода: 2H2O2 → 2H2O +O2. Флавопротеиды – входят в состав ферментов оксидоредуктаз, катализирующих окислительно-восстановительные реакции в клетке. Некоторые из них содержат ионы металлов. Нуклеопротеиды – состоят из белков и нуклеиновых кислот. Различают ДНП (дезоксинуклеопротеид), РНП (рибонуклеопротеид). ДНП преимущественно локализован в ядре, а РНП – в цитоплазме. ДНК хранит наследственную информацию, является важнейшим компонентом биохимической структуры клетки животного организма, а потому нуклеопротеиды будут рассмотрены более подробно в разделе "Нуклеиновые кислоты". Липопротеиды – состоят из белка и липида. В составе липопротеидов открыты нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды. Липопротеиды широко распространены в природе и выполняют разнообразные функции. Они входят в состав клеточной мембраны, внутриклеточных мембран ядра, митохондрий, микросом, миелиновых оболочек нервных волокон. Различают следующие липопротеиды в плазме крови: α-ЛПВП – липопротеиды высокой плотности, содержание белка в них - 50%, богаты фосфатидами. β-ЛПНП – липопротеиды низкой плотности, содержание белка в них 21%, богаты холестерином. Пре-β-ЛПОНП – липопротеиды особо низкой плотности, содержание белка в них 9%; богаты триглицеридами. Хиломикроны, содержание белка 1% (жиры). Липопротеиды, особенно богатые холестерином, имеют значение в развитии атеросклероза. Фосфопротеиды. К ним относятся казеиноген молока, вителлин, фосфовитин, выделенные из желтка куриного яйца, овальбумин, много фосфопротеидов в тканях нервной системы. Фосфопротеиды синтезируются в клетке путем посттрансляционной модификации. Они содержат органически связанный лабильный фосфат, абсолютно необходимый для выполнения ряда биологических функций. Гликопротеиды. Простетическая группа представлена углеводами и их производными. В гидролизате обнаруживают гексозамины (глюкозамин, галактозамин), глюкозу, маннозу, галактозу, ксилозу, арабинозу, глюкуроновую, уксусную и серные кислоты, нейраминовую и сиаловую кислоты и т.д. Гиалуроновая кислота – входит в состав внеклеточного вещества соединительной ткани, содержится в клеточной оболочке, в стекловидном теле, синовиальной жидкости. Состоит из D-глюкуроновой кислоты и N-ацетил-О-глюкозамина, соединенных β(1→3)-гликозидной связью (формула гиалуроновой кислоты приведена на стр.79). Между собой структурные единицы дисахаридов соединены обычными β(1→4)-связями, которые разрываются под действием фермента гиалуронидазы. Хондроитинсерная кислота – тоже полимерная молекула внеклеточного основного вещества, имеет структуру подобную гиалуроновой кислоте; отличие в том, что вместо N-ацетил-D-глюкозамина в состав входит N-ацетил-D-галактозамин. К гликопротеидам относятся также белки плазмы (за исключением альбуминов), трансферрин, церулоплазмин, гонадотропный, фолликулостимулирующие гормоны, муцин, овомукоид. Металлопротеиды. К ним относятся биополимеры, содержащие, кроме белка, ионы какого-либо металла. Типичные представители – железосодержащие ферритин, трансферрин, гемосидерин. Ферритин – высокомолекулярный водорастворимый белок с молекулярной массой 400000, содержание железа 17-23% (в среднем 20%), главным образом находится в селезенке, печени, костном мозге, является депо железа в организме. Трансферрин – железопротеид с молекулярной массой 90000 Да обнаружен в сыворотке крови в составе β-глобулинов, содержание железа в нем 0,13%. Железо связано координационно с участием гидроксильных групп тирозина. Это физиологический переносчик железа. Гемосидерин – содержится в клетках РЭС, печени, селезенки. Ко второй группе металлопротеидов относятся ферменты, у которых металл является мостиком между белковыми компонентами и субстратом, при этом металл выполняет каталитическую функцию. Сюда относятся ферменты, зависимые от ионов Zn2+, Mg2+, Fe2+, Fe3+, Mn2+, Cu2+, K+, Na+, Ca2+. Так, Zn+ обеспечивает каталитическую активность ферментов: алкогольдегидрагеназы, карбоангидразы, карбоксипептидазы; Mg2+ – фосфогидролазы и фосфотрансферазы; Mn2+ – аргиназы и фосфотрансферазы; Cu+ – цитохромоксидазы и тирозиназы; Fe2+, Fe3+ – цитохромов, пероксидазы, каталазы, ферредоксин-НАДФ-оксидоредуктазы; Mg2+, Ca +, Na+, K+ – фосфопируваткиназы, АТФ-азы. Ионы металлов могут быть прочно (ковалентно) присоединены, или же могут легко отделяться, но без ионов металла активность фермента отсутствует. |
