биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
 Скачать 14.38 Mb. Скачать 14.38 Mb.
|
4. ФЕРМЕНТЫФерменты или энзимы представляют собой высокоспециализированный класс веществ белковой природы, используемых живыми организмами для осуществления многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение большого разнообразия химических соединений Жизнь и многообразие ее проявлений – это сложная совокупность химических реакций, катализируемых ферментами. Ферменты отличаются рядом характерных свойств от неорганических катализаторов: ферменты чрезвычайно эффективны и проявляют каталитическую активность в условиях температуры тела, нормального давления и (в основном) при нейтральных значениях рН. Каждый фермент катализирует, как правило, только одну химическую реакцию, т.е. ферменты высоко специфичны. Каждый фермент имеет специфическую первичную структуру, активность фермента контролируется как на генетическом уровне, так и посредством низкомолекулярных соединений: субстратов и продуктов реакций, катализируемых этими же ферментами. Молекула фермента имеет уникальную структуру и, соответственно, уникальную функцию. Учение о ферментах – ферментология, энзимология (греч. enzyme – в дрожжах, лат. fermentatio – брожение) исторически связано с процессом брожения, выделением газов. Энзимология решает вопросы: а) молекулярной структуры ферментов; б) природы химических взаимодействий, лежащих в основе ферментативного катализа. Изучение ферментов имеет огромное значение как в теоретическом, так и в прикладном плане. Ферменты применяются в различных отраслях промышленности, сельского хозяйства, медицины. Например, вопросы заготовки кормов – сушка травы, приготовление сенажа, силоса, применение ферментных препаратов в качестве добавок к кормам – все рассчитаны на процессы, связанные с активностью ферментов. Фармакологическое действие многих лекарственных препаратов основано на определенном механизме взаимодействия их с ферментами. Процессы пищеварения, всасывания, все проявления жизни – рост, развитие – все связаны с действием определенных ферментов. История. Явления брожения и переваривания известны давно, но учение о ферментах зародилось в 1814 г., когда Петербургский ученый Кирхгоф показал, что не только проросшее зерно ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. В последующем были открыты другие ферменты, в частности пепсин, трипсин, вызывающие гидролиз белков в желудочно-кишечном тракте. Наибольшее внимание исследователей привлекали процессы окисления в организме. Например, было известно, что горение сахара на воздухе происходит медленно, если же добавить немного солей лития, то горение сахара идет очень интенсивно в соответствии со следующим уравнением: C 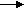 6H12O6+ 6O2 6CO2+ 6H2O 6H12O6+ 6O2 6CO2+ 6H2OВ живых организмах "горение", точнее окисление углеводов также протекает быстро и до тех же конечных продуктов, т.е. CO2 и H2O с выделением энергии. Однако, эта реакция происходит при относительно низкой температуре, без пламени, в присутствии воды. Это "горение", окисление сахара в организме происходит под действием биологических катализаторов – ферментов. Сейчас известно, что при окислении глюкозы до CO2 и H2O участвуют до 15 различных ферментов. Биологические катализаторы – ферменты осуществляют те же реакции, которые возможны по термодинамическим условиям, но они их лишь ускоряют, так же, как и неорганические катализаторы. Пример: перекись водорода H2O2 может медленно расщепляться на молекулярный кислород O2 и H2O и в отсутствие катализатора, но в присутствии платины (порошок) эта реакция идет с высокой скоростью: 2 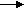 H2O2 2H2O + O2 H2O2 2H2O + O2платина или каталаза Эту же реакцию можно провести с высокой скоростью в присутствии фермента каталазы (например, содержащегося в эритроцитах), при этом образуются те же конечные продукты. Таким образом, можно считать установленным, что ферменты катализируют ряд химических реакций, аналогичных химическим реакциям, катализирующимся неорганическими веществами. Ферменты долгое время считали "организованными" (Л.Пастер) и "неорганизованными", т.к. полагали, что ферменты, сбраживающие сахар, связаны с целой клеткой, а кипячение инактивирует фермент. Лишь опыты М.М. Манасеина (1871 г., растертые с измельченным песком дрожжи), Бухнера (1897 г. дрожжевой сок, полученный под давлением 500 атм.), Лебедева A.H. (зимаза из дрожжей, получена настаиванием высушенных дрожжей в теплой воде) показали, что ферментативная активность не связана с целой клеткой, что фермент может быть выделен из клеток. Это послужило началом детального изучения процесса анаэробного окислительно-восстановительного расщепления углеводов. В настоящее время установлено, что любая химическая реакция, протекающая в организме может быть осуществлена вне организма, если удается выделить соответствующий фермент, катализирующий данную реакцию. Правда следует учесть, что ряд ферментов прочно связан с морфологическими структурами клетки – с биомембранами. В целостном организме имеется тесная связь между функцией фермента и его структурой, связанной с клеточными образованиями. Биосинтез и клеточная локализация ферментов Биосинтез молекулы фермента происходит в клетке по схеме синтеза белка. Наиболее интенсивно синтезируются ферменты в период роста и развития. В отдельных органах ферменты синтезируются в больших количествах. Например, слюнные, желудочные, кишечные, поджелудочные железы синтезируют ферменты, обеспечивающие гидролитическое расщепление кормовых масс. Для ферментов характерна определенная клеточная локализация. В клеточном ядре находятся ферменты обмена нуклеиновых кислот – ДНК-полимераза, гираза, РНК-полимераза и т.д. В митохондриях – ферменты цикла трикарбоновых кислот и дыхательной цепи, окисления жирных кислот; в цитозоле – ферменты гликолиза, синтеза жирных кислот, активирования аминокислот; в рибосомах – ферменты белкового синтеза; в лизосомах – ферменты, гидролизующие белки, нуклеиновые кислоты, липиды и полисахариды – катепсины, ДНК-азы, РНК-азы, фосфатазы и т.д. При этом ферменты в клетке находятся не в разрозненном состоянии, а функционируют в виде агрегатов сложных, строго упорядоченных структур. Формирование этих структур осуществляется с участием молекулярных шаперонов, то есть временных сопровождающих участников, которые не входят в состав конечных продуктов. Шапероны состоят из 7-членного кольца (бублика), имеют форму колеса и "катятся" по ниточке актина (при сокращении мышечной ткани) или вдоль микротрубочек, транспортируя белковые молекулы к месту назначения. Так, полиферментный пируватдегидрогеназный комплекс состоит из трех ферментов. В состав этого комплекса E.coli, Мм 4,6x10 Да, входят 24 молекулы пируватдегидрогеназы, 24 молекулы дегидролипоилтрансферазы, 12 субединиц дегидролипоилдегидрогеназы и 3 дополнительных белка. Этот комплекс диаметром 300 А осуществляет непрерывный ферментативный процесс окислительного декарбоксилирования и его регуляцию. Гликолиз, если начинается с гликогена, то обеспечивается участием 14 ферментов, находящихся в виде сложного комплекса на мембранах, их называют метаболоном. Метаболон – это надмолекулярный комплекс ферментов, катализирующих последовательные стадии метаболического пути в структурных элементах клетки. Химическая природа ферментов Ферменты являются белками. Это доказывается тем, что ферменты брожения инактивируются (Jl. Пастер) при кипячении, при котором происходит необратимая денатурация белка-фермента. Фермент при этом теряет свою способность катализировать химическую реакцию. Точно так же при кипячении белки теряют другие биологические свойства – антигенные, гормональные, каталитические. Ферменты при гидролизе распадаются на аминокислоты. Многие ферменты выделены в виде индивидуального белка в кристаллической форме, сейчас свыше 200 ферментов выделены в чистом виде и изучена их первичная структура. Первый кристаллический фермент уреаза был получен в 1926 году Самнером. В 1930 г. Нортрап выделил в виде кристаллов пепсин, в 1931 г. – трипсин. Будучи белками, они обладают амфотерными свойствами – могут существовать в растворе в виде анионов, катионов и амфионов, обладают электрофоретической подвижностью, а в изоэлектрической точке не обнаруживают подвижности; неспособны к диализу через полупроницаемые мембраны, легко осаждаются методом высаливания, ацетоном, этанолом, обладают высокой молекулярной массой (см. таблицу 4.1.). Таблица 4.1. Молекулярная масса ферментов
Ферменты обладают высокой специфичностью действия. В последние годы показано, что кроме белков ферментативной активностью обладают и молекулы РНК, их называют рибозимы. Каталитической активностью обладают также некоторые антитела, их называют абзимы. Так антитела, образующиеся при аутоиммунных заболеваниях, способны гидролизовать белки, РНК и ДНК. Иммуноглобулины G молока и их фрагменты могут гидролизовать моно-, ди- и трифосфаты. При работе с ферментами нужно учитывать их белковую природу, чтобы сохранить их стабильность; для этого надо соблюдать:
Строение ферментов Ферменты относятся к простыме и сложныме белкам. Ферменты однокомпонентные – простые белки. К ним относятся гидролитические ферменты – пепсин, трипсин, папаин,уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Ферменты двухкомпонентные (сложные белки) – кроме белкового компонента, содержат небелковый компонент – кофермент, белковая часть называется апоферментом, а все вместе называется холоферментом. Кофермент может быть связан с белковой частью ковалентной связью, но могут быть и слабые связи – водородные, электростатические взаимодействия и др. В случаях слабой связи между коферментом и белковой частью при выделении может происходить диссоциация – отделение небелковой части и изолированный белковый компонент оказывается лишенной ферментативной активности. Такими коферментами являются витамины B1 – тиамин, B2 – рибофлавин, B6 – пиридоксол, PP – никотинамид и другие. Ферменты, содержащие их, при выделении, очистке, как правило, теряют активность и лишь при добавлении кофактора вновь приобретают активность. Многие двухвалентные металлы (Mg2+, Mn2+, Ca2+) выполняют роль кофакторов, хотя их не относят к коферментам; в ряде случаев ионы металлов прочно связаны с белковой молекулой и выполняют функции простетической группы. Например: фермент, катализирующий окисление витамина С (аскорбиновой кислоты) в дезоксиаскорбиновую кислоту, содержит 8 атомов меди на молекулу. Все они прочно связаны с белковой молекулой, даже не обмениваются ионообменными смолами и не отделяются путем диализа. Доказано, что ионы меди принимают участие в переносе электронов. Коферментами являются витамин PP (никотинамид), B2 (рибофлавин), пантотеновая кислота, фолиевая кислота, биотин (витамин H), B1 (тиамин), B6 (пиридоксин), B12 (цианкобаламин), витамин Q (убихинон); они связаны с нуклеотидами (НАД, НАДФ, ФМН, ФАД, KoA, ТДФ, ПФ и т.д.). Кофакторами могут быть соединения, не являющиеся витаминами: HS -глутатион, АТФ, липоевая кислота, производные нуклеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), порфиринсодержащие вещества и др. Сюда же могут быть отнесены т-РНК, которые в составе фермента аминоацил-т-РНК-синтетазы принимают участие в синтезе белка. Следует подчеркнуть, что ни кофермент, ни апофермент в отдельности каталитической активностью не обладают. Лишь в виде комплекса они проявляют свою активность фермента. Активный центр фермента Молекула фермента, особенно у сложных ферментов, является очень крупной и при взаимодействии с субстратом в контакт входит лишь ее ограниченная часть – активный центр фермента. В активном центре фермента различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и "контактную" (якорную) площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом (рис. 4.1.). 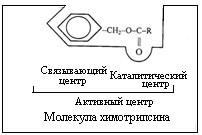 Рис.4.1. Образование фермент-субстратного комплекса. Выявление химической природы и топографии групп активного центра является важной проблемой – необходимо определить первичную структуру и взаиморасположение аминокислот в активном центре. Для решения этого вопроса применяют различные приемы (ингибиторы, частичный гидролиз и т.д.). Сейчас известно, что первичная структура активного центра определяется генетически, что реализуется при синтезе белка в рибосомах. Любое воздействие, связанное с денатурацией, приводит к нарушению активного центра и соответственно к потере ферментативной активности. Если удается восстановить третичную структуру фермента, то восстанавливается функция активного центра, что было доказано для рибонуклеазы поджелудочной железы. Ферменты имеют 1,2 и более активных центра. Фермент уреаза имеет 3 активных центра, а холинэстераза – 20 активных центров. Активный центр состоит из 8-10 аминокислотных остатков, чаще всего в него входят серии, гистидин, тирозин, триптофан, глутаминовая кислота. В молекуле фермента различают также аллостерический центр (греч. аллос – другой, стериос – пространственный). Ферменты, активность которых контролируется состоянием как активного, так и аллостерического центра, получили название аллостерических ферментов, их называют также регуляторными ферментами. Ферменты, имеют множественные молекулярные формы, которые называют изоферменты и гетероферменты. Изоферментами (изоэнзимами) называют белки, обладающие ферментативной активностью и катализирующие одну и ту же реакцию. Они встречаются у одного и того же вида, но отличаются между собой физико-химическими свойствами. Некоторые из них различаются между собой сродством к субстрату, коферменту и ингибитору. Например, лактатдегидрогеназа (ЛДГ) осуществляет превращение молочной и пировиноградной кислот, имеет Мм 140000 Да, ее молекула состоит из четырех субъединиц. Различают ЛДГ-1, содержащийся в мышечной ткани сердца, и ЛДГ-2 в мышечной ткани скелета; они различаются по электрофоретической подвижности. Гетероферментами называют каталитические молекулы белков, различающиеся по размерам молекул. Ферменты, выполняющие одинаковые функции, могут встречаться в различных формах не только у различных животных, у различных органов одного и того же животного, но и в разных частях клетки. Изоферментам принадлежит роль в регуляции отдельных звеньев обмена веществ. Например: изофермент лактатдегидрогеназы из сердечной мышцы (ЛДГ-1) резко тормозится пируватом, а скелетной мышцы – ЛДГ-2- менее чувствителен к нему. Регуляция активности ферментов Аллостерическая регуляция сопровождается изменением сродства фермента к субстрату без изменения максимальной скорости реакции. Это очень распространенная и чувствительная регуляция. Широко представлены такие коферменты как АМФ, АДФ, АТФ, НАД, НАДН, НАДФ, НАДФН, лимонная кислота, ацетил-KoA и ряд других, которые одновременно являются субстратами, продуктами и регуляторами ферментативных реакций. Регуляция активности ферментов происходит также ковалентной модификацией. Открытие этого пути – важнейшее достижение биохимии. Активирование и ингибирование активности ферментов фосфорилированием их киназами, участие циклической АТФ в процессах действия гормонов, наличие специфических рецепторов гормонов в мембранах клеток – все это является новым этапом в изучении регуляции обмена веществ. Общая схема регуляции при этом заключаются в следующем: циклический АМФ (ц-АМФ) присоединяется к регуляторной субъединице, что ведет к освобождению его активной каталитической субъединицы, то есть концентрация ц-АМФ, его образование под влиянием циклазы и расщепление под влиянием фосфодиэстеразы лежат в основе регуляции целого ряда путей обмена веществ. Фосфорилирование также является распространенным механизмом регулирования активности ферментов обмена веществ. Гормональная регуляция активности ферментов заключается в том, что имеется связь между влиянием гормонов на процессы транскрипции и модификацией негистоновых белков ядра. Гормоны могут выступать как эффекторы (сенсорные участки) ДНК и т.д. Нервная регуляция активности ферментов изучается давно (обмен веществ). На животных с перерезкой нервов доказано, что при этом ряд ферментов мышечной ткани меняет свои свойства. |
