|
|
биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
12.ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
Переваривание нуклеиновых кислот в желудочно-кишечном тракте
Нуклеиновые кислоты корма находятся в виде нуклеопротеидов. В ротовой полости они подвергаются измельчению, смачиванию слюной. В желудке нуклеопротеиды подвергаются действию пепсина, а в кишечнике – трипсина и других протеаз. Под действием этих ферментов белки нуклеопротеидов гидролизуются до аминокислот и аминокислоты всасываются.
Процесс расщепления нуклеопротеидов показан на следующей схеме:
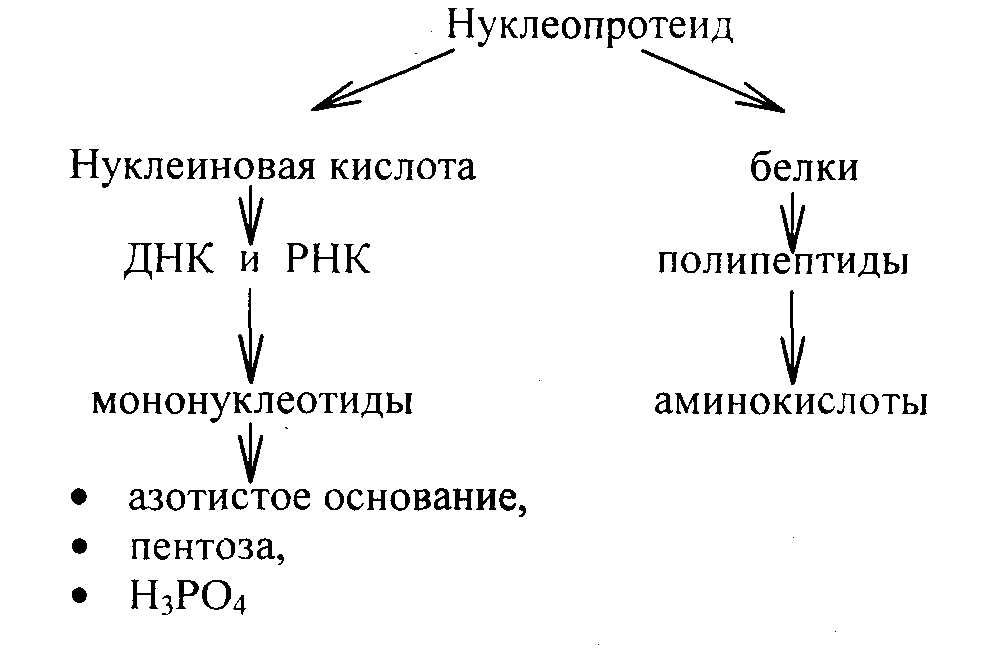
Нуклеиновые кислоты расщепляются под действием нуклеаз – рибонуклеазы (РНКазы) и дезоксирибонуклеазы (ДНКазы), содержащихся в соке поджелудочной железы. ДНК-азы поджелудочной железы – эндонуклеазы расщепляют ДНК на двуспиральные куски, затем до олигонуклеотидов (около четырех нуклеотидных остатков) со свободной -ОН группой в 3`- и фосфатной группой в 5'-положениях в остатке дезоксирибозы. Далее гидролиз происходит до образования мононуклеотидов. Нуклеотиды, нуклеозиды и неорганический фосфат всасываются в кровь и поступают в печень.
РНКазы гидролизуют РНК также до образования нуклеотидов, нуклеозидов и фосфорной кислоты. Продукты гидролиза нуклеиновых кислот поступают в клетки организма, где используются для синтеза нуклеотидов, нуклеиновых кислот, или же для удовлетворения энергетических потребностей организма.
Промежуточный обмен нуклеиновых кислот
Распад нуклеиновых кислот в тканях
В клетках тканей нуклеиновые кислоты распадаются под влиянием нуклеаз. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы гидролизуют фосфодиэфирные связи одновременно во многих участках молекулы нуклеиновых кислот. По специфичности действия различают ДНКазы и РНКазы. В результате их действия образуются олигонуклеотиды и лишь небольшое количества мононуклеотидов. Экзонуклеазы отщепляют нуклеотиды с 3′ или 5' конца, в результате образуются свободные рибонуклеозид или дезоксирибонуклеозид – 3`или 5' фосфаты, например:
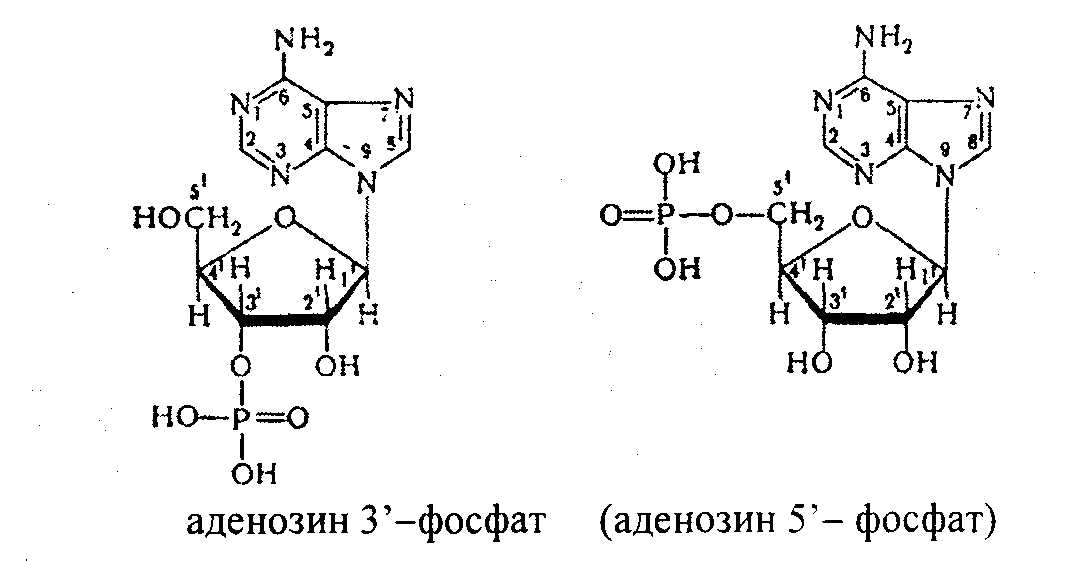
Рибо- и дезоксирибонуклеозидфосфаты расщепляются до нуклеозидов и фосфорной кислоты (под действием фосфатаз).
Нуклеозиды могут расщепляться и гидролитическим путем с участием фермента нуклеозидазы:
Аденозин + Н2О → Аденин + рибоза
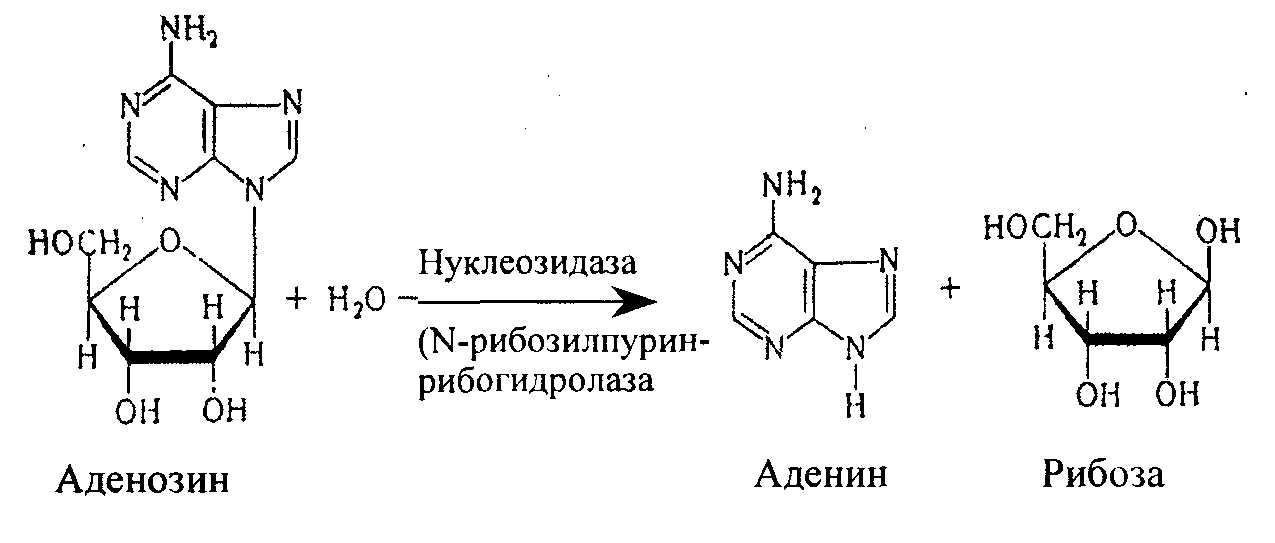
Другие мононуклеотиды подвергаются расщеплению таким же образом.
Пентозы окисляются до CO2 и H2O; фосфорная кислота используется для фосфорилирования органических соединений или выводится из организма. Азотистые основания превращаются в конечные продукты обмена и выделяются с мочой.
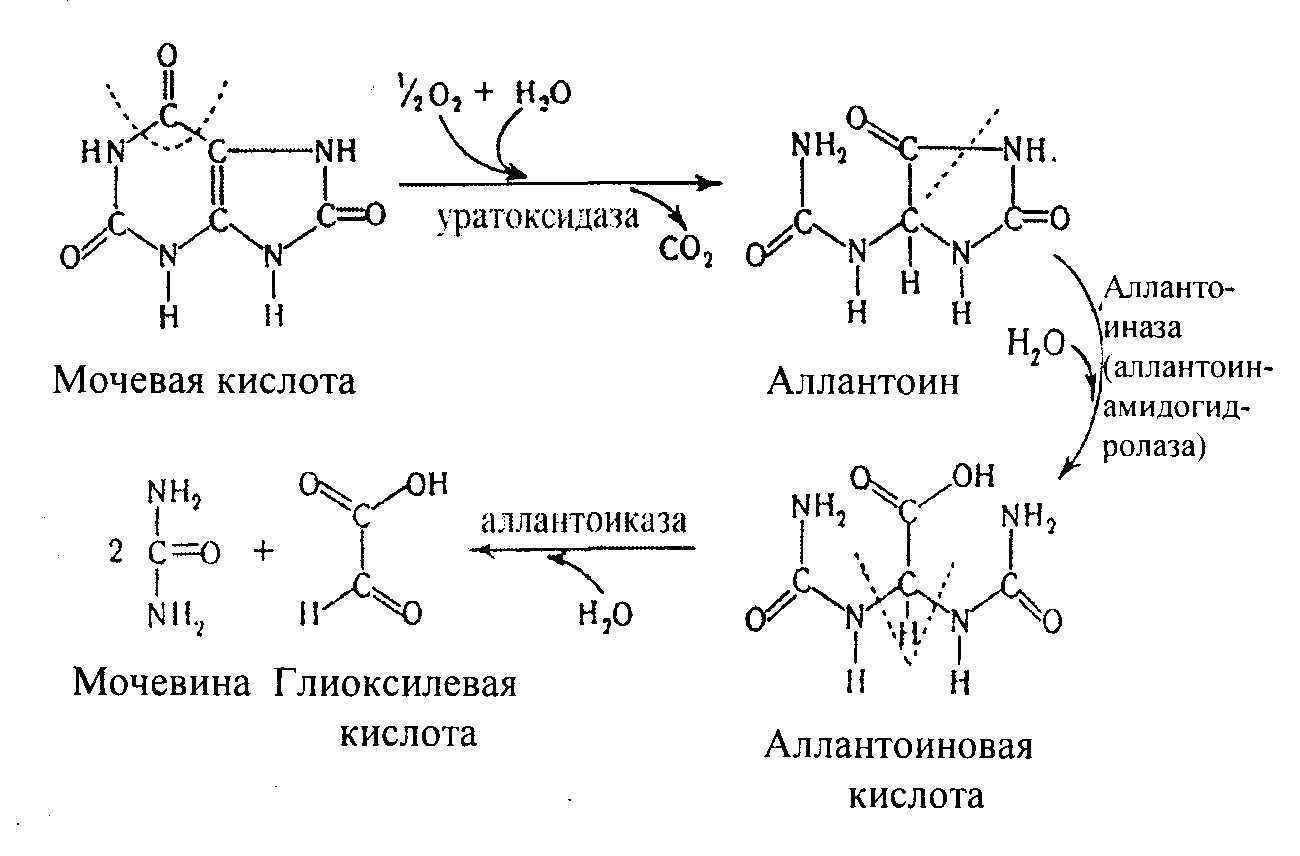
Пурины вначале дезаминируются до гипоксантина и ксантина, затем окисляются до конечных продуктов обмена – мочевой кислоты у человека, обезьян, свиней, птиц и аллантоина - у коров, лошадей, собак и кроликов. Мочевая кислота может образовываться из свободных пуринов – аденина и гуанина, а также из соответствующих нуклеозидов и нуклеотидов. Мочевая кислота в печени окисляется до аллантоина:
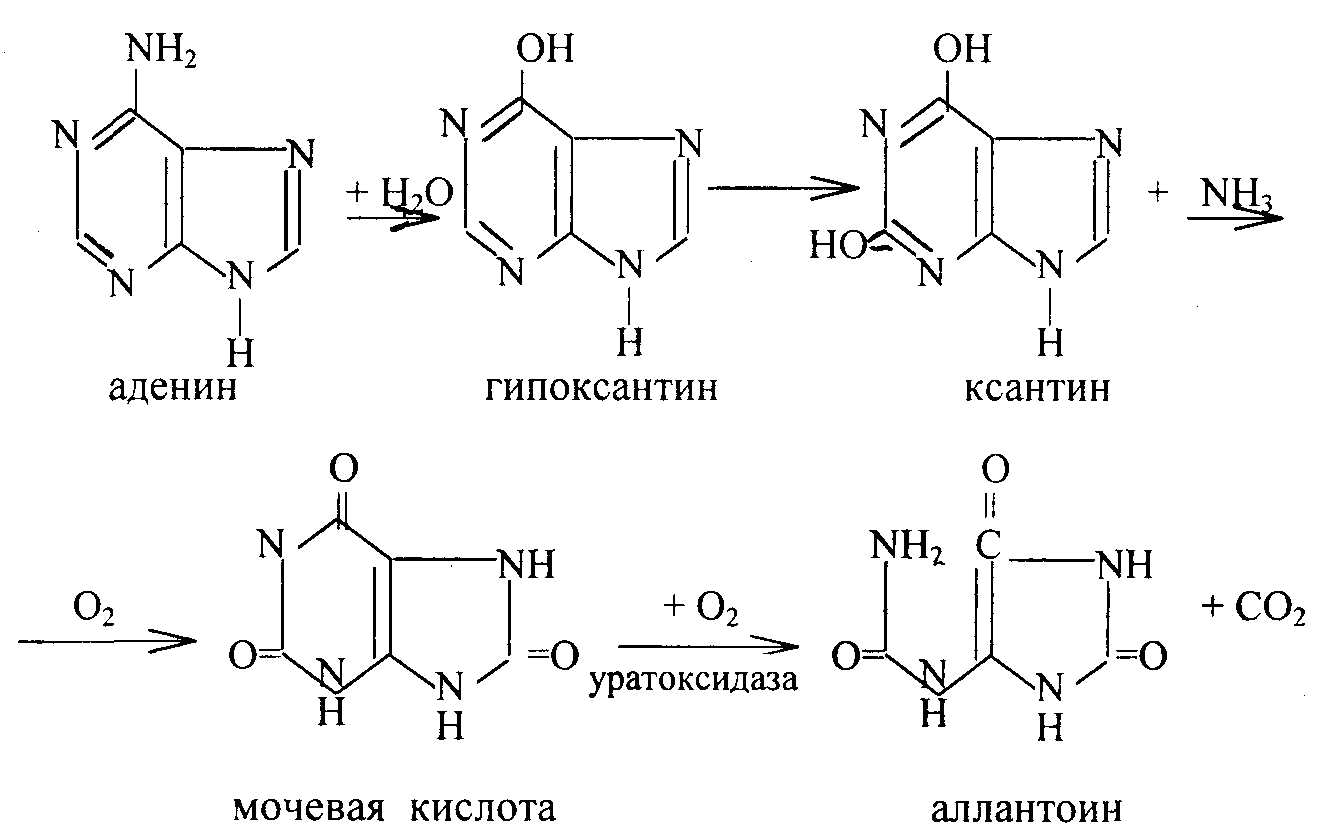
Гуанин под действием фермента гуаназы превращается в ксантин. Мочевая кислота плохо растворяется в воде (1:15000) и при нарушении обмена нуклеиновых кислот, особенно при избыточном поступлении в организм пуринов, мочевая кислота и ее соли откладываются в виде кристаллов в суставах пальцев, хрящах, в коже и мышцах, образуя узелки. Вокруг узелков развивается очень болезненный воспалительный очаг. Это заболевание известно под названием подагра. У многих животных, кроме млекопитающих, аллантоин может подвергаться дальнейшему расщеплению (у некоторых рыб, амфибий, морских беспозвоночных) с образованиекм аллантоиновой кислоты, а из нее – мочевины и глиоксалевой кислоты.
Пиримидиновые основания
Цитозин дезаминируется под действием фермента дезаминазы с образованием урацила и аммиака. Аммиак включается в орнитиновый цикл образования мочевины. Урацил и тимин восстанавливаются в дигидроурацил и дигидротимин, которые далее распадаются с образованием β-уреидпроизводных с выделением аммиака, CO2, β-аланина и его метилированного производного:
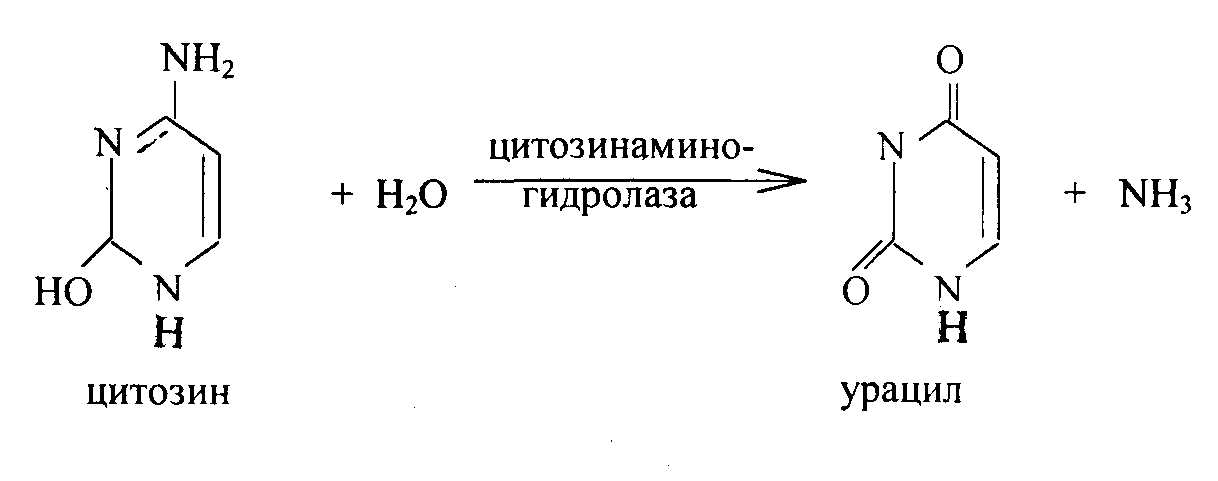

Распад тимина происходит по этой же схеме.
Биосинтез нуклеиновых кислот
Субстратом для синтеза нуклеиновых кислот в клетках и тканях могут служить продукты гидролиза ДНК и РНК, а также продукты обмена белков и углеводов.
Биосинтез пуриновых нуклеотидов происходит из углекислого газа, глицина, муравьиной кислоты, аспарагиновой кислоты и глутамина. В результате поэтапного синтеза из этих компонентов (всего 11 реакций) образуется инозиновая кислота, из которой затем АМФ и ГМФ. Из указанных монофосфатов затем синтезируются соответствующие ди- и трифосфаты.
Синтез пиримидиновых нуклеотидов происходит также поэтапно, вначале образуется карбомоилфосфат из NH3, CO2, АТФ. Затем с участием аспарагиновой кислоты образуется дигидрооротовая кислота, затем оротовая кислота.
Оротовая кислота далее взаимодействует с 5'-фосфорибозил-1-пирофосфатом, при этом синтезируется оротидин-5 -фосфат, который затем декарбоксилируется с образованием уридинмонофосфата. Из уридиловой кислоты при аминировании углеродов за счет глутамина образуется цитидинмонофосфат, а при метилировании – тимидиловая кислота:
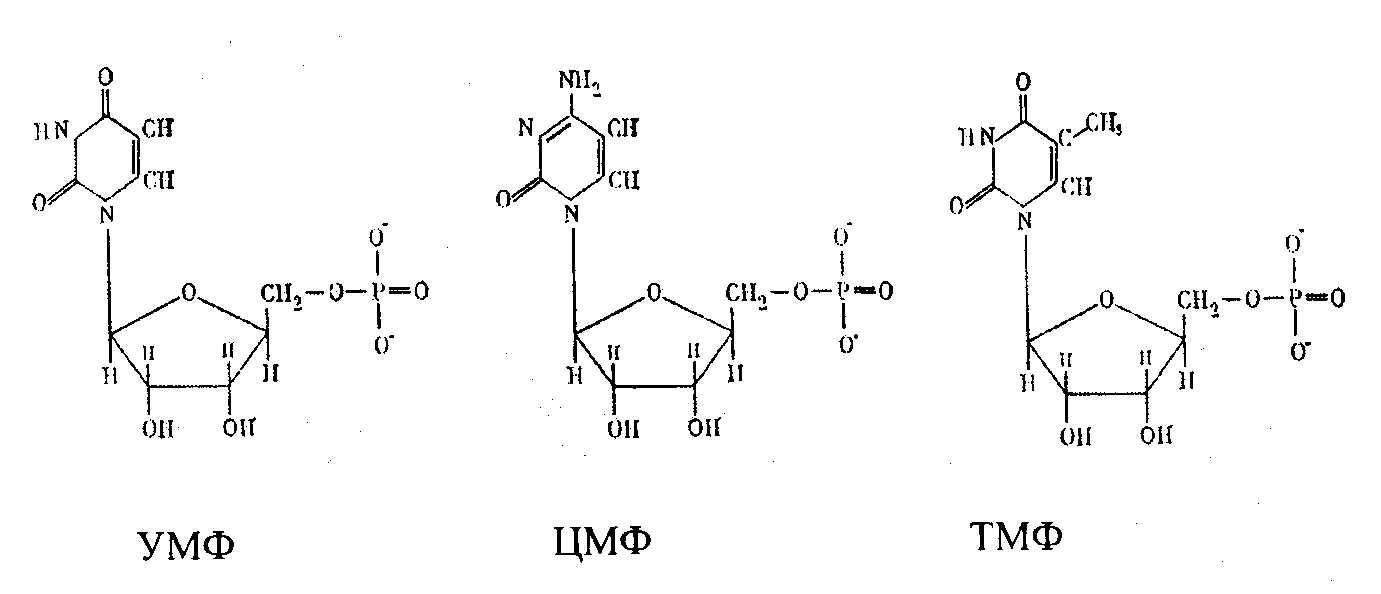
Эти монофосфаты затем фосфорилируются с участием АТФ до образования трифосфатов.
Синтез ДНК (или репликация ДНК). В клетках животных синтез (репликация) ДНК происходит только в определенный период жизни клетки – в синтетической S-фазе. Эта фаза отделена от митоза (M) предсинтетическим (G1 ) и постсинтетическим (G2) периодами (рис. 12.1).
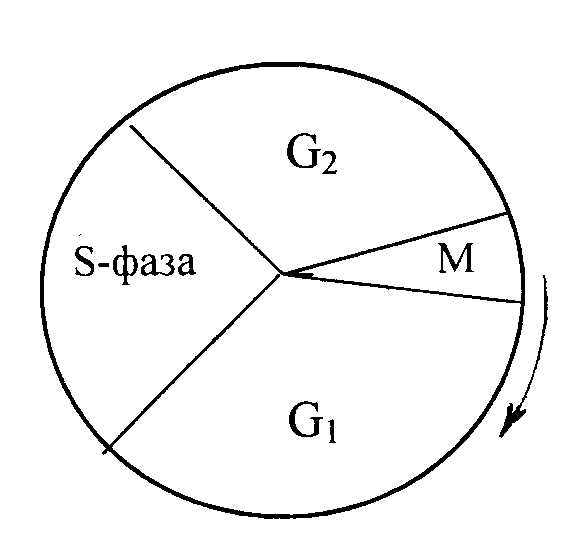
Рис. 12.1. Цикл деления клеток млекопитающих.
Фаза синтеза ДНК (S-фаза) отделена от митоза (M) периодами G1 и G2. Стрелкой указано направление синтеза.
Репликация ДНК происходит в строго определенное время в клетках, готовящихся к делению. В S-фазе происходит полная и строго однократная репликация ядерной ДНК, по времени это занимает примерно 9 часов; за этот срок происходит удвоение генетического материала диплоидной делящейся клетки. Репликация начинается сразу на многих участках молекулы ДНК, называемых точками начала репликаци, обозначаемых ori (origin – начало). Биосинтез ДНК происходит с участием всех четырех дезоксирибонуклеозидтрифосфатов – АТФ, ГТФ, ЦТФ, ТТФ; ферментов синтеза ДНК: ДНК-полимераз, хеликазы – фермента, обеспечивающего раскручивание (расплетение) двойной спирали ДНК в репликативной вилке, топоизомеразы фермента, способствующего расщеплению спирали ДНК в области репликативной вилки, ферментов, «редактирующих» ДНК, т.е. осуществляющих вырезание и удаление ошибочно включенных нуклеотидов или репарирующих повреждения ДНК.
Все этапы синтеза ДНК эукариот осуществляются с помощью репликативного мультиферментного комплекса (праймосомы), состоящего из ферментов и белковых факторов, осуществляющих узнавание точки ori, расплетание родительского дуплекса, удержание материнских цепей ДНК на достаточном расстоянии друг от друга, инициацию новых дочерних цепей, закручивание цепей в спираль и, наконец, терминацию репликации ДНК. В составе комплекса присутствуют новосинтезированная ДНК, не менее 30 белков с Мм от 15 до 300 кДа, ДНК-полимеразы 5, а, праймаза, 3'-5'экзонуклеаза, ДНК-лигаза I, РНКаза H, ДНК-топоизомераза I, ДНК-хеликаза, белок PCNA (ядерный антиген пролиферирующих клеток) и другие факторы.
В праймасоме репликативный белок A (RPA) связывается с однонитевой ДНК и существует в виде комплекса из трех белков с Мм 70, 34 и 11 кДа. Репликативный фактор С (RFC) состоит из пяти белковых елиниц и играет важную роль при связывании репликативных полимераз во время образования репликативной вилки. Белок PCNA, так называемый ДНК-полимеразный зажим, функционирует как кофактор ДНК-полимеразы, образуя закрытое кольцо, окружающее ДНК с каналом в центре. Репликативный фактор С совместно с PCNA продвигается вдоль ДНК по репликативной вилке. С участием праймасомы, ферментов образуются новые полинуклеотидные цепи. Синтез новых цепей всегда идет в направлении от 5'-конца к 3'-концу. Поэтому на одной из ветвей репликативной вилки новая цепь наращивается непрерывно по мере раскручивания ДНК-матрицы, а на другой ветви образуются короткие фрагменты новой цепи ДНК, называемые фрагменты Оказаки; затем концы этих фрагментов соединяются между собой в результате действия фермента ДНК-лигазы (рис. 12.2.).
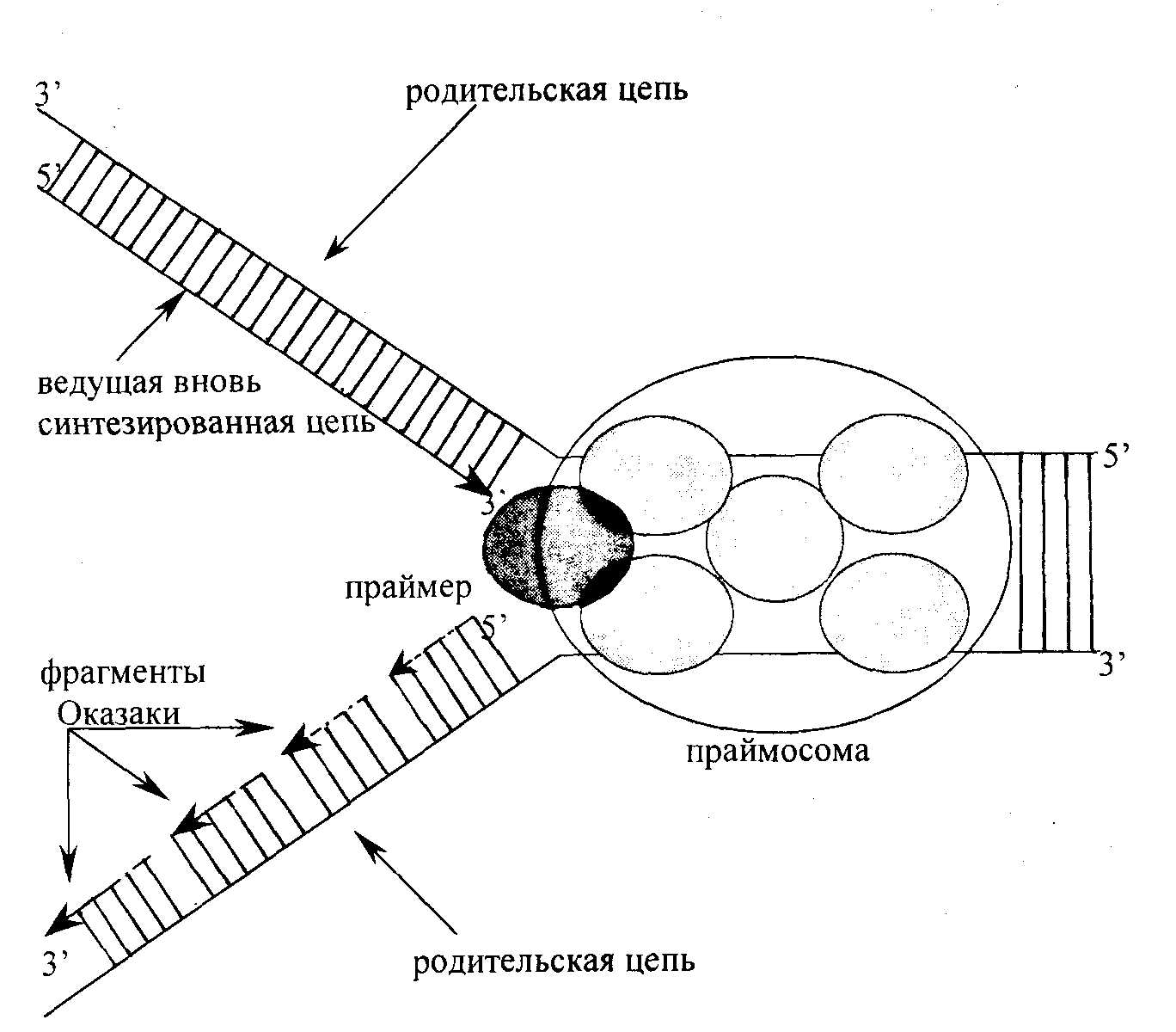
5'
Рис. 12.2. Схематическое изображение синтеза ДНК в репликативной вилке.
На одной ветви репликативной вилки нуклеотидная цепь синтезируется непрерывно, на другой – прерывисто, с образованием фрагментов Оказаки. Фрагменты Оказаки соединяются между собой в результате действия ДНК-лигазы. По мере роста новых цепей репликативная вилка перемещается по ДНК и в результате происходит репликация (удвоение) молекулы ДНК. Последовательности нуклеотидов новой цепи ДНК строго комплементарны последовательностям родительской цепи, благодаря этому соблюдается передача наследственной информации из поколения в поколение (см. рис.3.5.). Точность репликации очень высока – возможна одна ошибка на 10 трансферазных реакций.
Синтез ДНК на матрице РНК происходит под действием фермента ревертазы или обратной транскриптазы (РНК-зависимой ДНК-полимеразы), содержащейся в составе онковирусов. Доказано, что многие РНК-содержащие онкогенные вирусы (онковирусы) содержат этот фермент в составе покровных белков. При этом механизм синтеза ДНК на матрице РНК включает 3 стадии: на первом этапе фермент ревертаза синтезирует на матрице вирусной РНК комплементарную цепь ДНК, что приводит к формированию гибридной молекулы. Затем исходная молекула РНК отделяется от ДНК и только после этого на матрице ДНК синтезируется комплементарная цепь ДНК.
Биосинтез РНК происходит в клетках на матрице ДНК, т.е. синтезируемая РНК комплементарна к одной из цепей этой ДНК. Если при репликации ДНК происходит удвоение всей молекулы ДНК, то при синтезе РНК-транскрипции копия с молекулы ДНК снимается лишь с отдельных генов, с отдельных участков одной из цепей ДНК. Синтез различных форм РНК осуществляется с участием соответствующих РНК-полимераз, которые катализируют синтез информационной (и-РНК), рибосомальной (р-РНК) и транспортной (т-РНК) рибонуклеиновых кислот. В природе существует фермент РНК-зависимая РНК-полимераза, который обеспечивает в клетке репликацию РНК у РНК-содержащих вирусов. При этом РНК вируса выполняет две функции – роль носителя генетической информации (вместо ДНК) и информационной РНК. Вирусная РНК является одноцепочечной. Эту цепь обозначают «плюс»-тип РНК, а синтезируемую в присутствии РНК-полимеразы комплементарную ей цепь РНК «минус»-цепь. Поступившая в клетку вирусная РНК выполняет роль информационной РНК, связывается с рибосомами клетки - хозяина и обеспечивает образование фермента репликазы и белков вирусной оболочки. После этого с помощью фермента репликазы синтезируется вирусная РНК на матрице исходной РНК. В свою очередь молекула «минус»-РНК является матрицей для синтеза цепей «плюс»-РНК.
Рекомбинантные молекулы и проблемы
генной инженерии
Знание структуры молекулы ДНК, ее генетической роли, механизмов репликации ДНК и биосинтеза белка послужили основой развития новой науки – генетической инженерии. Ряд достижений молекулярной биологии и генетической инженерии воплощены в жизнь в области животноводства и ветеринарии: получены рекомбинантные вакцины против опасных инфекционных болезней животных, организовано производство гормона роста, интерферона, аминокислот, лекарственных веществ, разработаны методы ДНК-зондирования, полимеразной цепной реакции и т.д.
В связи с этим рассмотрим основные этапы получения рекомбинантных молекул и использования их для решения проблем ветеринарии. Для манипуляции с генами их получают следующими способами:
• методом химико-ферментативного синтеза;
• синтезом ДНК-копий с помощью обратных транскриптаз;
• выделением из фрагментированной молекулы ДНК.
Последний способ получения гена широко применяется, так как сейчас имеется большой набор ферментов-рестриктаз, так называемых «генных ножниц», позволяющих разрезать молекулу ДНК в определенных участках и выделить необходимый ген.
Следующий элемент – это векторные молекулы, так называемые генетические векторы. Векторные молекулы ДНК, способны перенести в клетку чужеродную ДНК и обеспечить там ее размножение (амплификацию) или включение в геном клетки.
В качестве вектора используют ДНК плазмид, ДНК-фагов, ДНК вируса оспы, ДНК других вирусов и некоторых бактерий. Например, для получения рекомбинантной молекулы ДНК вируса осповакцины, ее разрезают, с помощью рестриктаз и в несущественную часть генома осповакцины вставляют ген, интересующий исследователя. Так, получены рекомбинантные вакцины против чумы крупного рогатого скота, против бешенства, классической чумы свиней и т.д.
Создана рекомбинантная вакцина на основе вируса оспы, содержащего ген антигена вируса чумы крупного рогатого скота. При введении этой вакцины в организме животного образуются антитела, защищающие его от чумы крупного рогатого скота. Вакцину можно применять путем скарификации, что облегчает процедуру вакцинации. Она оказалась дешевле классической. Получена рекомбинантная вакцина против бешенства на основе вируса осповакцины. Она проверена на 30 видах животных с хорошим результатом. Подобная же вакцина создана против классической чумы свиней. При иммунизации этой вакциной образуются нейтрализующие антитела, защищающие животных от этой инфекции.
Создана вакцина на основе генома вируса болезни Ауески (ДНК-вирус), в который включен ген антигена вируса классической чумы свиней (РНК-вирус). Это крупный успех в получении вакцины против двух инфекций одновременно. В качестве векторной молекулы используются ДНК и других вирусов и бактериальных клеток. Является привлекательным использование в качестве основы вакцинного штамма M.bovis БЦЖ. В геном БЦЖ вставляют ген специфического антигена вирулентного штамма. Так созданы новые вакцины против туберкулеза, более эффективные по сравнению с БЦЖ.
Кольцевидная ДНК плазмид использована для получения рекомбинантных молекул с целью прризводства гормона роста. При этом ген гормона роста вставляется в кольцевидную ДНК плазмид и далее эта рекомбинантная молекула вводится в клетку кишечной палочки (E.coli), где в процессе ее жизнедеятельности рекомбинантная молекула экспрессируется, т.е. размножается и соответственно синтезируется гормон роста. Затем этот гормон выделяют из среды выращивания E.coli и применяют для стимуляции роста откормочных бычков или же для усиления молокоотдачи дойных коров. Гормон вводят 1 раз в месяц. Он обеспечивает стимуляцию продуктивности на 20%.
Таким же способом производят интерферон – белок, обеспечивающий защиту организма от вирусных инфекций, ряд других лекарственных препаратов.
Генная терапия – находится на стадии становления. В настоящее время имеются попытки лечения генетических болезней. Например, лейкоциты, извлеченные из крови больного, культивируют in vitro и с помощью ретровируса вносят в них дефицитный недостающий ген. Затем эти нормальные лейкоциты возвращают в организм больного. Так же поступают с клетками костного мозга: их культивируют in vitro, вносят недостающий ген с помощью ретровируса. Затем костномозговые клетки возвращаются в организм.
Антисмысловые РНК и ДНК используют для создания трансгенных животных. Антисмысловые соединения – это короткие одноцепочечные молекулы ДНК или РНК (и-РНК), но с обратной последовательностью. Это соединение связывается с нуклеиновыми кислотами по тому же принципу, как при транскрипции – комплементарно, и затем блокирует синтез белка: трансляция не происходит. Если это антисмысловая ДНК, то она может задержать транскрипцию. Практическое выполнение заключается в том, что у больного берут костный мозг, и клетки костного мозга культивируют in vitro, обрабатывая антисмысловой ДНК, в таких условиях больные клетки погибают, и культура клеток получается здоровой. Параллельно с этим больного лечат облучением – убивают клетки костного мозга. После этого пересаживают здоровые клетки (его же), полученные из культуральной клеточной линии.
Сейчас усиленно изучается эффективность антисмысловых олигонуклеотидов – цепочек ДНК и РНК – ингибиторов при различных заболеваниях. При этом они должны обладать специфичностью, т.е. быть комплементарными к гену данного возбудителя или этиологического фактора. В этом плане имеются определенные успехи: созданы антисмысловая РНК вируса лейкоза крупного рогатого скота, аденовируса, парвовируса. На основании их получены трансгенные животные.
Трансгенез – перенос генов с целью изменения наследственных свойств животных, например путем переноса гена гормона роста. Животное, которое содержит в своем геноме чужой ген (трансген), называется трансгенным. Для переноса гена животных используют метод микроинъекции, ретровирусов и перенос стволовых клеток. Суть методов заключается в следующем:
Метод микроинъекции ДНК в пронуклеус зиготы – основной метод получения трансгенных животных. Метод разработан Дж. Гордоном (1980 г.).
В зиготу, фиксированную под микроскопом, вводят рекомбинантную молекулу ДНК, содержащую 100 и более копий гена. Далее зиготу трансплантируют самке – реципиенту. На мышах получены трансгенные особи, содержащие ген интерферона, гормона роста, гемоглобина человека, кролика, аденовируса, тимидинкиназы.
Использование ретровирусов в качестве векторов. Ретровирусы – это РНК-содержащие вирусы, которые с помощью фермента обратной транскриптазы синтезируют в клетке ДНК. В клетке синтезируется двухцепочечная ДНК, содержащая
генетическую информацию вирусной РНК. Такая ДНК интегрируется в хромосомную ДНК клетки, образуя провирус.
Инъекция трансформированных эмбриональных стволовых клеток в эмбрион. Стволовые клетки способны делиться и дифференцироваться. Их умеют выделять и размножать в культуре. В выделенные клетки можно инъецировать генные конструкции. Затем стволовые клетки включают в реципиентный бластоцит.
Трансгенез осуществлен на лабораторных (мыши, крысы) и сельскохозяйственных (овцы, свиньи, кролики, коровы) животных (Халитер и др., 1985 г; Крамер и др., 1986 г.).
Мышам в пронуклеус оплодотворенной клетки инъецировали микрошприцом ген интерферона, гормона роста, гемоглобина человека, кролика, аденовируса. Экспрессию гена гормона роста проверяли по живой массе, методом ДНК-гибридизации, полимеразной цепной реакции и т.д. Наиболее доступным объектом для биотехнологии являются кролики; связано это с тем, что экспрессия чужеродного гена осуществляется в них наиболее часто – 25% случаев. Получены трансгенные овцы (1985г, Австралия) с геном гормона роста; живая масса их была в 1,5 раза выше контрольных животных.
Трансгенез представляет интерес, прежде всего, для получения животных, в качестве продуцентов биологически активных веществ и лечебных препаратов. Например, трансгенных животных используют для продуцирования человеческого инсулина, фактора свертываемости крови, интерферона. Ведутся исследования по получению трансгенных животных, устойчивых к ряду заболеваний (гриппу, лейкозу и т.д.), многоплодных с улучшенными хозяйственными признаками.
Клонирование животных
Под клоном понимают генетически однородные потомки одной исходной особи, образующиеся в результате бесполого размножения.
Для создания генетических копий сельскохозяйственных животных методом клеточной инженерии разрабатываются способы клонирования: пересадка ядер соматических клеток в яйцеклетку с предварительно удаленным ядром. Для этого берут от донора стволовые (не прошедшие дифференцировку) клетки. Ядро стволовых клеток in vitro вводят в энуклеированные яйцеклетки реципиента. Полученные таким способом зиготы крупного рогатого скота можно культивировать in vitro до 8-, 16-ти даже 32-клеточной стадии. Таких эмбрионов, достигших завершающих стадий предимплантационного развития, можно не только трансплантировать коровам-реципиентам или замораживать для длительного хранения, но использовать для последующего клонирования. Таким образом, можно в условиях in vitro получать неограниченное количество эмбрионов. Метод клонирования животных является очень привлекательным для получения неограниченно большого количества копий от высокопродуктивных особей, а потому разрабатывается очень интенсивно.
Достижения молекулярной биологии по изучению роли нуклеиновых кислот в процессах жизнедеятельности привели к разработке совершенно новых методов диагностики болезней животных и человека на основе уникальных свойств ДНК и РНК. Это – методы молекулярной гибридизации и полимеразной цепной реакции.
|
|
|
 Скачать 14.38 Mb.
Скачать 14.38 Mb.