биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
 Скачать 14.38 Mb. Скачать 14.38 Mb.
|
|
14. БИОХИМИЯ КРОВИ Кровь, лимфа, спинномозговая и межтканевая жидкость – все вместе у животных составляет внутреннюю среду организма. Кровь омывает все клетки – доставляет необходимые вещества, уносит от них продукты жизнедеятельности. Состав крови свидетельствует о нормальных процессах, а также о патологии, имеющей место в организме. Кровь, как внутренняя среда, осуществляет связь между всеми органами и тканями, создает оптимальный режим их существования. Функции крови разнообразные, главные из них: 1 .Транспортная – транспорт кислорода к тканям, углекислого газа от тканей к легким, транспорт питательных веществ и удаление из тканей конечных продуктов обмена. 2. Регуляторная – поддерживает постоянство рН и осмотического давления, доставляет к тканям гормоны. 3. Защитная – антитела, лейкоциты, содержащиеся в крови, связывают возбудителей болезней и продукты их жизнедеятельности, предохраняют организм от заболевания. Кровь способна свертываться, тем самым, защищая организм от кровотечения и кровопотерь при повреждении сосудов и ранах. Кровообращение, процессы кроветворения, химический состав крови регулируются центральной нервной системой. Исследования крови являются важным методом диагностики инфекционных и других заболеваний. Количество крови в % к общей массе тела у лошади – 9,8%, коровы – 8,8%, овец – 8,0%, коз – 6,2%, кур – 8,1%, морских свинок – 4,1%. Кровь состоит из плазмы – 55-60% и форменных элементов: эритроцитов – 39-44%, лейкоцитов – 1%, тромбоцитов – 0,1%. Форменные элементы при стоянии оседают, а при центрифугировании этот процесс ускоряется. В клинике широко применяется показатель РОЭ (СОЭ) – реакция (скорость) оседания эритроцитов, которая измеряется в мм/час. Для каждого вида животных величина РОЭ постоянная и составляет в норме у лошади 64, у свиньи – 30, коровы – 0,58, кролика – 1,5, собаки – 2,5. Скорость РОЭ увеличивается при патологии, показатель имеет большое значение в клинике. Физико-химические свойства крови Плотность цельной крови – 1,050-1,060. Форменные элементы имеют большую плотность - до 1,090, чем плазма – 1,025-1,030. В связи с этим форменные элементы при стоянии оседают (РОЭ). Вязкость крови в 4,5-6,0 раз, сыворотки в 1,5-2,0 раза больше вязкости воды. Она зависит от концентрации в крови белков, форменных элементов. Так, при недостатке воды, продолжительной тяжелой работе, при поносах, рвоте в крови уменьшается количество воды и повышается ее вязкость, затрудняется продвижение крови по сосудам. Это приводит к обезвоживанию организма, что опасно для жизни. Например, у новорожденных телят диарея, как следствие нарушения питания (холодное молоко, молозиво), авитаминоза (витамин А – кишечный эпителий), повреждения эпителия слизистой (размножение вирусов – короно, рото, энтеровирусов, бактерий – энтеропатогенной кишечной палочки), приводит к поносам, обезвоживанию организма, и телята погибают. В качестве лечебного воздействия вводят физиологический раствор, чтобы сохранить нормальную вязкость крови. Вязкость крови во многом зависит от количества эритроцитов. Например:
карбоната в 6 раз выше, чем в воде. При различных заболеваниях коллоидная устойчивость крови уменьшается и многие вещества, как известковые соли, холестерол, мочевая кислота и др., выпадают в осадок, откладываются в тканях и органах (известковые соли – в суставах, холестерол – на внутренней поверхности сосудов, мочевая кислота – в виде мочевых камней, желчные кислоты – в виде желчныхкамней). Осмотическое давление крови зависит от количества электролитов, белков и других растворенных веществ. На осмотическое давление крови наибольшее влияние оказывает концентрация NaCl. Общее осмотическое давление равно 7-8 атм, или в единицах депрессии ∆t = 0,56-0,63. Постоянство осмотического давления поддерживается поступлением и удалением из крови воды и электролитов. Особенно большую роль в этом играют органы: почки, потовые железы. С мочой удаляется избыток минеральных солей. Осмотическое давление мочи всегда выше, чем крови. Только при тяжелых нарушениях функции почек осмотическое давление мочи может снижаться. Потовые железы удаляют в основном воду, поэтому осмотическое давление пота всегда ниже, чем в крови. Избыточное количество солей всегда довольно быстро удаляется из организма. Поэтому даже при большом поступлении минеральных солей они быстро удаляются, и осмотическое давление крови быстро возвращается к норме. Регуляция осмотического давления имеет большое значение для функционирования клеток и тканей, прежде всего эритроцитов. Эритроциты могут функционировать только при определенном осмотическом давлении окружающей их плазмы. Если осмотическое давление плазмы уменьшается, то эритроциты набухают (эндоосмос) и происходит их гемолиз. Если осмотическое давление плазмы выше нормы, то это приводит к плазмолизу эритроцитов. Как гемолиз, так и плазмолиз, нежелательны для организма, т.к. при этом эритроциты теряют способность транспортировать кислород. Поэтому жидкости для внутривенных вливаний должны быть изотоничными (0,9% NaCl или 5,4% глюкозы). Белки крови играют важную роль в создании осмотического давления. Давление, которое создается белками, называют онкотическим или коллоидноосмотическим. Кровь содержит много белков и благодаря этому имеет высокую диэлектрическую постоянную, и как следствие, – обладает высокой растворяющей способностью. Белки проявляют свойства коллоидной защиты по отношению к веществам, находящимся в плазме, трудно растворимым, удерживая их в растворенном состоянии. Так, например, в крови растворимость фосфорного кальция в 2 раза, а Онкотическое давление обеспечивает более высокое давление в крови, чем в межклеточном пространстве, что препятствует выходу воды из сосудов в ткани и регулирует водный обмен между кровью и тканями. Буферные системы крови Биохимические процессы в организме животных могут происходить только при строго определенных значениях рН. Даже незначительное изменение рН среды вызывает изменение активности ферментов и нарушение течения биохимических процессов. Смещение рН крови на 0,5 единицы приводит к агонии. Допустимые физиологические колебания рН крови не выше 0,05-0,07 единицы. В процессе жизнедеятельности постоянно образуются промежуточные продукты окисления, в том числе значительное количество CO2. Из пищеварительного тракта всасываются органические кислоты, продукты брожения углеводов. Много кислот образуется в тканях в результате распада и окисления фосфорных эфиров и углеводов, нуклеотидов и других фосфор- и серосодержащих соединений с образованием соответственно H3PO4, H2SO4 . Усиленное образование кислых продуктов происходит при нарушении углеводного, липидного и белкового обмена, когда в крови в больших количествах появляются кетоновые тела (ацетоуксусная и β-оксимасляная кислоты, ацетон). Постоянно образуются также соединения, имеющие щелочную природу: аммиак, креатин, основные аминокислоты и т.д. Однако кислоты и основания, попадая в кровь, не изменяют рН крови благодаря наличию регуляторных механизмов – буферных систем крови и органов выделения. Сила буферных систем крови (буферная емкость) весьма велика. Например, для смещения рН крови к ней нужно добавить в 320 раз больше кислоты, чем к такому же количеству воды. В крови имеются как органические, так и минеральные буферные системы. К органическим буферным системам относятся: гемоглобиновый-оксигемоглобиновый буфер эритроцитов, белки плазмы крови, аминокислоты, органические кислоты и их соли. К минеральным буферным системам относятся гидрокарбонатный и фосфатный буферы. Гидрокарбонатная буферная система крови состоит из (в соотношении объем % CO2): CO2 – 2,7; H2CO3 – 1; NaHCO3 – 47; Na2CO3 – следы. Образующиеся в процессе обмена кислоты взаимодействуют с гидрокарбонатом натрия, и в результате образуются соли, а протон водорода связывается с анионом гидрокарбоната, в результате образуется слабо диссоциирующая угольная кислота H2CO3. В легких она разлагается на H2O и CO2. CO2 удаляется из организма с выдыхаемым воздухом: 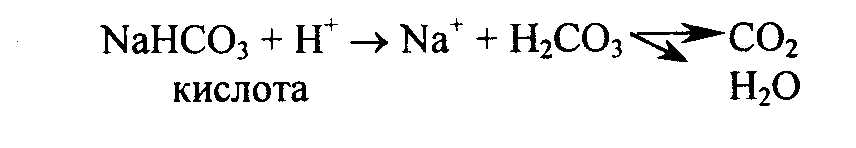 Второй компонент гидрокарбонатной буферной системы – H2CO3 будет нейтрализовать анионы гидроксила в случае защелачивания: 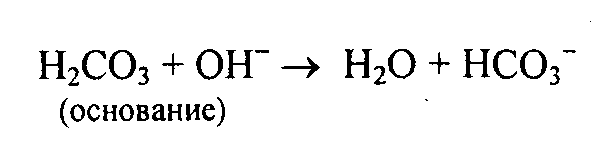 Для поддержания постоянства рН крови необходим определенный запас гидрокарбоната и других веществ, определяющих щелочной резерв. Щелочной резерв определяют по методу Ван-Слайка, и выражают количеством выделившегося CO2 в мл на 100 мл плазмы. Количество выделившегося СО2 определяют разрушением H2CO3 более сильной кислотой. При этом выделяется CO2 в норме в %: у лошади 56-80, крупного рогатого скота – 50-67%. Резервную щелочность можно выражать также кислотной емкостью, т.е. количеством щелочи в мг, идущей на титрование избытка кислоты, которую добавляют к крови (расчет ведется на 100 мл крови, выражается в мг% щелочи). Кислотная емкость в мг% составляет в норме: у лошади – 420-640; коров – 540-600; овец – 440-540; свиней – 450-660. Понижение щелочного резерва – ацидоз наблюдается при кетозах, сердечной недостаточности, рахите и т.д. Ацидоз может быть компенсированным, если нет изменений в рН крови. Если же кислот много и они не могут быть нейтрализованы буферными системами, то рН крови смещается в кислую сторону. Алкалоз – наблюдается при повышенном содержании гидрокарбонатов, избыток которых выделяется с мочой: при рвоте, гипервентиляции легких, отравлении окисью углерода. Неорганический фосфатный буфер имеет большое значение в клетках, а в крови занимает незначительное место, т.к. количество неорганических фосфатов крови составляет 3-4 мг%. Органические фосфаты играют большую роль в создании буферной емкости крови. Буферное действие белков плазмы занимает 10%, гемоглобин эритроцитов обеспечивает 70% буферной емкости крови. Действие гемоглобина как буфера тесно связано с его функцией в процессе дыхания. Гемоглобин не только выполняет роль переносчика кислорода, но и оказывает существенное влияние на связывание СО2 в тканях и выделение его в легких. Основное количество углекислоты переносится из тканей в легкие при участии катионов эритроцитов (калий), связанных с гемоглобином. Кроме того, углекислота может присоединяться к гемоглобину непосредственно через свободные аминогруппы при помощи карбаминовой связи, при этом образуется карбгемоглобин. Считают, что 15% СО2 переносится в легкие в виде карбгемоглобина. Плазма крови и ее химический состав После удаления из крови форменных элементов остается плазма. В обычных условиях, вне организма, плазма свертывается. После удаления из плазмы фибриногена остается сыворотка крови. Для предотвращения свертывания крови добавляют стабилизаторы (соль лимонной или щавелевой кислоты, гепарин). Плазма составляет около 55-60% объема крови. В ее составе 90-96% воды, 4-10% сухих веществ, в т. ч. органические вещества: белковые – альбумины, глобулины, фибриноген, ферменты; небелковые – пептиды, аминокислоты, мочевина, мочевая кислота, аллантоин, креатинин, билирубин, амиды, минеральные вещества (около 1%), гормоны, витамины; безазотистые вещества – глюкоза, молочная кислота, жирные кислоты, глицерин, триглицериды, холестерин, промежуточные продукты их обмена. Минеральные вещества плазмы: NaCl, KCl, CaCl2, MgCl2, NaHCO3, CaCO3, K2HPO4, Na2SO4, Са3(РО4)2. Кроме того, в небольших количествах содержатся ионы железа, меди, йода, цинка, кобальта, марганца и т.д. Минеральные вещества могут находиться в ионо- и молекулярно-дисперсном состоянии, а также могут входить в состав сложных органических соединений. Считают, что в обменных процессах наиболее активны минеральные вещества, связанные с белками крови. Содержание ионов (катионов и анионов) в плазме крови, мг% у лошади составляет следующие величины:
Роль солей щелочных и щелочноземельных металлов в крови разнообразна. Они участвуют в создании осмотического давления, состояния изотонии с внутриклеточным содержимым различных тканей. Отдельные ионы имеют специфические функции. Ионы Na+ повышают набухание тканей и увеличивают их проницаемость. Ионы Са++ действуют противоположно: уплотняют протоплазму клетки, уменьшают ее проницаемость. Ионы Mg++ вызывают анестезию. Катионы крови влияют на активность многих ферментов. Содержание кальция и фосфора изменяется при рахите, остеомаляции, тетании и других нарушениях минерального обмена. Железо сосредоточено в эритроцитах. В плазме – в составе трансферрина. Железо депонируется в виде ферритина. Избыток железа откладывается в форме гемосидерина в клетках ретикулоэндотелиальной системы. Белки плазмы и сыворотки крови Плазма содержит 2,5-8,0% белка, в том числе фибриногена – 0,5%. У разных видов животных содержание белка в плазме составляет следующие величины, в %: куры – 5,2; кролики – 7,1; коровы – 7,5; лошади – 7,8; свиньи – 7,4. Содержание белка в сыворотке крови колеблется в зависимости от возраста, пола, продуктивности. Снижение содержания белка – гипопротеинемия наблюдается при белковом голодании, при приеме больших количеств жидкости, нарушении функции почек, печени, неполноценном белковом питании, повышенном распаде белков. При сильных поносах и рвоте концентрация белков в крови повышается (гиперпротеинемия). При электрофорезе в полиакриламидном геле белки крови можно разделить до 30 и более фракций. Альбумины имеют повышенную электрофоретическую подвижность, хорошо растворимы в воде, на 98% состоят из аминокислот. Изоэлектрическая точка при рН 4,9; М.м. 65000-70000 Да; период полураспада 3,7 суток. В крови 30-55% белков – альбумины. Синтезируются в основном в клетках печени. Они участвуют в регуляции водно-солевого обмена между кровью и тканями. Альбумины можно рассматривать как аминокислотный резерв организма. Кроме того, они адсорбируют аминокислоты и в таком виде транспортируют их в ткани. Альбумины могут образовывать различные комплексы с металлами, гормонами, витаминами, токсинами, осуществляя их транспорт в организме. В этих комплексах многие биологически активные вещества теряют свою активность или, наоборот, усиливают, т.е. альбумины регулируют влияние их на метаболические процессы. Выступают в виде буферных веществ, поддерживая рН. Глобулины. Различают α, β, γ-глобулины. α-Глобулины при электрофорезе продвигаются за альбуминами, разделяются на несколько фракций (α1, α2, α3 -глобулины). М.м. 160000 - 200000. Изоэлектрическая точка при рН 4,7-5,2. Их функция – белки-переносчики, (легко соединяются с липидами, углеводами, витаминами, желчными пигментами). В их составе 25-35% углеводов. Сюда относится гаптоглобулин – переносчик железа, церулоплазмин – переносчик меди. Церулоплазмин, относящийся к α2-гликопротеидам плазмы крови, играет главную роль в обмене медьсодержащих энзимов. Во фракции α-глобулинов находятся также белки, участвующие в свертывании крови. β-Глобулины. Молекулярная масса 90000-1,Зх106 Да. Изоэлектрическая точка рН 4,4. Образуют комплексы с липидами. К этой группе относится трансферрин. В этой фракции находится белок проконвертин, участвующий в превращении протромбина в тромбин. γ-Глобулины. Наименее подвижная фракция с высокой М.м., выполняют защитные функции. В их составе белки-антитела, обеспечивающие защиту против инфекционных болезней. Иммунные белки – иммуноглобулины (Ig). Содержание иммуноглобулинов резко увеличивается при иммунизации, хронических заболеваниях. Иммуноглобулины синтезируются в лимфоидной ткани селезенки, лимфоузлов, костного мозга и т.д. против чужеродных белков (антигенов). Их молекулярная масса составляет до Ix106 Да и более. Состоят из двух тяжелых полипептидных цепей (H-Heavy, Мм 50-75 кДа) и двух легких цепей L (Light, Мм 23 кДа), соединенных дисульфидными мостиками, (рис. 14.1.). Н-цепи имеют ≈ 700, а L-цепи ≈ 200 аминокислотных остатков. В пептидных цепях различают вариабельные (v) и постоянные константные (с) области. В результате различных сочетаний отдельных участков иммуноглобулинов может образовываться большое число индивидуальных иммуноглобулинов - до 107 . 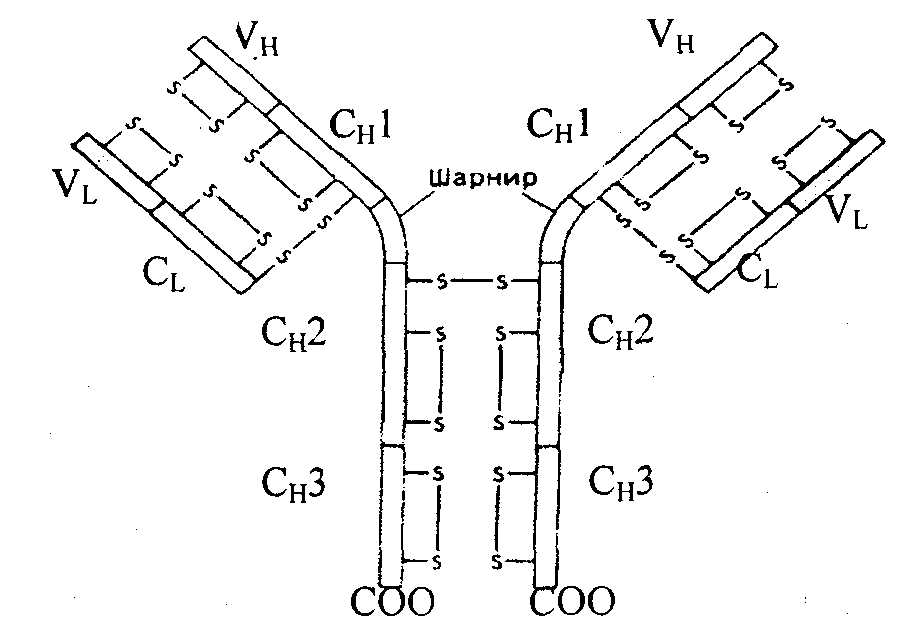 Рис. 14.1. Структура молекулы иммуноглобулина. Две легкие и две тяжелые цепи удерживаются вместе дисульфидными связями. Каждая из легких и тяжелых цепей имеет на своем N- конце вариабельный yчасток (VL или VH). B состав легких цепей входит один константный участок (CL); у тяжелых цепей константная часть состоит из четырех доменов (СН1, СН2, СнЗ и шарнирный участок). Различают иммуноглобулины классов IgG, M, A, D, E. Они различаются по молекулярной массе, по скорости седиментации, концентрации в сыворотке крови и т.д. В сыворотке крови содержатся и другие белки. Например, C-реактивный белок появляется при воспалительных процессах и некрозах. Пропердин и интерферон – защитные белки. Интерферон является универсальным противовирусным белком. Фибриноген и протромбин принимают участие в процессе свертывания крови. В небольших количествах в сыворотки крови содержатся гормоны и ферменты. Металлопротеиды – целый ряд белков крови способных связывать различные металлы, образуя комплексные соединения: церулоплазмин – М.м. 150 кДа, 8 атомов Cu++ , трансферрин, гаптоглобин и другие. Небелковые азотистые вещества крови В плазме крови содержится значительное количество небелковых азотсодержащих веществ, к ним относятся аминокислоты, пептиды, мочевина, мочевая кислота, креатин, креатинин, билирубин и т.д. Все эти вещества называют остаточным азотом, это вещества, остающиеся в растворе после осаждения белков. Количество их в норме составляет 20-65 мг%. При повышении обмена веществ, интенсивной работе количество остаточного азота увеличивается до 100 мг%. Безазотистые органические вещества – глюкоза, липиды, жирные кислоты, пировиноградная кислота, молочная кислота играют роль питательных веществ или являются промежуточными метаболитами. Минеральные вещества содержатся в виде катионов Na+, K+, Ca2+, Mg2+, Cu2+, анионов Cl-, НСОз- и т.д. или же в составе органических соединений. Форменные элементы крови Количество эритроцитов в крови у различных видов животных различно. Отличаются они по содержанию ядра: у птиц и земноводных эритроциты ядерные, а у млекопитающих безъядерные. Основная функция эритроцитов дыхательная, она связана с гемоглобином. Количество эритроцитов составляет у лошади (в млн/мм3) 6-10, коровы – 5,5-10, свиньи – 5,5-9, овцы – 8-16. Содержание гемоглобина составляет 10-15%. Кроме гемоглобина, в эритроцитах содержатся ферменты каталаза, карбоангидраза. Каталаза обеспечивает расщепление перекиси водорода на воду и молекулярный кислород, а карбоангидраза – синтез угольной кислоты из CO2 и H2O в тканевых капиллярах и распад H2CO3 в легочных альвеолах на CO2 и H2O. Таким образом, этот фермент обеспечивает связывание CO2 в тканях и удаление его из крови в альвеолах легких. Выполнение дыхательной функции эритроцитов связано с гемоглобином. Молекула гемоглобина состоит из четырех субъединиц, в том числе два пептида α-цепи из 141 аминокислотного остатка и два пептида β-цепи из 146 аминокислотных остатка. Эти 4 пептида соединены между собой водородными связями (рис.2.8.). В каждом пептиде содержится гем, связанный с двухвалентным железом (рис.2.11.). Строение гемоглобина обеспечивает кооперативное связывание 4-х молекул кислорода (O2): каждый гем присоединяет кислород не самостоятельно, а совместно, кооперативно. Кооперативность состоит в том, что каждую молекулу кислорода гемоглобин присоединяет (и отдает) легче, чем предыдущую. Оксигемоглобин – основное производное гемоглобина, легко диссоциирует на гемоглобин и O2. Скорость прямой и обратной реакций при взаимодействии гемоглобина и O2 зависит от величины парциального давления кислорода в воздухе, с которым контактирует кровь, находясь в капиллярах легочных альвеол. Количество кислорода, связываемого гемоглобином, содержащимся в 100 мл крови, называется кислородной емкостью крови. Для разных животных она составляет 10,1-19,5 мл. Оксигенация гемоглобина (Hb) происходит быстрее, чем распад оксигемоглобина: Hb+ O2 → HbO2 за 0,001 с Hb2 → Hb + O2 за 0,05 с В артериальной крови весь гемоглобин находится в виде оксигемоглобина. Это обеспечивается высоким парциальным давлением кислорода в легких, через которые проходит кровь. Во вдыхаемом воздухе содерится 20,9% кислорода, 0,03% CO2. В выдыхаемом – 15,5-16,3% кислорода и 4,1% CO2, или CO2 в 136 раз больше, чем в атмосфере. В легких создаются условия для диффузии O2 в кровь, CO2 – в воздух. В процессе дыхания организм использует около 5% кислорода, содержащегося в воздухе. Присоединение молекулярного кислорода к гемоглобину не ведет к изменению валентности железа, поэтому этот процесс называется оксигенация, а не окисление. Образуется при оксигенации оксигемоглобин, который в тканях распадается на гемоглобин и O2, после чего O2 усваивается тканями. При уменьшении парциального давления O2 в воздухе количество HbO2 снижается (гипоксемия), что ведет к гипоксии. Гемоглобин участвует в переносе CO2. В межтканевых жидкостях парциальное давление CO2 около 8 кПа (60 мм рт.ст.), в венозной крови – около 6 (47 мм рт ст). Эта разница обеспечивает диффузию CO2 из тканей в венозные сосуды. В крови около 20% CO2 соединяется с гемоглобином, около 80% превращается в гидрокарбонат калия КНСО3. B легких гидрокарбонаты разрушаются до H2CO3 с последующим распадом до H2O и CO2, которые удаляются из организма с выдыхаемым воздухом. Эти процессы катализируются ферментом карбоангидразой. Метгемоглобин Hb-OH образуется под действием различных окислителей, когда Fe++ окисляется до Fe+++ и прочно соединяется с группой ОН. Метгемоглобин не присоединяет кислород. Окислители: метиленовая синь, бензол, нитробензол, анилин. Образование метгемоглобина может привести к смерти. Карбоксигемоглобин – Hb-CO – соединение с угарным газом. Окись углерода СО имеет сродство к Hb в 300 раз больше, чем кислород. Поэтому даже небольшое количество (0,1%) окиси углерода связывает гемоглобин, превращая его в карбоксигемоглобин и приводит к гибели. В карбоксигемоглобине железо остается 2-х валентным. Циангемоглобин – Hb-CN – образуется при попадании в кровь синильной кислоты или ее солей. Это ведет к потере способности гемоглобина связывать кислород. Распад гемоглобина происходит в селезенке, печени, костном мозге. Глобин распадается до аминокислот, а гем превращается в желчные пигменты: биливердин, билирубин, которые далее удаляются из организма с калом (стеркобилин) или с мочей (уробилин). Лейкоциты – белые клетки крови, выполняют защитные функции, являются продуцентами иммуноглобулинов. Они могут захватывать и переваривать чужеродные тела, попавшие в организм (фагоцитоз). Тромбоциты – кровяные пластинки, участвуют в процессе свертывания крови. На их поверхности адсорбируются факторы свертывания крови. В первой фазе свертывания крови с участием тромбокиназы и ионов кальция из протромбина образуется тромбин, а во второй фазе под действием фермента тромбина, фибриногена превращается в фибрин. Лимфа – прозрачная жидкость, содержится в лимфатических сосудах и межклеточном пространстве. По химическому составу близок к плазме крови, отличается лишь более низким содержанием белков. 15. БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ Мышечная ткань составляет 40-45 % от массы тела животного. Основная функция мышц – сокращение и расслабление. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую. Обычно различают три типа мышечной ткани: скелетную мускулатуру, сердечную мышцу и гладкую мускулатуру. Особенно развиты и дифференцированы скелетные мышцы, они обеспечивают произвольные движения организма, работу легких и других органов. Сердечная мышца обеспечивает кровообращение, гладкие мышцы, расположенные в стенках внутренних органов, выполняют ряд важных физиологических функций: передвижение химуса, выделение пищеварительных соков, поддержание тонуса сосудов и т.д. Усиление мышечной работы всегда сопровождается усилением кровоснабжения мышц и интенсификацией обмена веществ в них. Основной морфологический элемент скелетной мышцы – мышечное волокно, которое имеет характерную поперечную исчерченность. Мышечное волокно – это гигантская многоядерная клетка, покрытая плотной эластичной оболочкой – сарколеммой. Длина мышечного волокна от нескольких мм до десятков см, часто соответствует длине мышцы. Вдоль мышечного волокна, под сарколеммой, расположены пучки миофибрилл. Миофибриллы окружены саркоплазмой, в которой находятся также ядра, митохондрии и различные гранулы. Мышечные волокна имеют очень много митохондрий, развитую эндоплазматическую сеть. Это обеспечивает доставку в клетки энергетических материалов и удаление из клетки продуктов обмена веществ. Белки мышечной ткани были предметом изучения многих ученых (А.Я. Данилевский, А.Сент-Дьерри, B.C. Гулевич, C.E. Северин и др.). В.А. Энгельгардт выявил ферментативный распад АТФ и роль в этом процессе мышечных белков, использующих энергию АТФ при сокращении мышечного волокна. Содержание воды в мышечной ткани составляет 70-80 %, плотный остаток – 20-30 %. Плотный остаток (сухое вещество) состоит из органических и минеральных веществ. Минеральные вещества: катионы K+, Na+, Ca+, Mg+; анионы хлора, фосфорной кислоты, серной кислоты и т.д. в мышцах находятся в свободном виде и в соединении с белками и другими органическими веществами. Мышечные волокна – миофибриллы построены из белковых нитей двух типов – толстых и тонких. Основным белком толстых нитей является миозин, а тонких – актин. Миозиновые и актиновые нити – главный компонент всех сократительных систем. Миозиновые нити образованы белком миозином. Миозин составляет почти половину всех белков скелетной мышцы. Молекула миозина содержит две тяжелые полипептидные цепи с Мм 200000 Да каждой и четыре легкие цепи с Мм 20000 Да. Каждая тяжелая цепь на большей части с С-конца имеет конформацию α-спирали, и обе спирали скручены друг с другом. Противоположные концы каждой цепи (N-концы) имеют глобулярную форму, образуя «головки» молекулы. К каждой из головок присоединены по 2 легкие цепи (рис 15.1.). Миозин катализирует гидролиз АТФ. Энергия гидролиза используется для сокращения мышцы. Палочкообразные хвосты молекул миозина могут соединяться друг с другом продольно, образуя пучки. Головки выступают на поверхности пучка. Так образуется миозиновые нити саркомера, каждая из которых соединяет около 400 молекул миозина. Актиновые нити – построены из белков актина, тропомиозина и тропонина. Основу нитей составляют молекулы актина. Актин глобулярный белок с Мм 43000 Да, молекулы соединясь, образуют фибриллярный актин (F-актин). Молекулы F-актина скручены друг с другом (рис. 15.1.). К F-актину могут присоединяться головки миозина, в результате такого взаимодействия многократно увеличивается АТФ-азная активность миозина. Соединения F-актина с миозином называют актомиозином. 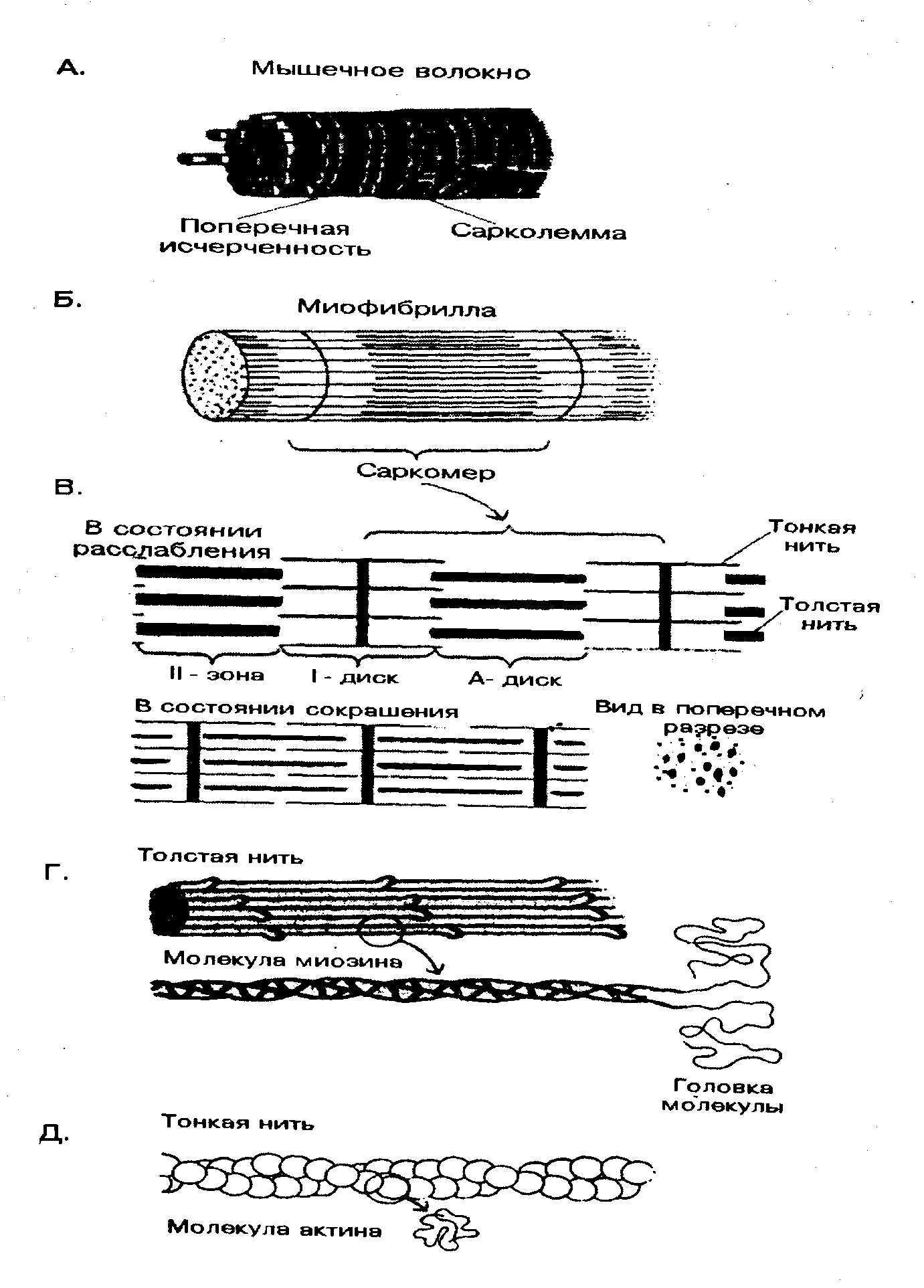 Рис. 15.1. А - мышечное волокно. Б - миофибриллы. В - саркомер в состоянии сокращения и расслабления. Г - молекула миозина. Д -молекула актина Тропомиозин – белок актиновых нитей имеет форму палочек длиной 40 нм. Они расположены вдоль ленты F-актина, причем каждая молекула тропомиозина соединена с семью молекулами G-(глобулярного) актина. Тропонин – белок актиновых нитей, имеет глобулярную форму, построен из нескольких субъединиц, связан с тропомиозином и с актином. Одна из субъединиц тропонина содержит кальций-связывающие центры и по структуре сходна с кальмодулином. Содержание миозина, актина, тропомиозина и тропонина в миофибриллах составляет 55, 25, 15 и 5 % соответственно Механизм сокращения мышцы Сокращение мышц – это результат укорочения каждого ее саркомера, которое происходит путем вдвигания актиновых нитей между миозиновыми нитями. Различают L (изотропный) диск, образованный нитями миозина. Повторяющиеся участки миофибрилл между двумя L-дисками называют саркомерами, их длина 2,5 мкм. При сокращении каждый саркомер укорачивается на 20-50 %, причем это сокращение происходит за счет параллельного скольжения тонких (актин) и толстых (миозин) нитей относительно друг друга. Скольжение нитей актина и миозина друг относительно друга сопровождается поочередным образованием и разрушением поперечных мостиков между этими нитями за счет конформационных изменений в нитях миозина. Химическим пусковым механизмом к началу сокращения служит выход катионов кальция Са++ из цистерн. В результате ионы кальция специфически стимулируют Са2+-зависимую АТФ- азную активность актомиозина, в возбужденной мышце происходит распад АТФ на АДФ и неорганический фосфат с освобождением энергии, которая используется для сокращения саркомера. Сигналом для выхода ионов Са++ из цистерн в саркоплазму служит электрический импульс, приходящий из двигательного нерва через моторную пластинку. Такой импульс приводит к разрядке трансмембранного потенциала мышечных волокон. При этом резко увеличивается проницаемость мембран (Т-система) и ионы Ca2+ выходят из цистерн, создавая условия реакции сокращения. С прекращением электрического импульса ионы кальция под действием кальциевого насоса вновь поглощаются Т-системой. Источником энергии для мышечного сокращения является АТФ. Для сохранения работоспособности должен происходить постоянный ресинтез АТФ. Одним из основных источников ресинтеза АТФ является гликоген мышц. В процессе гликолиза гликоген превращается в молочную кислоту, а энергия, освобождающаяся при этом, идет на синтез АТФ. В мышцах кроме АТФ имеется и другой макроэрг – креатинфосфат, концентрация которого в 4-5 раз больше, чем АТФ. Продолжительная работа мышц приводит к истощению запасов креатинфосфата и в этих условиях ресинтез АТФ из АДФ может идти за счет гликолиза и тканевого дыхания. При высокой мышечной активности для получения энергии используется главным образом глюкоза. Переход мышц из покоя к работе ведет к увеличению потребления кислорода в ней в 20 раз и более. Одновременно уменьшается отношение АТФ:АДФ, что приводит к активации фосфофруктокиназы и ферментов цикла трикарбоновых кислот. АДФ может также вступать в реакцию перефосфорилирования друг с другом: АДФ + АДФ => АТФ + АМФ Это является дополнительным механизмом ресинтеза АТФ. В период покоя в мышцах происходит накопление креатинфосфата: АТФ + креатин => креатинфосфат + АДФ Повышенная нагрузка на мышцы (быстрый бег, поднятие больших грузов) сопровождается учащением дыхания вследствие усиления гликолиза, что приводит к накоплению молочной кислоты в ткани. Молочная кислота используется затем для ресинтеза гликогена в печени и мышечной ткани (гликонеогенез). Азотистые экстрактивные вещества мышц Это - вещества, извлекаемые из мышц при настаивании с водой, содержание их по азоту составляет 300-500 мг %. К ним относятся: креатин, карнозин, ансерин, карнитин, глутаминовая кислота, глутамин, аминокислоты, мочевина, пептиды, АТФ. Среди небелковых азотистых веществ самое высокое содержание креатина – 60 % всего небелкового азота мышц. Креатин образуется из глицина, аргинина, метионина. Его образование начинается в печени. Мышцы адсорбируют креатин из крови и удерживают в значительных количествах. Более половины креатина находится в виде креатинфосфата, образующегося в результате реакции трансфосфорилирования между креатином и АТФ. Креатинфосфорная кислота является дополнительным резервом энергии. Она запасается в покоящейся мышце и интенсивно используется для синтеза АТФ в работающей мышце. Передавая неорганический фосфат на АДФ, креатин необратимо превращается в креатинин, удаляемый из организма с мочой. Синтез креатина происходит из аргинина, глицина и метионина: 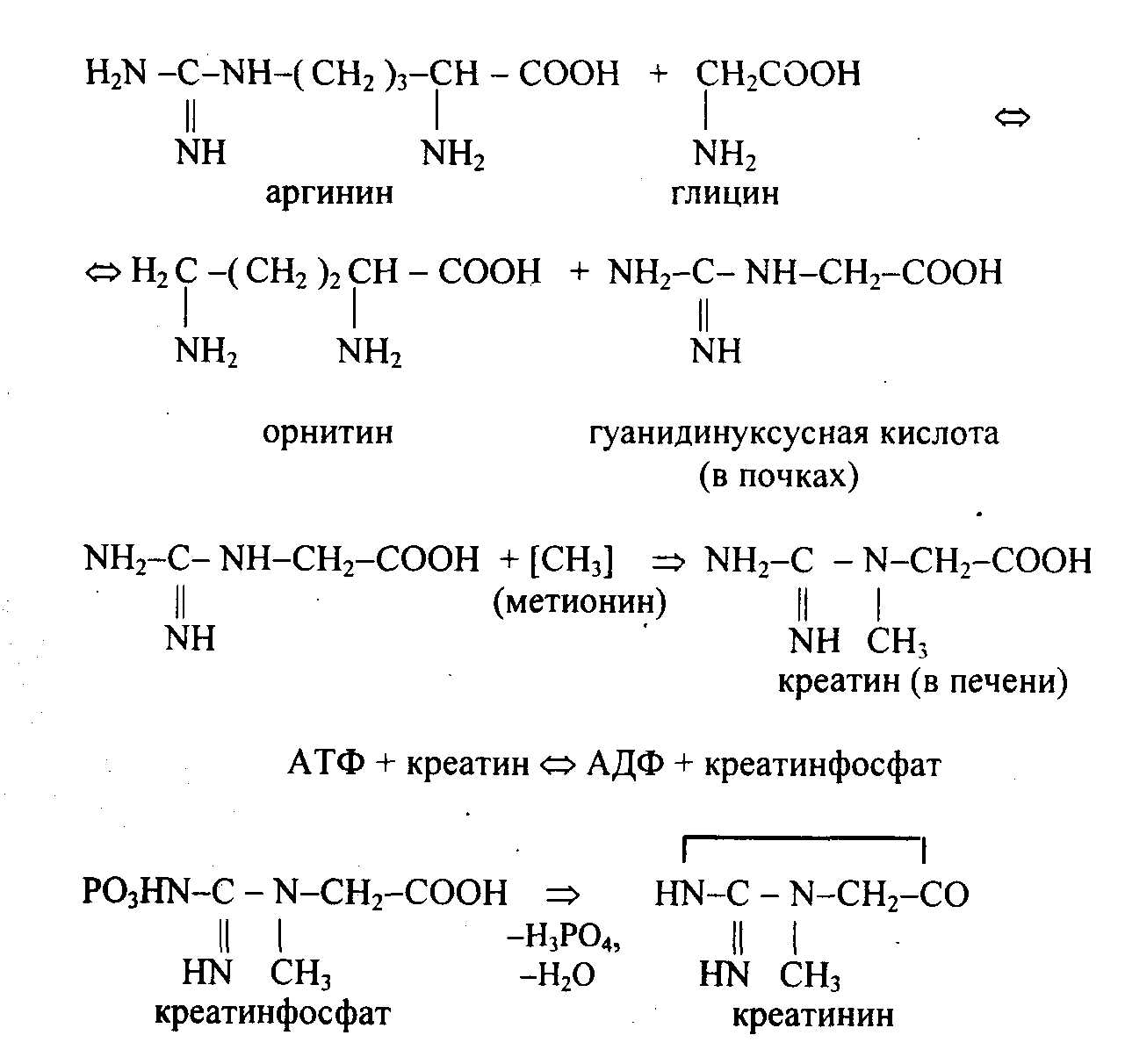 При болезнях мышц увеличивается концентрация креатина в крови и выделение его с мочой. Суточное выделение креатина в норме величина постоянная. Содержание его в крови в норме 1-2 мг/дл. При болезнях почек с нарушением фильтрации выделение креатина уменьшается, а его концентрация в крови увеличивается. К специфическим азотистым экстрактивным веществам скелетных мышц относятся карнозин, ансерин, карнитин. 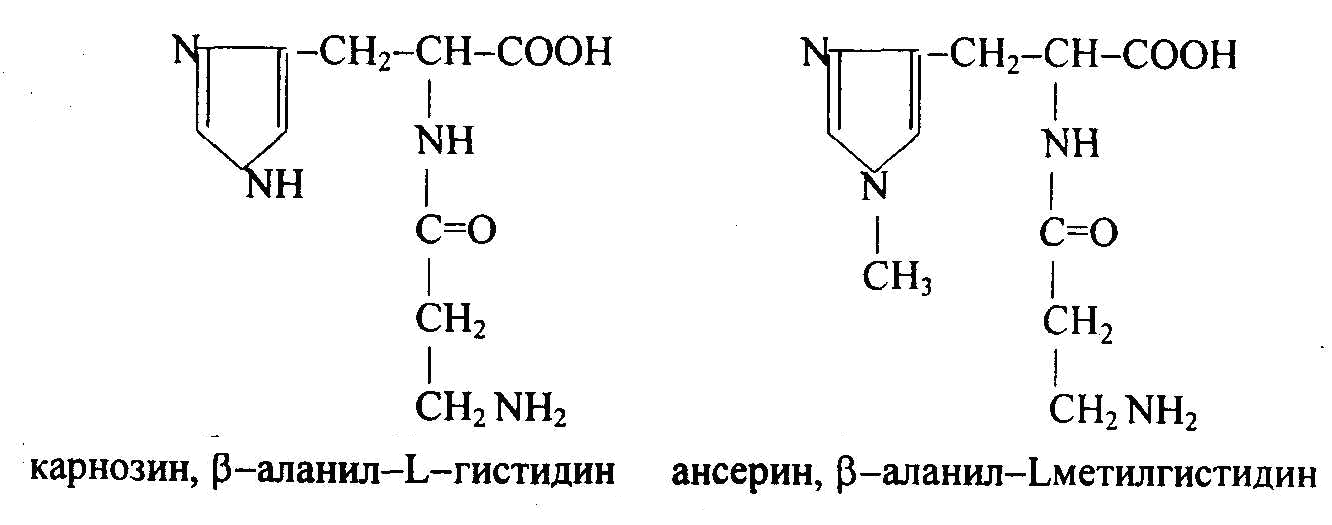 Дипептиды карнозин и ансерин были открыты А.С. Гуливичем и его сотрудниками в 1900 г; эти пептиды в больших количествах содержатся в белых мышцах (0,2-0,3 %). Е.С. Северин показал, что они увеличивают амплитуду мышечного сокращения, создают буферную емкость быстрых мышц, являются антиоксидантами, комплексонами металлов, защитными веществами, предотвращающими модификацию белков. Карнозин оказывает защитное действие на ряд ферментов и ферментных комплексов, а также на ионные насосы, является гидрофильным антиоксидантом, понижает в клетках уровень свободных радикалов. Карнитин участвует в транспорте жирных кислот через мембрану митохондрий, тем самым, ускоряя использование жирных кислот для синтеза АТФ в работающей мышце. Глутаминовая кислота и глутамин (150-200 мг %) играют важную роль в обезвреживании аммиака, образующегося во время мышечной работы. Минеральные вещества Суммарное содержание их 1-1,5 %. Качественный состав мало отличается от других тканей. Большинство ионов двухвалентных металлов (Са2+, Mg2+) находится в осмотическом недеятельном состоянии, т.е. относительно прочно соединены с белками: около 60 % Ca2+ соединено с актином, 30 % – с миозином. Считают, что ионы Mg++ притягивают к себе АТФ, делают доступной для воздействия фермента. Окоченение мышц После наступления смерти прекращается кровообращение, замедляется и прекращается удаление продуктов распада. рН среды становится кислой, мышцы затвердевают и укорачиваются. Развивается трупное окоченение. Оно может наступить через несколько минут или часов после клинической смерти. Его скорость зависит от наличия в ткани гликогена, молочной кислоты, рН, окружающей температуры. В ткани резко уменьшаются запасы гликогена, АТФ, креатинфосфата, глюкозы, возрастает содержание молочной кислоты и фосфатов, происходит коагуляция белков. Через некоторое время окоченение мышц прекращается, и они становятся мягкими. 16. БИОХИМИЯ МОЛОКА И МОЛОКООБРАЗОВАНИЯ Молоко – ценнейший продукт питания человека и животных. Белки, углеводы и липиды молока практически полностью усваиваются организмом. Люди используют в основном молоко коров, реже – других животных. Молоко является секретом молочной железы. Оно состоит из плазмы и жировых шариков. Плотность молока 1,027-1,033. Температура замерзания составляет 0,54 0C, реакция среды рН 6,5-7,0. Химический состав молока у разных животных представлен в таблице 16.1.(по А.И.Иващуре.) Таблица 16.1. Химический состав молока сельскохозяйственных животных (%),
Содержание воды в молоке составляет около 90%, белка – 2,9-5,0%, жира – 3,5-7 %, молочного сахара – 2,5-6,5%, минеральных веществ – около 1,5%, всего в молоке содержатся около 200 различных компонентов, в т.ч. витамины, ферменты, гормоны и т.д. Состав молока зависит от вида животного, породы, возраста, периода лактации, условий кормления. Молоко, секретируемое в первые дни лактации называется молозивом. Оно содержит много белка – до 18%, в том числе иммуноглобулины. Белка в молоке коров может быть до 4,0%. Основная масса молочных белков это казеины, они составляют до 80% белков молока. Они относятся к фосфопротеидам. Известно содержание 4 типов казеинов α-, β, γ, к-казеинов в соотношении 50:30:5:15% от общего количества казеина. Разные типы казеина отличаются между собой по молекулярной массе, количеству фосфорной кислоты, а к-казеин содержит и углеводы (глюкозамин, сиаловую кислоту). Молекулы казеина имеют глобулярную форму и образуют мицеллы. Каждая мицелла содержит в себе все виды казеина и состоит из 7000-8000 полипептидов, соединенных между собой ионами кальция Ca2+. Фермент реннин (сычужный фермент) разрушает мицеллу и происходит створаживание молока. При этом казеин с ионами кальция образует нерастворимый осадок. Казеин содержит полный набор аминокислот – является полноценным белком. Содержание фосфора составляет 0,1-1,0%, кальция тоже много, поэтому является ценным продуктом для растущего организма. Синтез казеина происходит в молочной железе. β-Лактоглобулины – белки с Мм 150000-106 Да составляют 0,2-0,32%. Содержат много сульфгидрильных групп. При нагревании молока часть SH-групп отщепляется в виде SH2, что дает кипяченому молоку специфический запах. Синтез этих белков происходит в молочной железе. α-Лактоглобулины – белки с Мм 16500, ИЭТ = 5,1, составляют 0,18-0,22%, по составу похожи на сывороточный альбумин. Глобулины составляют до 3,0% от общего белка молока, 0,1-0,15%, синтезируются в лимфоидных системах. Кроме указанных белков в молоке содержатся продукты распада белков – полипептиды, свободные аминокислоты. Углеводы молока – лактоза – дисахарид, состоящий из галактозы и глюкозы, в молоке коров содержится около 5%. Синтез лактозы происходит в молочной железе из глюкозы под действием ферментов лактоза-синтетаз. Жиры молока имеют сложный состав. В триглициридах обнаруживается 15 различных жирных кислот; из общего количества жирных кислот молока около половины приходится на ненасыщенные жирные кислоты пальмитиновую и олеиновую. Синтез молочного жира происходит в молочной железе из глюкозы. Кроме нейтральных жиров, в молоке имеются фосфолипиды, стериды, витамины, растворимые в жирах (А, D, E, F) и в воде (Вь B2, B3, B5, B6, B12, С и др.). Минеральные вещества составляют 0,7-1%, они находятся в свободном или связанном состоянии. В молоке содержатся практически все минеральные вещества, входящие в состав крови, в наибольшем количестве хлориды, фосфаты, цитраты, гидрокарбонаты, сульфат натрия. Питательная ценность молока у различных животных зависит от концентрации белков, липидов, углеводов и минеральных веществ и направлена на удовлетворение потребности роста и развития потомства. В таблице 16.2. представлена зависимость между скоростью роста новорожденных и концентрацией питательных веществ (по Чечеткину А.В.). Таблица 16.2. Зависимость между ростом новорожденных и содержанием в молоке белков, минеральных веществ и жира
Из таблицы видно, что рост новорожденных находится в прямой зависимости от концентрации белка, липидов и минеральных веществ. Изучение содержания жира и белкового состава молока – важный критерий в племенной работе в животноводстве в последние годы. Одним из методических приемов является электрофоретическое разделение казеинов в полиакриламидном геле, что позволяет в дальнейшем вести селекционную работу по полиморфизму молочных белков с учетом выявленных генотипов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
