биохимия хазипов. Биохимия животных Электронный дидактический комплекс (эдк)
 Скачать 14.38 Mb. Скачать 14.38 Mb.
|
Метод молекулярной гибридизацииМетод молекулярной гибридизации (ДНК-гибридизация, ДНК-зонды) широко применяется для диагностики инфекционных болезней, в генетике, криминалистике и т.д. Метод основан на уникальном свойстве генетического материала организма – молекулы ДНК –, состоящей из мононуклеотидов, образовывать двойную спираль с комплементарно соединенными азотистыми основаниями. Известно, что молекула ДНК представляет полимер, состоящий из четырех видов дезоксирибонуклеотидов (dAMP, dGMP, dTMP, dCMP), соединенных между собой 3'- и 5'-фосфодиэфирными связями дезоксирибоз. Молекула ДНК образует двойную спираль, при которой азотистые основания первой цепи строго комплементарно соединяются водородными связями с азотистыми основаниями второй цепи, при этом аденин соединяется с тимином, гуанин с цитозином. Принцип метода Структуру двойной спирали ДНК (или РНК), скрепленную водородными связями, можно разрушить нагреванием, поскольку спаренные, не связанные между собой ковалентно, две полинуклеотидные цепи ДНК после разрыва всех водородных связей полностью разделяются. Процесс разделения цепей называют денатурацией или плавлением ДНК. Денатурация происходит в узком интервале температур и сопровождается гиперхромным эффектом, т.е. при этом происходит возрастание поглощения ультрафиолетовых лучей. Температуру, при которой происходит разделение цепей ДНК, называют точкой плавления (Т пл.), которая в зависимости от состава ДНК имеет величину примерно 85-95о C. Процесс денатурации ДНК обратимый, т.е. при снижении температуры происходит восстановление водородных связей – отжиг – образование двойной спирали. Это явление называют ренатурацией (рис. 12.2.). Ренатурация связана со специфичностью спаривания азотистых оснований между комплементарными цепями. Реакция происходит в две стадии: вначале короткие комплементарные последовательности двух цепей случайно соединяются друг с другом и образуют двухспиральный участок, затем образуется длинная двухцепочечная структура с восстановлением первоначальных свойств, утраченных при денатурации. В ренатурации участвуют две комплементарные последовательности. Если при этом взяты цепочки молекулы ДНК из различных источников, то говорят о гибридизации, например при отжиге ДНК и РНК. В основе гибридизации лежит тот же принцип спаривания комплементарных оснований, который обеспечивает репликацию ДНК или ренатурацию молекул. Способность к гибридизации двух препаратов нуклеиновых кислот является строгим тестом на комплементарность их последовательностей. 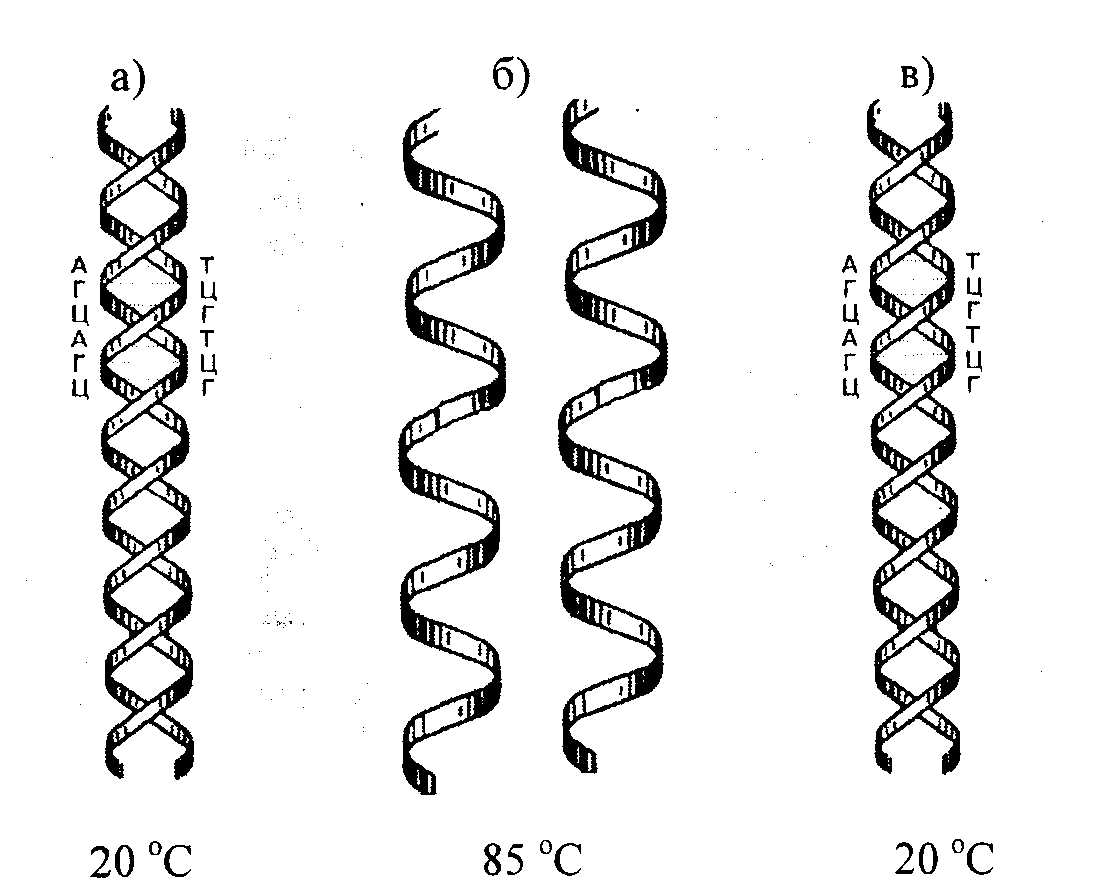 Рис. 12.2. Схема денатурации и ренатурации ДНК; двойная спираль образуется по принципу комплементарности азотистых оснований. а) нативная молекула ДНК, б) денатурированная молекула ДНК, в) ренатурированная молекула ДНК. Способы гибридизации Гибридизацию можно осуществлять в растворе или на фильтре (капроновом или нитроцеллюлозном). При гибридизации молекул в растворе препараты (одноцепочечные молекулы) смешивают и определяют образование двухцепочечных молекул при отжиге по изменению гиперхромного эффекта или же по количеству метки в двухцепочечной ДНК (для этого один из препаратов ДНК предварительно метят радиоактивным изотопом). Удобным для работы является метод гибридизации с использованием фильтров. При этом один из препаратов ДНК иммобилизуют на нитроцеллюлозных фильтрах, на которых молекула ДНК адсорбируется. Фильтры с адсорбированной одноцепочечной ДНК обрабатывают таким образом, чтобы предотвратить дальнейшую адсорбцию одноцепочечных молекул. На рис. 12.3. показана схема гибридизации на фильтре. 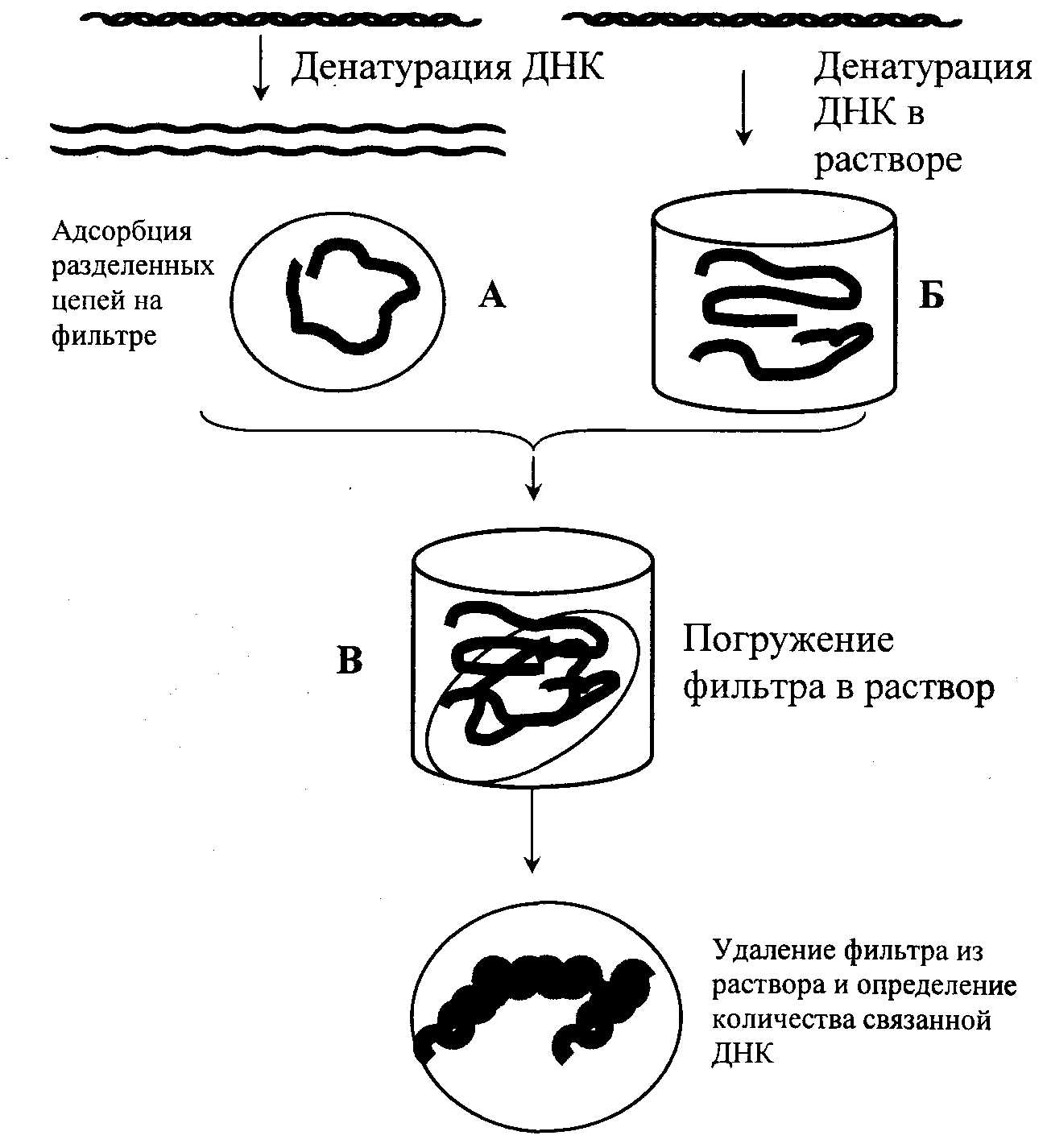 Рис. 12.3. Схема гибридизации на фильтре. А - иммобилизованная на фильтре одноцепочечная ДНК; Б - одноцепочечная ДНК в растворе; В - фильтр с иммобилизованной одноцепочечной ДНК опускается в раствор, содержащий денатурированную молекулу ДНК. Фильтр с адсорбированной ДНК погружают в раствор, содержащий второй препарат денатурированной ДНК (ДНК-зонд). Связывание ДНК-зонда происходит только в том случае, если он имеет комплементарную последовательность с первоначально адсорбированной на фильтре молекулой ДНК. Эффективность гибридизации определяют по количеству метки, оставшейся на фильтре. Метод является очень чувствительным и применяется для изучения структуры гена. При этом необходимо иметь меченые радиоактивным изотопом РНК или ДНК-зонды, идентификация которых с исследуемой молекулой регистрируется с помощью радиоавтографии. В качестве зонда используют клонированную кДНК-копию, т.е. меченую радиоактивным изотопом молекулу ДНК с известной последовательностью нуклеотидов. Метод блоттинга по Саузерну Для идентификации гена молекулу ДНК генома расщепляют с помощью ферментов рестриктаз на куски размером примерно по 15-20 тысяч пар нуклеотидов. Расщепленный таким образом геном подвергается электрофоретическому фракционированию в агарозном геле. После этого фракции ДНК денатурируют нагреванием и переносят из агарозного геля на нитроцеллюлозный фильтр, где их иммобилизуют. Процесс переноса ДНК напоминает промокание (по английский – блоттинг) и называется методом блоттинга по Саузерну. Сущность блоттинга заключается в том, что агарозный гель помещают на фильтровальную бумагу, смоченную в концентрированном солевом растворе; затем на гель накладывают нитроцеллюлозный фильтр и сверху помещают сухую фильтровальную бумагу. Солевой раствор впитывается в сухую бумагу; чтобы это произошло, он должен пройти сквозь агарозный гель и затем через нитроцеллюлозный фильтр. ДНК переносится вместе с раствором, но задерживается нитроцеллюлозой. Иммобилизованную таким образом ДНК можно гибридизовать на месте с радиоактивным зондом. Со специфическим зондом будут гибридизироваться только комплементарные ему фрагменты. Так как зонд радиоактивный, то гибридизацию можно обнаружить с помощью авторадиографии. Каждая комплементарная последовательность проявляется в виде радиоактивной полосы, местоположение которой определяется размером фрагмента ДНК. Схема метода блоттинга по Саузерну представлена на рис. 12.4. 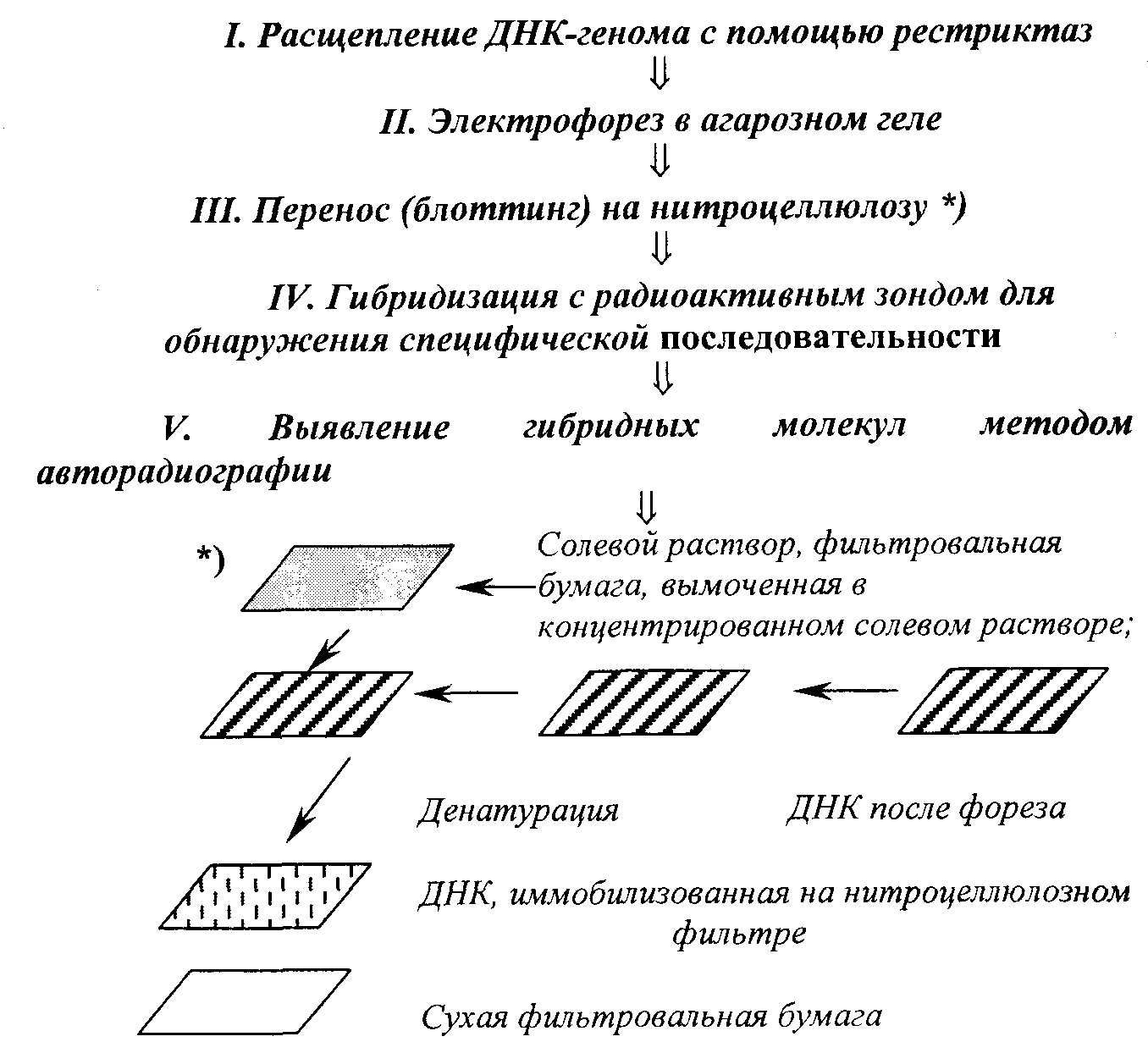 Рис. 12.4. Схема блоттинга по Саузерну: расщепление ДНК генома с помощью рестриктаз на куски 15000-20000 пар нуклеотидов; электрофоретическое разделение этих рестриктаз в агарозном геле, перенос их на нитроцеллюлозный фильтр, гибридизация с ДНК-зондом и выявление образующихся гибридных молекул методом авторадиографии; *)схема переноса (блоттинга). Метод блоттинга является высокочувствительным и точным и широко применяется в криминалистике, медицине, ветеринарии. В настоящее время метод молекулярной гибридизации разработан для диагностики инфекционных болезней сельскохозяйственных животных, например для обнаружения возбудителя сибирской язвы, бруцеллеза, туберкулеза, ящура, чумы свиней, чумы птиц, энтеровирусов и т.д. Этот метод является» перспективным для изучения племенных качеств животных. Он имеет преимущества перед принятым сегодня в селекции методом изучения маркеров белкового полиморфизма. Считают, что метод ДНК-гибридизации может успешно использоваться в селекции быков, так как геном быков можно разделить на гены, которые в дальнейшем выявляются блоттингом. При этом необходимо выделить около 75 фрагментов ДНК, чтобы оценить геном по признаку молочной продуктивности. В последние годы разрабатывается новый метод анализа ДНК, так называемая "геномная дактилоскопия". Геномная дактилоскопия включает следующие этапы: выделение ДНК, фрагментации ее с помощью ферментов - рестриктаз, фракционирование с помощью электрофореза в геле. Фрагменты ДНК, содержащие гипервариабельные участки, выявляют с помощью специального зонда – "пробы Джеффриса", с которой они связываются путем гибридизации. Участки гибридизации выявляются путем авторадиографии. Исследования показали, что в этой методике в качестве радиоактивного зонда может быть использована ДНК, выделенная из бактериофага Ml3. ДНК этого бактериофага содержит еще один тип гипервариабельной последовательности, который найден также и в геноме человека. Принцип строения этой гипервариабельной последовательности в общих чертах сходен со строением минисателлитной ДНК Джеффриса. Использование этой новой пробы для генной "дактилоскопии" показало ее высокую эффективность и пригодность для решения многих задач. Дело в том, что эти гипервариабельные последовательности обнаружены у разных представителей живой природы – человека, животных, растений и бактерий, а потому ДНК-зонд бактериофага M13 может быть использован в широких масштабах. Например, для идентификации личности, для установления родства любых живых существ. Метод дает возможность решать вопросы генетики и селекции животных, вести отбор по полезным признакам; используя этот метод можно вести генную паспортизацию отдельных высокопродуктивных животных, анализировать родословную и полученные сведения использовать для направленной селекции. Существует еще одна разновидность гибридизационного анализа ДНК – это метод точечной (дот) гибридизации (рис.9), который выполняется путем внесения исследуемых образцов ДНК в денатурированном состоянии на капроновые мембранные фильтры в виде точек. Например (рис. 12.5), ДНК микобактерий туберкулеза крупного рогатого скота в количестве 3 мкл (1,8 мкг/мл) в виде точек наносится в квадраты (1,5 х 1,5 см). 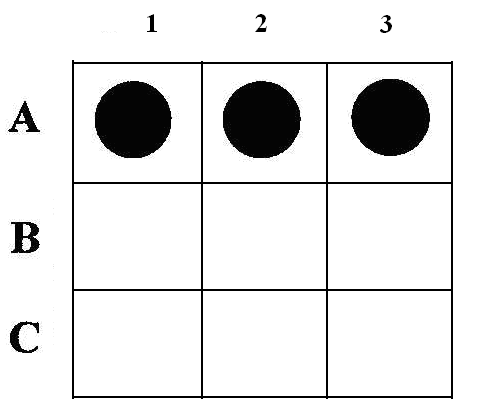 Рис. 12.5. Дот-гибридизация ДНК-зонда M.bovis: А: 1 - M.bovis: 2,3, - ДНК из пораженной туберкулезом ткани; В: 1,2,3 - ДНК, выделенная из тканей здоровых животных; С: 1 - ДНК возбудителя бруцеллеза ; 2 - ДНК возбудителя листерий; 3 - ДНК M. fortuitum. Одноцепочечные молекулы ДНК (денатурированные) адсорбируются на мембране и фиксируются. После этого на фильтр наносится ДНК-зонд, меченный радиоактивным фосфором, то есть одноцепочечная молекула M.bovis, меченая P32 . Поскольку в данном случае азотистые основания молекул ДНК M.bovis и меченого P32 ДНК-зонда комплементарны, то происходит связывание азотистых оснований нитей ДНК и ДНК-зонда с образованием двойной спирали. После этого несвязанные молекулы ДНК-зонда отмываются и образующиеся гибридные молекулы выявляются путем радиоавтографии. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР) Из молекулярных методов диагностики наибольшее распространение получила полимеразная цепная реакция (ПЦР). Предложенный в 1983 году американским биохимиком Керри Маллисом метод ПЦР в корне изменил подход в молекулярной диагностике наследственных и инфекционных заболеваний, судебно-медицинской экспертизе вещественных доказательств, установлении родства и анализе родословных, систематике микроорганизмов, растений, животных и т.д. За изобретение ПЦР К.Маллис в 1993 г. был удостоен Нобелевской премии. Полимеразная цепная реакция – наиболее точный метод на сегодняшний день метод исследований по генной диагностики. Принцип метода заключается в том, что по данным банка генов различных организмов выявляется специфический для данного организма (бактериальной клетки, вируса) ген – участок молекулы ДНК, несущий информацию для синтеза одного белка. К участкам данного гена синтезируются затравки - праймеры, длиной 15-25 нуклеотидов. ПЦР является надежным, высокочувствительным методом, хорошо защищенным от ложноположительных и ложноотрицательных результатов. В модельной системе при диагностике вирусных инфекций удается регистрировать порядка 10 геномов в пробе (Виноградская P.P. и др., 1991 г.). Считают, что предел чувствительности ПЦР-диагностикума при условии использования 100 мкл необогащенного клинического образца в качестве пробы составляет 10-10 возбудителей в 1 мл. Такой чувствительности достигают только культуральные методы диагностики. ПЦР имеет преимущество перед культуральными методами для обнаружения возбудителей болезней, которые не удается выращивать в лабораторных условиях. Суть полимеразной цепной реакции (рис. 12.6) заключается в том, что молекулу ДНК подвергают температурному плавлению, то есть нагревают до 90-94о C, что ведет к денатурации – разрушению водородных связей между азотистыми основаниями двойной спирали, а затем охлаждают (отжиг) до 52°С в присутствии праймера, фермента ДНК-полимеразы и всех четырех дезокситрифосфатов. 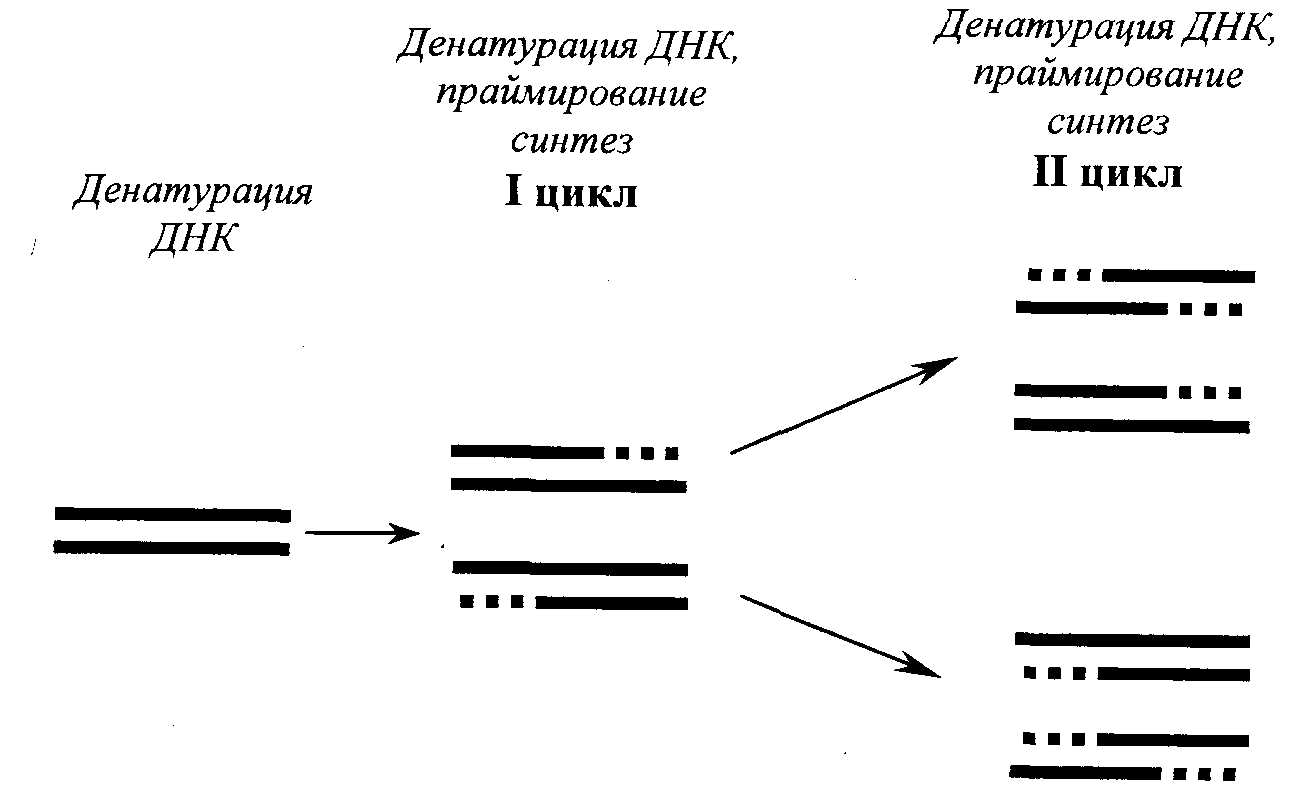 Рис. 12.6 Схематическое изображение амплификации молекулы ДНК при плавлении (денатурации) и отжиге (синтезе) новой молекулы ДНК в присутствии затравки (праймера), фермента ДНК-полимеразы и трифосфатов. ▬ праймер ▪ ▪ ▪ ▪ новосинтезированная молекула ДНК Последующее повышение температуры до 70-72°С приводит к синтезу новой молекулы ДНК, комплементарной к матричной. Эту процедуру плавления, отжига и синтеза ДНК повторяют многократно, в результате чего количество выбранного фрагмента ДНК увеличивается в геометрической прогрессии (рис. 12.6). Специфичность метода уникальна, так как она обусловлена последовательностью нуклеотидов затравки (праймера) и в зависимости от цели исследования можно выявить вид, группу видов или род микроба. Так, использовав в качестве праймера олигонуклеотид гена gro El микобактерий можно установить наличие в образце представителей любого из 30 видов рода Mycobacteria; праймера IS 986 (или IS6110) – представителей любого из четырех видов – возбудителей туберкулеза человека, относящихся к M.tuberculosisComplex; праймер к IS 900 выявит один единственный вид – Mycobacteriumparatuberculosis (Ланцев В.А и др., 1993 г.). Продолжительность реакции определяется числом циклов, необходимых для синтеза ДНК-амплификата в количестве, достаточном для дальнейшего исследования или индикации. Индикация может быть осуществлена с помощью электрофореза или с помощью меченого ДНК-зонда. Необходимые приборы и реактивы • ДНК-амплификатор (термоциклер) – прибор, обеспечивающий циклическую смену температур по заданной программе (выпускаемые в настоящее время термоциклеры рассчитаны на одновременное проведение до 96 реакций); • стандартный набор лабораторного оборудования для выделения генетического материала из исследуемых образцов, постановки электрофореза (центрифуга типа "Eppendorf), вортекс, автоматические пипетки, источник питания, электрофоретические камеры, трансиллюминатор), одноразовые наконечники и пробирки для ПЦР; • термостабильная ДНК-полимераза, выдерживающая многократный нагрев до 96 0C; это фермент, выделяемый из бактерий, обитающих в горячих источниках (гейзерах). В настоящее время известны два штамма термофильных бактерий, из которых выделены эти ферменты (Termusaquaticus и Termusthermophilus), соответственно ферменты обозначаются Taq-полимераза и Tth-полимераза. • Праймер – олигонуклеотид из 15-20 нуклеотидов, является затравкой для синтеза новой молекулы ДНК. Данный олигонуклеотид должен быть специфичным для исследуемого организма (возбудителя болезни). Его получают путем химического синтеза на автоматическом синтезаторе, пользуясь данными о первичной структуре (нуклеотидной последовательности) ДНК. • дезоксинуклеозидтрифосфаты – dNTP, предшественники синтеза ДНК. В настоящее время выпускаются специальные наборы для ПЦР, предназначенные для диагностики туберкулеза крупного рогатого скота, бруцеллеза, ящура и других инфекционных болезней животных. Обычно один набор содержит компоненты для анализа 100 образцов. На рис. 12.7 показаны результаты проведения полимеразной цепной реакции по идентификации классической чумы свиней. 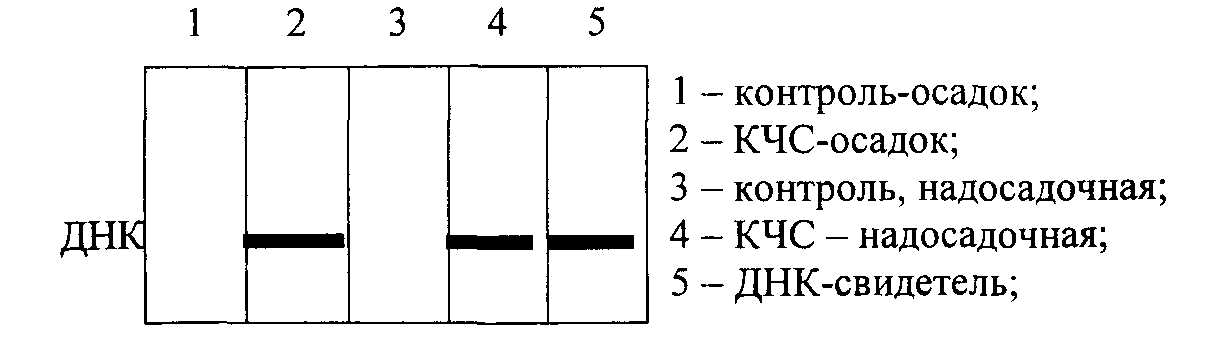 Рис. 12.7. Фотография электрофореграммы, полученной при ультрафиолетовом (УФ) освещении агарозногогеля с продуктами ПЦР. Полосы, выявляемые при УФ-освещении, – это фрагменты ДНК, амплифицированые с участием использованных в опытах праймеров. Контроль – лизат из культуры клток ПК-15, КЧС – лизат из клеток, инфицированных вирусом классической чумы свиней. 13. ОБМЕН ВОДЫ И СОЛЕЙ Организм животных и растений, кроме белков, углеводов и липидов, содержит обширную группу веществ неорганической природы. К ним относятся вода, анионы и катионы неорганических кислот и солей. Значительная часть солей в организме находится в растворенном состоянии. Другая часть образует прочные нерастворимые комплексы с белками, например, фосфорнокислый кальций в костной ткани, углекислый кальций в раковинах моллюсков. Некоторое количество минеральных веществ входит в состав органических веществ: железо содержится в геме гемоглобина, цитохромов, каталазы, миоглобина; магний, марганец, цинк, медь – в ряде ферментов; йод – в тироксине; кобальт – в витамине B12. Сейчас установлено, что в организме животных и растений обнаруживается до 76 различных элементов (из известных 106). Различают макроэлементы – их содержание в тканях составляет мг% и более: Ca2+, Mg2+, Na+, K+, P5+, Сl- , S2-. Микроэлементы – в следовых количествах (мкг%, 10-3 и менее) –Fe2+, Cu2+, Zn2+, I-, Mo2+, Co2+ и др. – однако в некоторых органах они могут содержаться в значительных количествах, например, йод в щитовидной железе. Вода, ее содержание и роль в организме Вода составляет 75% биомассы Земли, 65% общей массы животного организма. Вода обеспечивает всасывание, механическое передвижение питательных веществ, продуктов обмена, является универсальным растворителем. Участвует в процессах набухания, осмоса, создает онкотическое добавление в крови, тканях. Для воды характерна высокая удельная теплоемкость, теплопроводность; она обеспечивает поддержание температуры тела. Вода высокополярное соединение, вызывает диссоциацию электролитов, обуславливает гидратацию, участвует в гидролитическом распаде, вода сама является конечным продуктом обмена в процессе биологического окисления. Все основные химические реакции в клетке – биосинтез, ферментативный катализ происходят с участием воды. Молекула воды – электрический диполь, дипольный момент 1,86. Для молекул воды характерна водородная связь, определяющая в значительной степени ее свойства и значение. Водородные связи возникают между частичным отрицательным зарядом атома кислорода одной молекулы воды и частичным положительным зарядом атома водорода соседней. Каждая молекула воды связана с четырьмя молекулами H2O, образуя сетку водородных связей ( рис. 13.1.). 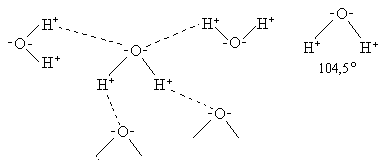 Рис. 13.1. Образование сетки водородных связей. При внешних воздействиях сетка водородных связей перестраивается (растворение различных веществ, образование пара, льда), этим определяется ряд свойств воды. Между молекулами воды имеются пустоты, которые могут заполняться частицами растворенного вещества. Это очень важное свойство воды как растворителя. Так, в одном литре воды лишь 370 мл занято ее молекулами, а 630 мл составляет межмолекулярное пространство, где протекают различные процессы в ходе растворения, диффузии, гидролитического расщепления. Для воды характерна очень низкая вязкость, что придает водным растворам хорошую текучесть и быстрое перемещение жидкостей. В организме вода находится в свободном и связанном (иммобилизованном) виде. Свободная вода содержится в плазме крови, лимфе, спинномозговой жидкости, в пищеварительных соках, моче. В межклеточном пространстве свободной воды мало, она там удерживается капиллярными силами. Свободная вода обеспечивает приток к тканям питательных веществ и удаление из них конечных продуктов обмена. Связанная вода не способна к свободному перемещению. Часть воды связана с белками (с полярными группами) – это гидратационная вода. Каждые 100 г белка могут связывать 18-20 г воды. На 1 молекулу нуклеиновой кислоты приходится 100000 молекул воды, белка – 40000 и липидов – 1500 молекул воды. Гидратационная вода не замерзает при охлаждении до Oо C и ниже, имеет повышенную плотность (1,48-2,4), в ней не растворяются вещества, обычно растворимые в воде. Эти отличия обусловлены упорядоченным расположением молекул (диполей) воды вокруг полярных групп гидрофильных коллоидов. |
