Биологические мембраны
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
ИНОЗИТОЛФОСФАТНАЯ СИСТЕМА Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc — белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Последовательность событий, приводящих к активации фосфолипазы С: 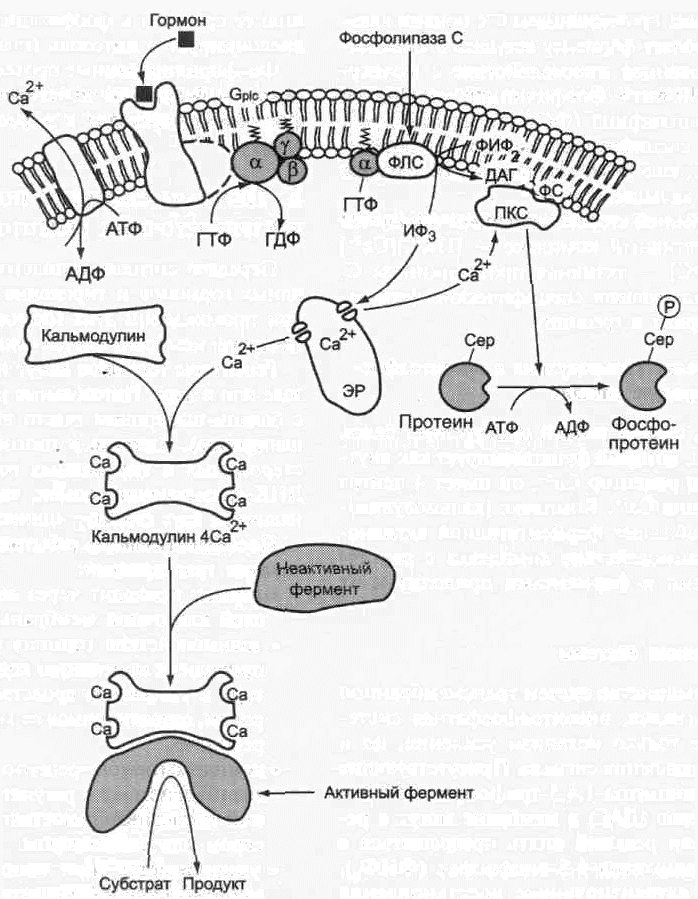 • связывание сигнальной молекулы, например гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Gр|с-белку. • образование комплекса [Г][R][Gр1с-ГДФ] приводит к снижению сродства α-протомера Gр|с-белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ. • это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С. • α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипа-зы-С происходит гидролиз липида мембраны фосфатидилинозитол-4,5-бисфосфата (ФИФ2). Инозитолфосфатная система. • в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС). • инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2+-кана- ла мембраны ЭР, это приводит к изменению конформации белка и открытию канала — Са2+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт. Активация протеинкиназы С • Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС) и белком кальмо-дулином, таким образом сигнал, принятый рецептором клетки, раздваивается. Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами «кислого» фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция. • На внутренней стороне мембраны образуется ферментативный комплекс — [ПКС][Са2+] [ДАГ][ФС] — активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину. Участие белка кальмодулина в. инозитолфосфатной передаче сигнала В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са2+, он имеет 4 центра для связывания Са2+. Комплекс [кальмодулин]-[4 Са2+] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации. Саморегуляция системы Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАТ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилировани-ем протеинкиназой С. Концентрация Са2+ в клетке снижается до исходного уровня при действии Са2+-АТФ-аз цито-плазматической мембраны и ЭР, а также Na+/Ca2+-и Н+/Са2+-транслоказ (активный антипорт) клеточной и митохондриальной мембран. Функционирование транслоказ Са2+ и Са2+-АТФ-аз может активироваться: • комплексом [кальмодулин] [4 Са2+]; • протеинкиназой А (фосфорилированием); • протеинкиназой С (фосфорилированием). Понижение концентрации Са2+ в клетке и диацилглицерола в мембране приводит к изменению конформации протеинкиназы С, снижению её сродства к фосфатидилсерину, фермент диссоциирует в цитозоль (неактивная форма). Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму.
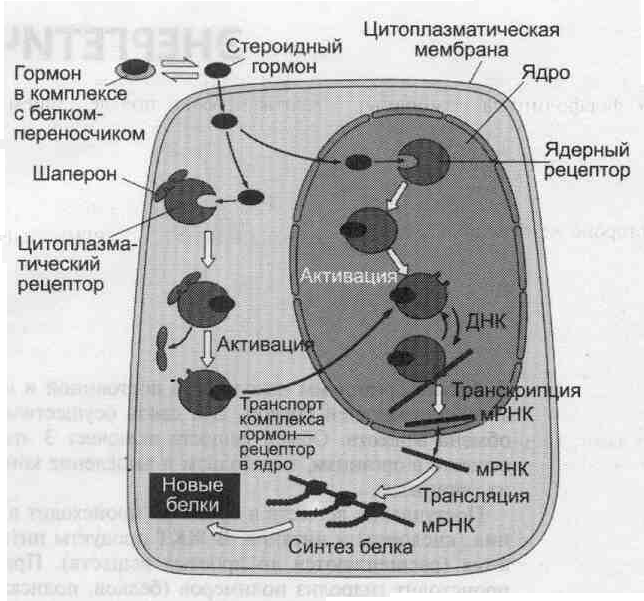 Передача сигнала липидорастворимых стеро-идных гормонов и тироксина возможна только при прохождении этих гормонов через плазматическую мембрану клеток-мишеней. Рецепторы гормонов могут находиться в цитозоле или в ядре. Цитозольные рецепторы связаны с белком-шапероном (часто это группа белков-шаперонов). Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНК-связывающий домен, характеризующийся наличием двух структур «цинковых пальцев». Последовательность событий, приводящих к активации транскрипции: • гормон проходит через двойной липидный слой клеточной мембраны. • взаимодействие гормона с рецептором (R) приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон-рецептор. • комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК — энхаисером или сайленсером. • увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы. • соответственно увеличивается или уменьшается скорость транскрипции структурных генов. • увеличивается или уменьшается скорость трансляции. • изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки. Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы.
Для исследователей, имеющих представление о количестве сигнальных молекул, о соответствующем количестве рецепторов, о трансмембранных системах передачи сигналов, вторичных посредниках, остаётся загадкой, как протеинкиназы выбирают соответствующий фермент метаболического пути для фосфорилирования. Исследователи для объяснения этого явления предлагают «гипотезу мишени» (от англ. targetinghypothesis). По этой гипотезе специфичность протеинкиназ и фосфопротеинфосфатаз достигается путём образования компартментов на мембране, в состав которых входят не только сами протеинкиназы и фосфопротеинфосфатазы, но и специфические белки-субстраты. Наличие остатка миристиновой или пальмитиновой кислоты в структуре белков-субстратов — условие их «заякоривания» в соответствующем мембранном компартменте. Однако в большинстве случаев процесс активации какого-либо метаболического процесса находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, поэтому важным фактором ответа клеток служит взаимосвязь этих систем. |
