|
|
Биологические мембраны
Любая молекула может пройти через липидный бислой, однако скорость пассивной диффузии веществ, т.е. перехода вещества из области с большей концентрацией в область с меньшей, может сильно отличаться. Для некоторых молекул это занимает столь длительное время, что можно говорить об их практической непроницаемости для липидного бислоя мембраны. Скорость диффузии веществ через мембрану зависит главным образом от размера молекул и их относительной растворимости в жирах.
Легче всего проходят простой диффузией через липидную мембрану малые неполярные молекулы, такие как О2, стероиды, тиреоидные гормоны, а также жирные кислоты. Малые полярные незаряженные молекулы — СО2, NH3, H2O, этанол, мочевина — также диффундируют с достаточно большой скоростью. Диффузия глицерола идёт значительно медленнее, а глюкоза практически не способна самостоятельно пройти через мембрану. Для всех заряженных молекул, независимо от размера, липидная мембрана непроницаема.
Транспорт таких молекул возможен благодаря наличию в мембранах либо белков, формирующих в липидном слое каналы (поры), заполненные водой, через которые могут проходить вещества определённого размера простой диффузией, либо специфических белков-переносчиков, которые избирательно взаимодействуя с определёнными лигандами, облегчают их перенос через мембрану (облегчённая диффузия).
Кроме пассивного транспорта веществ, в клетках есть белки, активно перекачивающие определённые растворённые в воде вещества против их градиента, т.е. из меньшей концентрации в область большей. Этот процесс, называемый активным транспортом, осуществляется всегда с помощью белков-переносчиков и происходит с затратой энергии.
строение и функционирование белковых каналов
Каналы в мембране формируются интегральными белками, которые «прерывают» липидный
бислой, образуя пору, заполненную водой. Стенки канала «выстилаются» радикалами аминокислот этих белков.
Если каналы различают вещества только по размеру и пропускают все молекулы меньше определённой величины, по градиенту концентрации, т.е. служат фильтрами, то их называют «неселективные каналы», или «поры». Такие поры есть в наружной мембране митохондрий, где молекулы белка-порина образуют широкие гидрофильные каналы. Через них могут проходить все молекулы с молекулярной массой 10 кД и меньше, в том числе и небольшие белки.
Селективные каналы, как правило, участвуют в переносе определённых ионов. Ионная селективность (избирательность) каналов определяется их диаметром и строением внутренней поверхности канала. Например, катионселективные каналы пропускают только катионы, так как содержат много отрицательно заряженных аминокислотных остатков.
Открытие или закрытие селективных каналов регулируется либо изменением концентрации специфических регуляторов, таких как медиаторы, гормоны, циклические нуклеотиды, NO, G-белки, либо изменением трансмембранного электрохимического потенциала. Воздействие регуляторного фактора вызывает конформационные изменения каналообразующих белков, канал открывается и ионы проходят по градиенту концентрации. Транспорт веществ через каналы не приводит к конформационным изменениям белков и зависит только от разности концентраций веществ по обе стороны мембраны. Поэтому скорость транспорта веществ через такие каналы может достигать 106-108 ионов в секунду.
облегчённая диффузия веществ
В мембранах клеток существуют белки-транс-локазы. Взаимодействуя со специфическим лигандом, они обеспечивают его диффузию (транспорт из области большей концентрации в область меньшей) через мембрану. В отличие от белковых каналов, транслоказы в процессе взаимодействия с лигандом и переноса его через мембрану претерпевают конформационные изменения. Кинетически перенос веществ облегчённой диффузией напоминает ферментативную реакцию. Для транслоказ существует насыщающая концентрация лиганда, при которой все центры связывания белка с лигандом заняты, и белки работают с максимальной скоростью Vmax. Поэтому скорость транспорта веществ облегчённой диффузией зависит не только от градиента концентраций переносимого лиганда, 'но и от количества белков-переносчиков в мембране.
Существуют транслоказы, переносящие только одно растворимое в воде вещество с одной стороны мембраны на другую. Такой простой транспорт называют «пассивный унипорт».
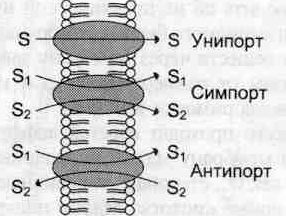
Некоторые транслоказы могут переносить два разных вещества по градиенту концентраций в одном направлении — пассивный симпорт, или в противоположных направлениях — пассивный антипорт.
Примером транслоказы, работающей по механизму пассивного антипорта, может служить анионный переносчик мембраны эритроцитов.
S1 и S2 – разные молекулы
Внутренняя митохондриальная мембрана содержит много транслоказ, осуществляющих пассивный антипорт. В процессе такого переноса происходит эквивалентный обмен ионами, но не всегда эквивалентный обмен по заряду.
строение И функционирование БЕЛКОВ-ПЕРЕНОСЧИКОВ, ОСУЩЕСТВЛЯЮЩИХ АКТИВНЫЙ ТРАНСПОРТ
Перенос некоторых лигандов (ионов, глюкозы, аминокислот) через мембраны происходит против градиента концентрации и сопряжён с затратой энергии (активный транспорт). Перенос лигандов через мембрану, связанный с затратой энергии АТФ, называют «первично-активный транспорт».
1. Первично-активный транспорт
Перенос некоторых неорганических ионов идёт против градиента концентрации при участии транспортных АТФ-аз (ионных насосов). Все ионные насосы одновременно служат ферментами, способными к аутофосфорилированию и аутодефосфорилированию. АТФ-азы различаются по ионной специфичности, количеству переносимых ионов, направлению транспорта. В результате функционирования АТФ-азы переносимые ионы накапливаются с одной стороны мембраны. Наиболее распространены в плазматической мембране клеток человека На+,К+-АТФ-аза, Са2+-АТФ-аза и Н+,К+,-АТФ-аза слизистой оболочки желудка.
Na+, К+-АТФ-аза
Этот фермент-переносчик катализирует АТФ-зависимый транспорт ионов Na+ и К+ через плазматическую мембрану. Nа+,К+-АТФ-аза состоит из субъединиц α и β; α - каталитическая большая субъединица, β - малая субъединица (гликопротеин). Активная форма транслоказы — тетрамер (αβ)2.
Na+,К+-АТФ-аза отвечает за поддержание высокой концентрации К+ в клетке и низкой концентрации Na+. Так как Nа+,К+-АТФ-аза выкачивает три положительно заряженных иона, а закачивает два, то на мембране возникает электрический потенциал с отрицательным значением на внутренней части клетки по отношению к её наружной поверхности.
Са2+-АТФ-аза
В цитозоле «покоящихся» клеток концентрация Са2+ составляет 10'7 моль/л, тогда как вне клетки она равна
2-10-3 моль/л. Поддерживает такую разницу в концентрации система активного транспорта ионов кальция; её основные компоненты — кальциевые насосы — Са2+-АТФ-азы и Na+,Ca2+ -обменники.
Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфорилирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмодулином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами.
Нарушение активности Са2+-АТФ-азы при патологии. Одна из причин нарушения работы
Са2+-АТФ-азы — активация перекисного окисления липидов (ПОЛ) мембран. Окислению подвергаются как ацильные остатки жирных кислот в составе фосфолипидов, так и SH-группы в активном центре фермента. Нарушение структуры липидного окружения и структуры активного центра приводит к изменению конформации АТФ-азы, потере сродства к ионам кальция и способности к аутофосфорилированию. АТФ-аза перестаёт выкачивать ионы кальция из цитозоля клетки, повышается концентрация внутриклеточного кальция, Са2+ усиливает мышечное сокращение, возрастает тонус мышечной стенки, что приводит к повышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий.
2. Вторично-активный транспорт
Перенос некоторых растворимых веществ против градиента концентрации зависит от одновременного или последовательного переноса
другого вещества по градиенту концентрации в том же направлении (активный симпорт) или в противоположном (активный антипорт). В клетках человека ионом, перенос которого происходит по градиенту концентрации, чаще всего служит Na+.
Примером такого типа транспорта может служить Nа+,Са2+-обменник плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+ против градиента концентрации выходят из клетки.
По механизму активного симпорта происходят всасывание глюкозы клетками кишечника и реабсорбция из первичной мочи глюкозы, аминокислот клетками почек.
перенос через мембрану макромолекул И частиц: ЭНДОЦИТОЗ И ЗКОЦИТОЗ
Траспортные белки обеспечивают перемещение через клеточную мембрану полярных молекул небольшого размера, но они не могут транспортировать макромолекулы, например белки, нуклеиновые кислоты, полисахариды или ещё более крупные частицы. Механизмы, с помощью которых клетки могут усваивать такие вещества или удалять их из клетки, отличаются от механизмов транспорта ионов и полярных соединений.
1. Эндоцитоз
Перенос вещества из среды в клетку вместе с частью плазматической мембраны называют «эндоцитоз». Путём эндоцитоза (фагоцитоза) клетки могут поглощать большие частицы, такие как вирусы, бактерии или обломки клеток. Захват больших частиц осуществляется в основном специализированными клетками — фагоцитами.
Поглощение жидкости и растворённых в ней веществ с помощью небольших пузырьков называют «пиноцитоз». Усвоение веществ механизмом эндоцитоза (пиноцитоза) характерно для всех клеток.
Цикл эндоцитоза начинается в определённых участках плазматической мембраны, называемых «окаймлённые ямки». На долю окаймлённых ямок приходится всего 1-2% общей площади мембраны. Белок клатрин образует решётчатые структуры, связанные с углублениями на поверхности плазматической мембраны.
Окаймлённые ямки втягиваются в клетку, сужаются у основания, отделяются от мембраны, образуя окаймлённые пузырьки (пиноцитозные пузырьки). Время жизни окаймлённых ямок невелико, они формируются в течение минуты, затем совершают цикл эндоцитоза.
Вещества в составе пиноцитозных пузырьков не смешиваются с другими макромолекулами клетки. Они заканчивают свой путь в лизосомах, а мембранные компоненты пузырьков, содержащие клатрин, возвращаются в плазматическую мембрану.
Эндоцитоз, происходящий с участием рецепторов, встроенных в окаймлённые ямки, позволяет клеткам поглощать специфические вещества. Макромолекулы или частицы связываются рецепторами и накапливаются в окаймлённой ямке. Затем следует погружение в клетку и отделение эндоцитозного пузырька, в составе которого находится поглощённое вещество, мембранные компоненты окаймлённой ямки и рецептор. В разные окаймлённые ямки могут быть встроены разные рецепторы.
Примером рецептор-зависимого эндоцитоза может служить поступление в клетку холесте-рола в составе липопротеинов низкой плотности (ЛПНП).
2. Экзоцитоз
Макромолекулы, например белки плазмы крови, пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы, синтезируются в клетках и затем секретируются в межклеточное пространство или кровь. Но мембрана непроницаема для таких макромолекул или комплексов, их секреция происходит путём экзоцитоза. Особенность экзоцитоза в том, что секретируемые вещества локализуются в пузырьках и не смешиваются с другими макромолекулами или органеллами клетки. В ходе экзоцитоза содержимое секреторных пузырьков выделяется во внеклеточное пространство, когда они сливаются с плазматической мембраной.
В организме имеются как регулируемый, так и нерегулируемый пути экзоцитоза. Нерегулируемая секреция характеризуется непрерывным синтезом секретируемых белков, упаковкой их в транспортные пузырьки в аппарате Гольджи и переносом к плазматической мембране для секреции. Примером может служить синтез и секреция коллагена фибробластами для формирования межклеточного матрикса.
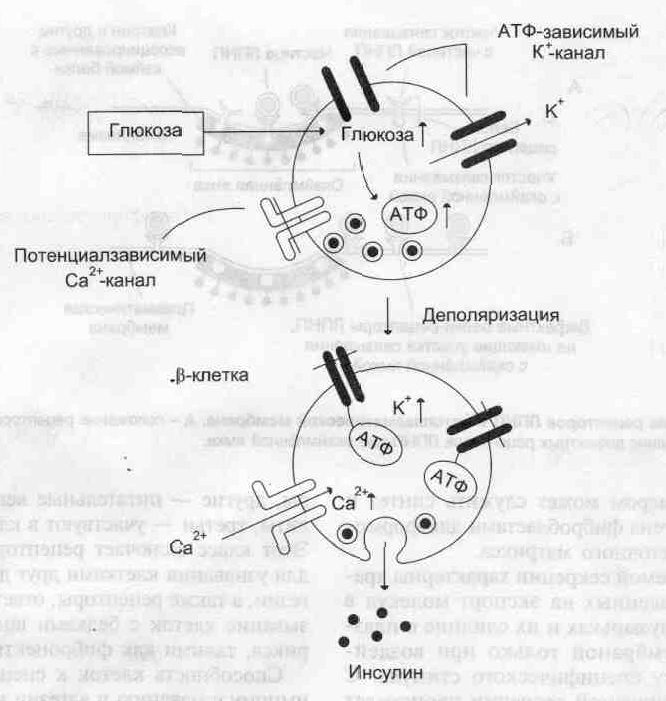
Регуляция секреции инсулина. Повышение концентрации глюкозы приводит к увеличению соотношения АТФ/АДФ в β-клетке, закрытию АТФ-зависимых калиевых каналов, деполяризации, раскрытию потенциалзависимых кальциевых каналов, Повышение концентрации ионов калия и кальция в β-кпетке инициирует слияние секреторных пузырьков (инсулинсодержащих гранул) с мембраной и выделение содержимого пузырьков (инсулина] из клетки.
Для регулируемой секреции характерны хранение приготовленных на экспорт молекул в транспортных пузырьках и их слияние с плазматической мембраной только при воздействии на клетку специфического стимула. С помощью регулируемой секреции происходят выделение пищеварительных ферментов в период переваривания пищи, а также секреция гормонов, нейромедиаторов и других биологически активных веществ. Пример такого типа секреции — выброс пептидного гормона инсулина в кровь после еды. Стимулом к секреции инсулина, хранящегося в секреторных гранулах β-клеток островков Лангерханса поджелудочной железы, является повышение концентрации глюкозы в крови и β-клетках.
УЧАСТИЕ МЕМБРАН В МЕЖКЛЕТОЧНЫХ ВЗАИМОДЕЙСТВИЯХ
В плазматической мембране эукариотических клеток содержится множество специализированных рецепторов, которые, взаимодействуя с лигандами, вызывают специфические клеточные ответы. Одни рецепторы связывают сигнальные молекулы — гормоны, нейромедиаторы, другие — питательные вещества и метаболиты, третьи — участвуют в клеточной адгезии. Этот класс включает рецепторы, необходимые для узнавания клетками друг друга и для их адгезии, а также рецепторы, ответственные за связывание клеток с белками внеклеточного матрикса, такими как фибронектин или коллаген.
Способность клеток к специфическому взаимному узнаванию и адгезии важна для эмбрионального развития. У взрослого человека адгезивные взаимодействия «клетка—клетка» и «клетка—матрикс» продолжают оставаться существенными для поддержания стабильности тканей. В многочисленном семействе рецепторов клеточной адгезии наиболее изучены интегрины, селектины и кадгерины.
Интегрины — обширное суперсемейство гомологичных рецепторов клеточной поверхности для молекул межклеточного матрикса, таких как коллаген, фибронектин, ламинин и др. Являясь трансмембранными белками, они взаимодействуют как с внеклеточными молекулами, так и с внутриклеточными белками цитоскелета. Благодаря этому интегрины участвуют в передаче информации из внеклеточной среды в клетку, определяя таким образом направление её дифференцировки, форму, митотическую активность, способность к миграции. Передача информации может идти и в обратном направлении — от внутриклеточных белков через рецептор во внеклеточный матрикс.
Идентифицировано примерно 20 разных членов семейства рецепторов в разных типах клеток.
Интегрины — гетеродимеры, а каждая субъединица (α, β) содержит один трансмембранный домен.
Индивидуальные интегрины строго специфичны. Центр связывания интегринов образован внеклеточными доменами α- и β-субъединиц. Интегрины узнают и связываются с белками, содержащими определённую аминокислотную последовательность -Арг-Гли-Асп-, присутствующую в ряде матриксных белков (фибронектин, фибриноген, ламинин, коллаген I типа и другие). Эффект связывания усиливается в присутствии ионов Са2+ и Mg2+.
Кадгерины и селектины — семейства трансмембранных Са2+-зависимых гликопротеинов, участвующих в межклеточной адгезии.
Кадгерины разных тканей очень схожи, гомологичные аминокислотные последовательности составляют 50—60%. Каждый рецептор имеет один трансмембранный домен. В отсутствие Са2+ конформация кадгеринов меняется, и они становятся доступными для протеолитических ферментов, которые их расщепляют. Наиболее полно охарактеризованы 3 группы кадгериновых рецепторов:
• Е-кадгерин находится на поверхности многих клеток эпителиальных и эмбриональных тканей;
• N-кадгерин локализован на поверхности нервных клеток, клеток сердца и хрусталика;
• Р-кадгерин расположен на клетках плаценты и эпидермиса.
Кадгерины играют важную роль при начальной межклеточной адгезии, на стадиях морфо-и органогенеза. Они обеспечивают структурную целостность и полярность тканей, особенно эпителиального монослоя.
В семействе селектиновых рецепторов наиболее хорошо изучены три белка: L-селектин,
Р-селектин и Е-селектин. Внеклеточная часть селектинов состоит из 3 доменов: первый домен представлен 2—9 блоками повторяющихся аминокислотных остатков (комплементрегуляторный белок), второй — домен эпидермального фактора роста (ЭФР), третий — N-концевой лектиновый домен. Селектины L, Р, Е различаются количеством блоков в комплементрегуляторном белке. Лектины — семейство белков, специфически взаимодействующих с определёнными последовательностями углеводных остатков в составе гликопротеинов, протеогликанов и гликолипидов внеклеточного матрикса.
Углеводные структуры — поливалентные линкерные молекулы, которые могут быть суль-фатированы, фукозилированы и сиализированы. Связывание лигандов с рецепторами происходит в области N-концевого лектинового домена.
|
|
|
 Скачать 1.56 Mb.
Скачать 1.56 Mb.

