Биологические мембраны
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛАВажное свойство мембран — способность воспринимать и передавать внутрь клетки сигналы из внешней среды. «Узнавание» сигналь- ных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора. Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так: • взаимодействие рецептора с сигнальной молекулой (первичным посредником); • активация мембранного фермента, ответственного за образование вторичного посредника; • образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+; • активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказывают влияние на активность внутриклеточных процессов. Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
Сигнальными молекулами могут быть неполярные и полярные вещества. Неполярные вещества, например стероидные гормоны, проникают в клетку, проходя через липидный бислой. Полярные сигнальные молекулы в клетку не проникают, но связываются специфическими рецепторами клеточных мембран. Такое взаимодействие вызывает цепь последовательных событий в самой мембране и внутри клетки. К полярным сигнальным молекулам относят белковые гормоны (например, инсулин), нейромедиаторы (например, АХ, ГАМК), факторы роста, цитокины, эйкозаноиды.
По локализации различают мембранные, цитоплазматические и ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах мс) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы. Рецепторы первого типа — интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал. Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы, обладающие собственной тирозинкиназной или гуанилатциклазной активностью, и рецепторы, взаимодействующие через G-белок с мембранным ферментом. Связывание лиганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т.е. через мембрану переносится информация, а не заряды или какие-либо растворённые молекулы. В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро. Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т.д.) клеток-мишеней. 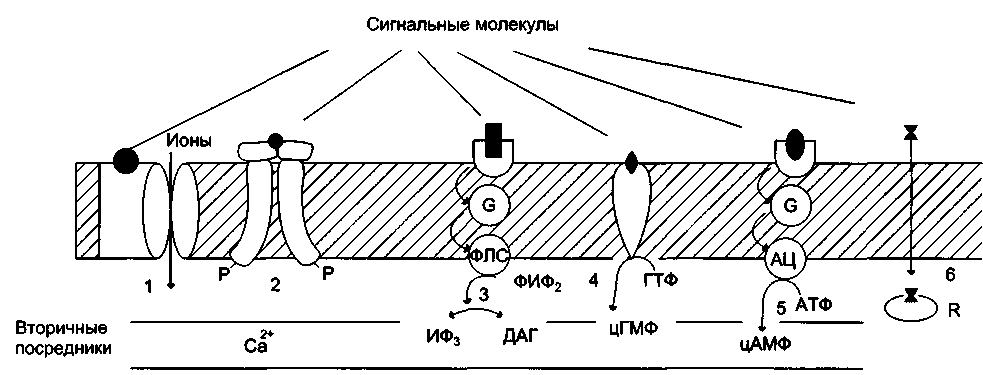 Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 — связанные с ионными каналами, например рецептор ГАМК; 2— с каталитической активностью (рецептор инсулина); 3— передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 — с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 — передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола. 1. Рецепторы адреналина — адренорецепторы Адренорецепторы различают по распределению в организме — центральные и периферические. Центральные адренорецепторы, локализованные в различных областях мозга, участвуют в регуляции функций ЦНС, периферические — контролируют работу внутренних органов. Все адренорецепторы классифицируют на два типа — α- и β-, но каждый тип имеет несколько подтипов, наиболее распространённые из них — α1-, α2-, β1 - и β2-рецепторы. В зависимости от своего анатомического расположения клетки одного типа, например гладко-мышечные клетки сосудов или адипоциты, содержат разные типы рецепторов. Несмотря на значительное подобие между α- и β-рецепторами и их подтипами, они кодируются разными генами. Адренорецепторы принадлежат к семейству белков, имеющих 7 трансмембранных а-спиралей (которые принято называть доменами). Длина N- и С-концов, а также длина 1-4 доменов различается у разных типов и подтипов рецепторов. Адренорецепторы — гликопротеины, включающие в свой состав различные углеводные фрагменты. Гликозилированию подвергаются расположенные в области N-конца остатки аспарагиновой кислоты. β-Адренорецепторы встречаются практически во всех тканях организма. Количество β-адренорецепторов, приходящееся на клетку, варьирует от 300 до 4000. Центр связывания адреналина образован аминокислотными остатками третьего, пятого и шестого доменов α-Адренорецепторы различают по локализации (например, гепатоциты имеют α1-рецепторы, адипоциты — α2-адренорецепторы) и механизму трансформации биологического сигнала. Эффекторные системы, связанные с α1,- и α2-адренорецепторами, включают G-белки разного типа — Gplc-белки (G-белок стимулирующий) и Gi-белки (G-белок ингибирующий) и соответственно ферменты — фосфолипазу С или аденилатциклазу. 2. Рецепторы с тирозинкиназной активностью Тирозиновые протеинкиназы — ферменты, фосфорилирующие специфические белки по тирозину, подразделяют на 2 типа — мембранные (рецепторные) и цитоплазматические. Внутриклеточные тирозиновые протеинкиназы принимают участие в процессах передачи сигнала в ядро. Рецепторные тирозиновые протеинкиназы участвуют в трансмембранной передаче сигналов. 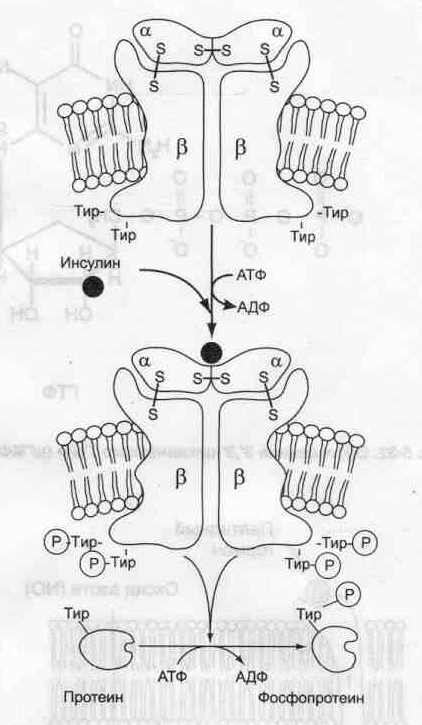 Примером рецепторной тирозиновой протеинкиназы может служить рецептор инсулина. Рецептор инсулина — тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина. Рецептор состоит из двух α- и двух β-субъединиц, связанных дисульфидными связями и нековалентными взаимодействиями, α- и β-Субъединицы — гликопротеины с углеводной частью на наружной стороне мембраны. Вне мембраны на её поверхности находятся α-субъе-диницы. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. β-Субъединицы пронизывают мембранный бислой и не участвуют в связывании инсулина. Активация рецептора инсулина — тирозиновой протеинкиназы Каталитический центр тирозиновой протеинкиназы находится на внутриклеточных доменах β-субъединиц. В отсутствие гормона инсулиновые рецепторы не проявляют тирозинкиназной активности. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причём субстратом служит сама тирозиновая протеинкиназа (β-субъединицы), т.е. происходит фосфорилирование β-субъединицы по нескольким тирозиновым остаткам. Фосфорилирование β-субъединиц происходит по механизму межмолекулярного трансфосфорилирования, т.е. одна β-цепь фосфорилирует другую β-цепь той же молекулы рецептора. Это, в свою очередь, приводит к изменению субстратной специфичности тирозиновой протеинкиназы; теперь она способна фосфорилироватъ другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационными изменениями рецептора инсулина после связывания гормона и аутофосфорилирования. Ключевой белок, фосфорилируемый тирозиновой протеинкиназой, — субстрат инсулино-вого рецептора-1 (от англ, insulinreceptorsubstrate, IRS-I). Фосфорилированный IRS-I активирует ферменты, например тирозиновую фосфопротеинфосфатазу, и белки, участвующие в регуляции клеточных процессов. Дефосфорилирование рецептора под действием тирозиновой фосфопротеинфосфатазы возвращает его в неактивное состояние. Сродство рецептора к инсулину снижается при его фос-форилировании протеинкиназой А по аминокислотным остаткам серина и треонина. 3. Рецепторы с гуанлатциклазной активностью Гуанилатциклаза катализирует образование цГМФ из ГТФ, одного из важных посредников внутриклеточной передачи сигнала. Гуанилатциклаза находится в клетке, как в мембранносвязанном состоянии, так и в цитозольном. Соотношения этих двух форм фермента в различных тканях разное. Например, в клетках тонкого кишечника 90% гуанилатциклазы находится в мембранах, а в лёгких и печени — лишь 20%. Цитозольная и мембранносвязанная гуанилатциклазы различаются не только по локализации, но и по молекулярной массе, активности, способу регуляции. Цитозольная форма гуанилатциклазы состоит из двух субъединиц (α и β) и содержит в своём составе простетическую группу — гем. В области гема связывается активатор этой формы гуанилатциклазы — оксид азота (NO), образующийся из аргинина под действием фермента синтазы оксида азота. Мембранносвязанная гуанилащиклаза — трансмембранный гликопротеин. Внутриклеточный домен гуанилатциклазы проявляет каталитическую активность, внеклеточный домен служит рецептором. Присоединение активатора к рецептору вызывает изменение конформации в мембранном и цитозольном доменах и, как следствие, активацию гуанилатциклазы. В клетках тканей выявлены 3 основных типа внутриклеточных рецепторных белков, с которыми взаимодействует цГМФ: цГМФ-зависимая протеинкиназа (протеинкиназа G), цГМФ-регулируемые ионные каналы и цГМФ-регулируемая фосфодиэстераза, специфичная к цАМФ (катализирует превращение цАМФ в АМФ). цГМФ играет важную роль в регуляции Са2+-гомеостаза в различных типах клеток. Повышение концентрации цГМФ приводит к понижению концентрации Са2+ как в результате активации Са2+-АТФ-аз, так и за счёт подавления рецепторзависимого поступления этого иона в цитоплазму клетки. Эти эффекты опосредованы действием протеинкиназы G на мембранные белки, участвующие в обмене Са2+.
G-белки (ГТФ-связывающие белки) — универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала. G-белки — олигомеры, состоящие из α, β и γ-субъеди-ниц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъединицам. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка, вследствие альтернативного сплайсинга РНК. В структуре G-белков отсутствуют α-спиральные, пронизывающие мембрану домены. G-белки относят к группе «заякоренных» белков
Аденилатциклаза - фермент, катализирующий превращение АТФ в цАМФ, — ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток. Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Ци-топлазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ — вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А.
При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул — гормонов, нейромедиаторов, эйкозаноидов. Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs-рецептор сигнальной молекулы, которая активирует аденилатциклазу, и R-рецептор сигнальной молекулы, которая ингибирует аденилатциклазу; Gs-стимулирующий и Gi-ингибирующий аденилатциклазу белки; ферменты аденилатциклаза (АЦ) и протеинкиназа А. Последовательность событий, приводящих к активации аденилатциклазы: • связывание активатора аденилатциклазной системы, например гормона (Г) с рецептором (Rs), приводит к изменению конформации рецептора и увеличению его сродства к Gs-белку. В результате образуется комплекс [Г][R][G-ГДФ]; • присоединение [Г][R] к G-ГДФ снижает сродство α-субъединицы G-белка к ГДФ и увеличивает сродство к ГТФ. ГДФ замещается на ГТФ; • это вызывает диссоциацию комплекса. Отделившаяся субъединица α, связанная с молекулой ГТФ, обладает сродством к аденилатциклазе: [Г][R][G-ГТФ] → [Г][R] + α-ГТФ + βγ • взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конформации фермента и его активации, увеличивается скорость образования цАМФ из АТФ; • конформационные изменения в комплексе [α-ГТФ][АЦ] стимулируют повышение ГТФ-фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов реакции — неорганический фосфат (Рi)отделяется от α-субъединицы, а комплекс [α-ГДФ] сохраняется; скорость гидролиза определяет время проведения сигнала; • образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βγ-субъединицам. Gs-белок возвращается к неактивной форме; • если рецептор связан с активатором, например гормоном, цикл функционирования Gs белка повторяется. 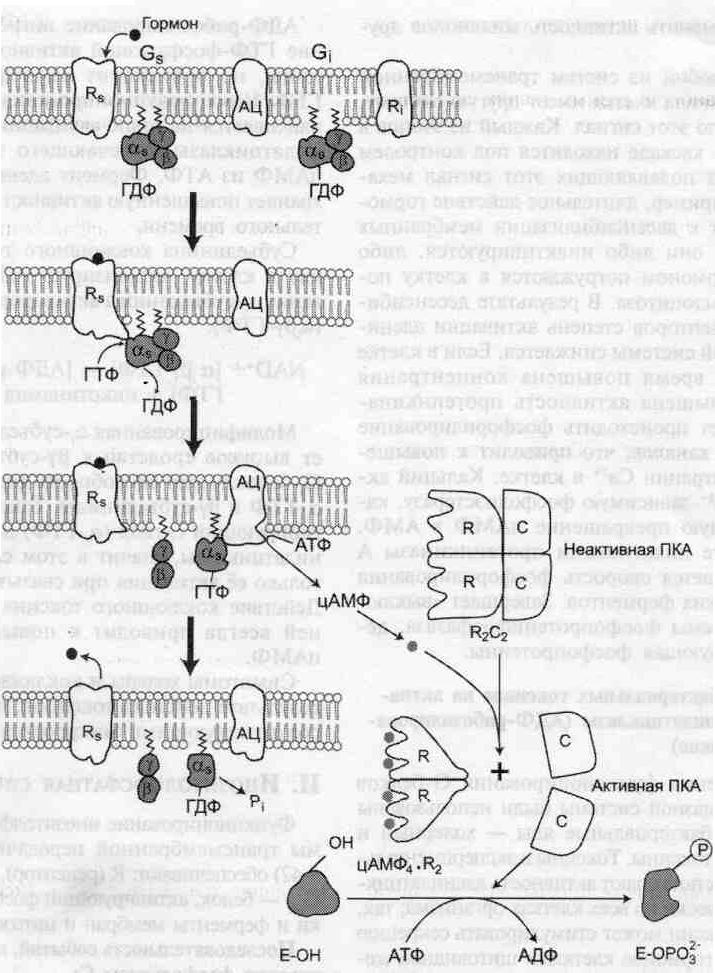 Активация протеинкиназы А (ПКА) • Молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами ПКА. • Присоединение цАМФ к регуляторным субъединицам (R) вызывает диссоциацию комплекса C2R2 на комплекс цАМФ4 R2и С + С. • Активная протеинкиназа А фосфорилирует специфические белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, а это приводит к изменению скорости и направления регулируемых ими процессов в клетке. • Концентрация цАМФ в клетке может регулироваться, она зависит от соотношения активностей ферментов аденилатциклазы и фосфодиэстеразы. Аденилатциклазная система Большую роль в регуляции внутриклеточной сигнальной системы играет белок AKAPS. «Заякоренный» белок AKAPS участвует в сборке ферментных комплексов, включающих не только протеинкиназу А, но и фосфодиэстеразу и фосфопротеинфосфатазу. Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая рецептор, может «включать» несколько G-белков, и затем каждый активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 102—103 раз. Образующийся цАМФ «включают» другой фермент — протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой А ещё больше усиливает сигнал, в результате суммарное усиление равно 106—107 раз. Таким образом, по механизму каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул. Но для любой из систем трансмембранной передачи сигнала клетка имеет другую систему, подавляющую этот сигнал. Каждый из этапов в ферментном каскаде находится под контролем специальных подавляющих этот сигнал механизмов. Например, длительное действие гормона приводит к десенсибилизации мембранных рецепторов: они либо инактивируются, либо вместе с гормоном погружаются в клетку посредством эндоцитоза. В результате десенсибилизации рецепторов степень активации аденилатциклазной системы снижается. Если в клетке длительное время повышена концентрация цАМФ (повышена активность протеинкиназы А), может происходить фосфорилирование кальциевых каналов, что приводит к повышению концентрации Са2+ в клетке. Кальций активирует Са2+-зависимую фосфодиэстеразу, катализирующую превращение цАМФ в АМФ. В результате инактивации протеинкиназы А (R2C2) снижается скорость фосфорилирования специфических ферментов. Завершает «выключение» системы фосфопротеинфосфатаза, де-фосфорилирующая фосфопротеины. Влияние бактериальных токсинов на активность аденилатциклазы (АДФ-рибозилирование G-белков) Для изучения функционирования G-белков аденилатциклазной системы были использованы экзогенные бактериальные яды — холерный и коклюшный токсины. Токсины в экспериментальных условиях повышают активность аденилатциклазы практически во всех клетках организма. Реакция разных клеток на холерный токсин вызвана повышением уровня цАМФ в этих клетках. Холерный токсин — олигомерный белок. Одна из субъединиц — фермент АДФ-рибозилтрансфераза; проникая в клетку, она катализирует присоединение АДФ-рибозы к аs-субъединице комплекса [αs-ГТФ][АЦ] (этап активации аденилатциклазы). NAD++ [αsГТФ][АЦ] → [АДФ-рибозил- αs ГТФ][АЦ] + никотинамид + Н+. АДФ-рибозилирование ингибирует проявление ГТФ-фосфатазной активности α5-субъеди-ницы, не происходит дефосфорилирование ГТФ. Цикл функционирования Gs-белка останавливается на этапе активации фермента аденилатциклазы, отвечающего за образование цАМФ из АТФ. Фермент аденилатциклаза сохраняет повышенную активность в течение длительного времени. Субъединица коклюшного токсина, проникая в клетку, катализирует АДФ-рибозилирование αi-субъединицы активированного Gi-белка (α1βγ-ГТФ). NAD++ [α1βγ-ГТФ] → [АДФ-рибозил- α1βγ-ГТФ] + никотинамид + Н+. Модифицированная α1-субъединица сохраняет высокое сродство к βγ-субъединицам, т.е. Gi-белок теряет способность диссоциировать на α1-ГТФ и βγ-субъединицы. Таким образом, ин-гибирующий сигнал (α1-ГТФ) не достигает аденилатциклазы, значит в этом случае возможна только её активация при связывании с αs-ГТФ. Действие коклюшного токсина на клетки тканей всегда приводит к повышению уровня цАМФ. Симптомы холеры и коклюша развиваются в результате действия токсинов, вырабатываемых соответствующими микроорганизмами. |
