Через эндокринные железы и гормоны, которые секретируются в кровь транспортируются по кровеносному руслу и связываются с рецепторами клетокмишеней и влияют на метаболизм различных клетокмишеней
 Скачать 197.57 Kb. Скачать 197.57 Kb.
|
|
15. Строение, биосинтез и механизм действия кальцитриола (витамина D3). Причины и проявления рахита. Как и другие стероидные гормоны, кальцитриол синтезируется из холестерола. Действие гормона направлено на повышение концентрации кальция в плазме крови. 1. Строение и синтез кальцитриола производное витамина D 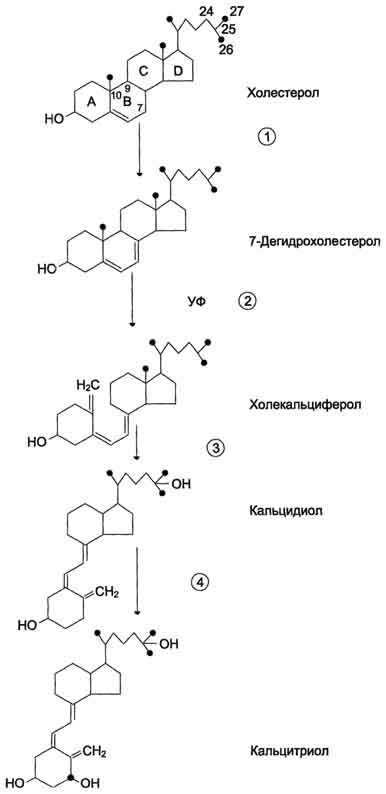 1 - холестерол является предшественником кальцитриола; 2 - в коже 7-дегидрохолестерол неферментативно превращается в холекальциферол; 3 - в печени 25-гидроксилаза превращает холекальциферол в кальцидиол; 4 - в почках образование кальцитриола катализируется 1α-гидроксилазой. Кальцитриол оказывает воздействие на тонкий кишечник, почки и кости. связывается с внутриклеточным рецептором клетки-мишени. Образуется комплекс гормон-рецептор, который взаимодействует с хроматином и индуцирует транскрипцию структурных генов, в результате чего синтезируются белки, опосредующие действие кальцитриола. В почках кальцитриол стимулирует реабсорбцию ионов кальция и фосфатов. При недостатке кальцитриола приводит к развитию рахита и остеомаляции. Рахит - заболевание детского возраста, связанное с недостаточной минерализацией костной ткани. Нарушение минерализации кости - следствие дефицита кальция. Рахит может быть обусловлен недостатком витамина D3 в пищевом рационе, нарушением всасывания витамина D3 в тонком кишечнике, снижением синтеза предшественников кальцитриГола из-за недостаточного времени пребывания на солнце, дефектом 1α-гидроксилазы, дефектом рецепторов кальцитриола в клетках-мишенях. Всё это вызывает снижение всасывания кальция в кишечнике и снижение его концентрации в крови, стимуляцию секреции паратгормона и вследствие этого мобилизацию ионов кальция из кости. 16. Гормоны коры надпочечников Надпочечники – железы внутренней секреции, в которых выделяют корковое и мозговое вещество. В корковом слое синтезируется гормоны стероидной природы, в мозговом веществе вырабатываются гормоны, производные аминокислот. Гормоны коры надпочечников (кортикостероиды): 1. Глюкокортикоиды Основной глюкокортикоид человека – кортизол Мишенями для глюкокортикоидов являются клетки печени, почек, лимфоидной, соединительной, мышечной, жировой тканей. - стимуляция глюконеогенеза - стимуляция липолиза в конечностях; - стимулируют синтез белков в печени; - повышают реабсорбцию натрия в почечных канальцах; 2. Минералокортикоиды Наиболее активный минералокортикоид – альдостерон Клетками – мишенями а являются клетки дистальных извитых почечных канальцев и клетки собирательных трубочек. 1. Повышение реабсорбции ионов натрия в клетки почечных канальцев; 2. Увеличение секреции ионов калия в первичную мочу. Нарушение секреции гормонов коры надпочечников. 1. Аддисонова болезнь («бронзовая болезнь»)– эндокинная болезнь обусловленная разрушением надпочечников или снижением их функции с возникающим в результате дефицитом гормонов надпочечников. Признаки:-снижается устойчивость к стрессовым ситуациям;-отмечается гипогликемия;нарушение водно – солевого обмена (потеря Na+, накопление К+ );мышечная слабость;пигментация; 2. Гиперсекреция: Болезнь Иценко-Кушинга - заболевание, при котором в гипофизе вырабатывается избыточное количество АКТГ), регулирующего работу надпочечников. Они увеличиваются в размере и усиленно вырабатывают свои гормоны .Признаки:- гипергликемия;-повышение АД;-повышение ионов Na+ в крови;- понижение ионов К+ в крови 17. Важнейшие параметры вводно-солевого гомеостаза - осмотическое давление….. Альдостерон - наиболее активный минералокортикостероид, синтезирующийся в коре надпочечников из холестерола. Минералокортикоиды вызывают усиление канальцевой реабсорбции катионов натрия, анионов хлора и усиливают канальцевую экскрецию катионов калия и способствуют переходу жидкости и натрия из сосудистого русла в ткани. вазопрессин - гормон гипоталамуса, который накапливается в задней доле гипофиза и оттуда секретируется в кровь. Секреция увеличивается при повышении осмолярности плазмы крови и при уменьшении объёма внеклеточной жидкости. Вазопрессин увеличивает реабсорбцию воды почкой, повышая концентрацию мочи и уменьшая её объём. ренин, протеолитический фермент, катализирует превращение ангиотензиногена в ангиотензин I; превращается в ангиотензин II; стимулирует синтез и секрецию альдостерона; ангйотензин II вызывает сужение сосудов периферических артерий; альдостерон стимулирует реабсорбцию Na+ и экскрецию К+ Основным механизмом возникновения гипертонической болезни является нервный механизм. Длительные и сильные напряжения нервной системы вызывают застойные очаги возбуждения в клетках коры головного мозга. Сначала это приводит к временным, затем к постоянным спазмам мелких сосудов и к повышению диастолического давления. Увеличивается нагрузка на левый желудочек сердца, и следовательно, повышается систолическое давление. В результате длительных спазмов артериол в сосудах развиваются склеротические изменения, что способствует сохранению и дальнейшему развитию гипертонии. 18..Мозговой слой надпочечников вырабатывает гормоны, относящиеся к катехоламинам. Основной гормон – адреналин, вторым по значимости является предшественник адреналина – норадреналин. Адреналин поступает в кровь постоянно, при кровопотере, стрессе, мышечной деятельности происходит увеличение его образования и выделения в кровь. Возбуждение симпатической нервной системы приводит к повышению поступления в кровь адреналина и норадреналина. Адреналин влияет на углеродный обмен, ускоряет расщепление гликогена в печени и мышцах, расслабляет бронхиальные мышцы, угнетает моторику жкт, повышает возбудимость и сократимость сердечной мышцы. Он повышает тонус кровеносных сосудов, действует сосудорасширяюще. усиливает работоспособность скелетных мышц. Адреналин – гормон короткого периода действия, он быстро разрушается моноаминоксидазой. Норадреналин выполняет функцию медиатора. Секреторная активность мозгового слоя надпочечников регулируется гипоталамусом. Биосинтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников. В одних гранулах содержится адреналин, в других норадреналин, а в некоторых - оба гормона. При стимуляции содержимое гранул высвобождается во внеклеточную жидкость. Адреналин взаимодействует как с α-, так и с β-рецепторами; норадреналин в физиологических концентрациях взаимодействует с α-рецепторами. 19 Гормоны поджелудочной железы Функции поджелудочной железы: Экзокринная функция заключается в синтезе и секреции пищеварительных ферментов. Эндокринную функцию выполняют клетки островковой части - В-клетки. - синтезируется - инсулин. - А-клетки - глюкагона. - D-клетках- соматостатин. - F-клетки секретируют панкреатический полипептид. Инсулин –Состоит из двух полипептидных цепе. предшественником инсулина является препроинсулин, который в результате гидролиза превращается в проинсулин.. Превращение неактивного проинсулина в активный инсулин происходит путем частичного протеолиза. В результате действия специфических протеаз образуется инсулин и С-пептид. Клетками – мишенями для инсулина являются клетки печени, жировой и мышечной тканей. Основным регулятором синтеза инсулина является глюкоза. Она стимулирует экспрессию гена инсулина.активирует секрецию инсулина, вызывая быстрое освобождение инсулина из секреторных гранул. Процесс секреции инсулина кальций – зависимый и при дефиците ионов кальция секреция инсулина снижается ^ Метаболические эффекты инсулина - Инсулин увеличивает транспорт глюкозы в клетках - Индукция синтеза глюкокиназы в клетках печени. - Усиление гликолиза - Стимуляция превращения глюкозы в жиры. - Стимулирует синтез жиров; - Тормозит липолиз. - Увеличение транспорта аминокислот в клетки; - Активация синтеза белка. Глюкагон - одноцепочечный полипептид. Биосинтез глюкагона происходит в α-клетках островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов. стимулирует мобилизацию основных энергоносителей - углеводов и жиров 20. Регуляция обмена основных энергоносителей. Изменения метаболизма в абсорбтивный и постабсорбтивный периоды. Изменения гормонального статуса и метаболизма при голодании. Основные пищевые вещества (углеводы, жиры, белки) окисляются в организме с освобождением свободной энергии, которая используется в анаболических процессах и при осуществлении физиологических функций. Основную роль в поддержании энергетического гомеостаза играют гормоны инсулин и глюкагон. а также другие контринсулярные гормоны - адреналин, кортизол, йодтиронины и соматотропин. Инсулин и глюкагон играют главную роль в регуляции метаболизма при смене абсорбтивного и постабсорбтивного периодов и при голодании. Изменения метаболизма в печени в абсорбтивном периоде После приёма пищи печень становится главным потребителем глюкозы, поступающей из пищеварительного тракта. Почти 60 из каждых 100 г глюкозы, транспортируемой портальной системой, задерживается в печени. Увеличение потребления печенью глюкозы - не результат ускорения её транспорта в клетки (транспорт глюкозы в клетки печени не стимулируется инсулином), а следствие ускорения метаболических путей, в которых глюкоза превращается в депонируемые формы энергоносителей: гликоген и жиры. При повышении концентрации глюкозы в гепатоцитах происходит активация глюкокиназы, превращающей глюкозу в глюкозо-6-фосфат. Глюкокиназа имеет высокое значение Кm для глюкозы, что обеспечивает высокую скорость фосфорилирования при высоких концентрациях глюкозы. Кроме того, глюкокиназа не ингибируется глюкозо-6-фосфатом (см. раздел 7). Инсулин индуцирует синтез мРНК глюкокиназы. Повышение концентрации глюкозо-6-фосфата в гепатоцитах обусловливает ускорение синтеза гликогена. Этому способствуют одновременная инактивация гликогенфосфорилазы и активация гликогенсинтазы. Под влиянием инсулина в гепатоцитах ускоряется гликолиз в результате повышения активности и количества ключевых ферментов: глюкокиназы, фосфофруктокиназы и пируваткиназы. В то же время происходит торможение глюконеогенеза в результате инактивации фруктозо-1,6-бисфосфатазы и снижения количества фосфоенолпируваткарбоксикиназы - ключевых ферментов глюконеогенеза. Повышение концентрации глюкозо-6-фосфата в гепатоцитах в абсорбтивном периоде, сочетается с активным использованием NADPH для синтеза жирных кислот, что способствует стимуляции пентозофосфатного пути. Ускорение синтеза жирных кислот обеспечивается доступностью субстратов (ацетил-КоА и NADPH), образующихся при метаболизме глюкозы, а также активацией и индукцией ключевых ферментов синтеза жирных кислот. В абсорбтивном периоде в печени ускоряется синтез белков. Однако количество аминокислот, поступающих в печень из пищеварительного тракта, превышает возможности их использования для синтеза белков и других азотсодержащих соединений. Излишек аминокислот либо поступает в кровь и транспортируется в другие ткани, либо дезаминируется с последующим включением безазотистых остатков в общий путь катаболизма. Постабсорбтивный период. Постабсорбтивным состоянием называют период после завершения пищеварения до следующего приёма пищи. Если пища не принимается в течение суток и более, то это состояние определяют как голодание. Типичным постабсорбтивным периодом считают состояние после 12-часового ночного перерыва в приёме пищи. В начале постабсорбтивного периода концентрация глюкозы в крови снижается, вследствие чего снижается секреция инсулина и повышается концентрация глюкагона. При снижении индекса инсулин/глюкагон ускоряются процессы мобилизации депонированных энергоносителей. В постабсорбтивном периоде изменения метаболизма направлены, главным образом, на поддержание концентрации в крови глюкозы, которая служит основным энергетическим субстратом для мозга и единственным источником энергии для эритроцитов. Основные изменения метаболизма в этот период происходят в печени и жировой ткани. Изменения метаболизма в печени. В печени прежде всего ускоряется мобилизация гликогена (см. раздел 7). Однако запасы гликогена в печени истощаются в течение 18-24 ч голодания. Главным источником глюкозы по мере исчерпания запасов гликогена становится глюконеогенез, который начинает ускоряться через 4-6 ч после последнего приёма пищи. Субстратами для синтеза глюкозы служат глицерол, аминокислоты и лактат. При высокой концентрации глюкагона скорость синтеза жирных кислот снижается вследствие фосфорилирования и инактивации ацетил-КоА-карбоксилазы, а скорость р-окисления возрастает. Вместе с тем увеличивается снабжение печени жирными кислотами, которые транспортируются из жировых депо. Ацетил-КоА, образующийся при окислении жирных кислот, используется в печени для синтеза кетоновых тел. Изменения метаболизма в жировой ткани. В жировой ткани при повышении концентрации глюкагона снижается скорость синтеза ТАГ и стимулируется липолиз. Стимуляция липолиза - результат активации гормончувствительной ТАГ-липазы адипоцитов под влиянием глюкагона. Жирные кислоты становятся важными источниками энергии в печени, мышцах и жировой ткани. Таким образом, в постабсорбтивнрм периоде концентрация глюкозы в крови поддерживается на уровне 80-100 мг/дл, а уровень жирных кислот и кетоновых тел возрастает. Изменение гормонального статуса и метаболизма при голодании. Голодание может быть кратковременным, в течение суток (I фаза), продолжаться в течение недели (II фаза) или нескольких недель (III фаза). В отсутствие пищи в крови снижается уровень глюкозы, аминокислот и триацилглицеролов. Инсулинглюкагоновый индекс снижается, и повышается концентрация контринсулярных гормонов, в первую очередь кортизола. В этих условиях возникает состояние, для которого характерно преобладание процессов катаболизма жиров, гликогена и белков на фоне общего снижения скорости метаболизма. Под влиянием контринсулярных гормонов в этот период происходит обмен субстратами между печенью, жировой тканью, мышцами и мозгом. Этот обмен служит двум целям: 1) поддержанию концентрации глюкозы в крови для обеспечения глюкозозависимых тканей (мозга, эритроцитов); 2) мобилизации других источников энергии, в первую очередь жиров, для обеспечения энергией всех других тканей. Вследствие переключения метаболизма на режим мобилизации энергоносителей даже после 5-6 нед голодания концентрация глюкозы в крови составляет не менее 60 мг/дл. Обмен углеводов. Так как за счёт мобилизации гликогена обеспечивается только кратковременное голодание, основным источником глюкозы при длительном голодании служит глюконеогенез, а основными субстратами глюконеогенеза - аминокислоты, лактат и глицерол. При низкой концентрации инсулина глюкоза используется только инсулиннезависимыми тканями, в основном мозгом, эритроцитами. Обеспечение энергетических потребностей других тканей происходит за счёт жирных кислот и кетоновых тел. Обмен жиров. Жирные кислоты, образующиеся в процессе мобилизации жиров в жировых депо, становятся основными источниками энергии для большинства органов в первый период голодания. Во II фазе мобилизация жиров продолжается, и концентрация жирных кислот в крови увеличивается в 3-4 раза по сравнению с постабсорбтивным состоянием. Синтез кетоновых тел начинается в первые дни голодания. Во II фазе голодания скорость синтеза кетоновых тел значительно возрастает. Концентрация кетоновых тел в крови в этот период может достигать 20-30 мг/дл (в норме 1-3 мг/дл). Используются кетоновые тела, в основном, в мышцах. В этот период голодания часть энергетических потребностей мозга обеспечивается кетоновыми телами, а скорость окисления кетоновых тел в мышцах снижается. Обмен белков. В течение нескольких первых дней голодания быстро распадаются мышечные белки - основной источник субстратов для глюконеогенеза. При голодании более 3 нед скорость катаболизма белков стабилизируется и составляет примерно 20 г в сутки. В этот период увеличивается потребление мозгом кетоновых тел, а скорость глюконеогенеза снижается. Снижение скорости глюконеогенеза способствует сбережению белков. В этот период и для мозга кетоновые тела становятся значительным источником энергии. Однако для окисления кетоновых тел необходимы оксало-ацетат и другие компоненты ЦТК. В норме они образуются из глюкозы и аминокислот, а приголодании - только из аминокислот. При продолжительности голодания более 4 недель развиваются атрофические процессы, в результате которых происходит потеря значительного количества белков. В теле человека массой 70 кг масса белков составляет 15 кг. При потере 1/3-1/2 белков наступает смерть. 21. Инсулинзависимый сахарный диабет - заболевание, вызываемое разрушением р-клеток островков Лангерханса поджелудочной железы.развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени Изменения метаболизма при сазарном диабетеПри сахарном диабете соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния. Для всех форм диабета характерно повышение концентрации глюкозы в крови.После приёма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде. Повышение концентрации глюкозы в плазме крови обусловлено снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях. К характерным признакам сахарного диабета относят повышение концентрации в крови кетоновых тел - кетонемия. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз. Ещё один характерный признак СД- повышенный уровень в крови ли-попротеинов. При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Высокие концентрации глюкозы, кетоновых тел, мочевины требуют усиленной экскреции их из организма. Поскольку концентрационная способность почек ограничена, резко увеличивается выделение большого количества воды, в результате чего может наступить обезвоживание организма. 22. Мужские половые гормоны вырабатываются в основном в клетках Лейдига семенников Небольшое количество андрогенов образуется в коре надпочечников. Предшественником андрогенов служит холестерол Тестостерон. Превращение прегненолона в тестостерон катализируется пятью микросо-мальными ферментам. Гормон циркулирует в крови в связанном с белками плазмы состоянии: Лишь 2% от общего количества гормона в крови транспортируется в свободном виде Дигидротестостерон. В семенных канальцах, предстательной железе, коже, наружных половых органах тестостерон служит предшественником более активного дигидротестостерона. 2. Регуляция синтеза и секреции андрогенов В препубертатный период секреция андрогенов подавляет по механизму отрицательной обратной связи секрецию гонадотропина до начала пубертатного периода. Это приводит к освобождению ЛГ и ФСГ. ЛГ, связьюаясь с рецепторами клеток Лейдига, стимулирует образование тестостерона интерстициальными клетками Лейдига, а ФСГ, связываясь с рецепторами клеток Сертоли в семенниках, стимулирует сперматогенез. Тестостерон замыкает отрицательную обратную связь на уровне гипофиза и гипоталамуса, уменьшая частоту секреторных импульсов ЛГ. У эмбриона под действием андрогенов из вольфова протока образуются придаток яичка, семявыносящий проток и семенной пузырёк. У плода мужского пола происходит маскулинизация мозга. повышенный уровень андрогенов в препубертатный период приводит к увеличению линейных размеров тела, скелетных мышц, росту костей. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса . Женские половые гормоны В яичниках синтезируются женские половые гормоны - эстрогены и прогестины, среди которых наиболее активны 17β-эстрадиол и прогестерон. В детском возрасте незрелые яичники вырабатывают небольшое количество гормонов, поэтому концентрация эстрогенов в крови низкая. В пубертатный период чувствительность гипоталамо-гипофизарной системы к действию ЛГ и ФСГ снижается. В начале каждого менструального цикла секреция ФСГ и ЛГ вызывает развитие первичных фолликулов. Созревающий фолликул в результате совместного действия ЛГ,и ФСГ секретирует эстрогены, которые по механизму отрицательной обратной связи угнетают секрецию ФСГ. По мере созревания фолликула концентрация эстрадиола повышается, чувствительность гипофизарных клеток к гонадолиберину возрастает, и эстрадиол повышает секрецию ЛГ и ФСГ. Повышение секреции ЛГ приводит к овуляции. После овуляции клетки гранулёзы превращаются в жёлтое тело, которое, помимо эстрадиола, начинает вырабатывать всё большее количество - прогестерона. Если возникает беременность, жёлтое тело продолжает функционировать и секретировать прогестерон, однако на более поздних этапах беременности прогестерон в основном продуцируется плацентой. Если оплодотворение не происходит, высокая концентрация прогестерона в плазме крови по механизму отрицательной обратной связи угнетает активность гипоталамо-гипофизарной системы, тормозится секреция ЛГ и ФСГ, жёлтое тело разрушается, и снижается продукция стероидов яичниками. Наступает менструация Эстрогены стимулируют развитие тканей, участвующих в размножении, определяют развитие многих женских вторичных половых признаков, регулируют транскрипцию гена рецептора прогестина. Эстрогены оказывают анаболическое действие на кости и хрящи.
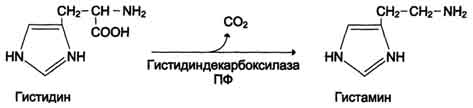
23. Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, - высокоактивные регуляторы клеточных функций. оказывают эффекты как "гормоны местного действия", влияя на метаболизм продуцирующей их клетки по аугокзэинному механизму, и на окружающие клетки - по паракринному механизму. Эйкозаноиды: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. 24.гистамин Синтез и биологическая роль гистамина Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции:
25. серотонин Синтез и биологическая роль серотонина Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин) Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции. Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках. 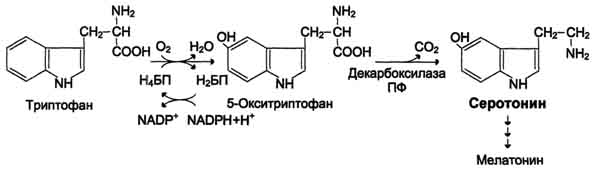 26. биологические активные пептиды Брадикинин — пептид, расширяющий кровеносные сосуды и потому снижающий артериальное давление. Ингибиторы АПФ[1], которые используются для снижения артериального давления, повышают уровень брадикинина. Брадикинин воздействует на кровеносные сосуды, высвобождая простациклин, оксид азота(II). Брадикинин — это физиологически и фармакологически активный пептид из кининовой группы белков, состоящий из девяти аминокислот. Считается, что брадикинин является основным фактором, обеспечивающим болевую чувствительность, являясь плазменным алгогеном. Нейропепти́ды — пептиды (разновидность молекул белка), образующиеся в центральной или периферической нервной системе и регулирующие физиологические функции организма человека и животных. Синтез Вначале на рибосомах синтезируются более длинные полипептидные цепи — предшественники. Они обязательно начинаются с сигнальной последовательности, которая необходима для проникновения полипептида во внутреннее пространство эндоплазматической сети. Далее белки-предшественники транспортируются в мембранных пузырьках к нервным окончаниям и расщепляются протеазами в определенных местах. Нередко при этом высвобождается сразу несколько активных пептидов. В промежуточной доле гипофиза при расщеплении единого белка-предшественника проопиомеланокортинаобразуются, в зависимости от способа протеолиза,
|
