венозное полнокровие. инфа. Циркуляторные расстройства в печени
 Скачать 213.84 Kb. Скачать 213.84 Kb.
|
|
Патогенез обструкции и тромбоза портальной вены Портальная вена образуется слиянием селезеночной и верхней брыжеечной вен. Места обструкции и тромбоза локализуются выше уровня этого слияния. При циррозе печени и злокачественных опухолях процесс тромбирования портальной вены начинается в ее внутрипеченочном отделе и распространяется на внепеченочную часть. При тромбозе, вызванном другими причинами, патологический процесс возникает в месте начала портальной вены. Тромбоз селезеночной вены, который наблюдается при хроническом панкреатите , также распространяется и на портальную вену. Обструкция портальной вены не нарушает функцию печени до тех пор, пока у пациента не возникнет заболевание печени (например, цирроз). Это происходит за счет компенсаторного усиления кровотока в системе печеночных артерий. Среднее время формирования коллатерального кровообращения составляет 5 недель; при остром тромбозе - 12 дней. При этом риск возникновения кровотечения из варикозно-расширенных вен пищевода, желудка и кишечника повышается. Развивается асцит . Кавернозная мальформация портальной вены (т.е. развитие перипортальных коллатералей) возникает при длительном течении тромбоза портальной вены в результате разрастания мелких сосудов вокруг места тромбоза. Скорость кровотока по этим сосудам составляет 2-7 см/сек. На снимках, выполненных в ходе эндоскопической ретроградной холангиогепатографии, у пациентов с портальной гипертензией кавернозная трансформация портальной вены выглядит как губкоподобная масса, расположенная под печенью. Аналогичные данные можно получить и у пациентов с гемангиосаркомой поджелудочной железы, и у больных псевдохолангиосаркомой. После выполнения трансюгулярного внутрипеченочного портосистемного шунтирования и устранения явлений портальной гипертензии кавернозная мальформация портальной вены на снимках не визуализируется. Эпидемиология Обструкция портальной вены диагностируется у 5-18% пациентов с циррозом печени . Частота возникновения тромбоза портальной вены у пациентов с гепатоцеллюлярной карциномой составляет 30%; у больных циррозом печени - 5%. Смерть при обструкции портальной вены обусловлена возникновением кровотечений из варикозно-расширенных вен желудка, пищевода и кишечника. Риск появления кровотечений в течение 2 лет у пациентов без цирроза печени составляет 0,25%, а смертность - 5%. Аналогичные показатели у больных циррозом печени: 20-30% и 30-70% соответственно. У пациентов с тромбозом портальной вены показатели 10-летней выживаемости составляют 38-60%; у детей - 70%. Клиническая картина Клинические критерии диагностики асцит, кровотечения из варикозно расширенных вен пищевода, портальная гипертензия, печеночная недостаточность Cимптомы, течение Течение тромбоза портальной вены может быть острым и хроническим. В некоторых случаях острая фаза заболевания может протекать бессимптомно. Для хронического течения тромбоза портальной вены характерно длительное развитие клинической симптоматики (от нескольких месяцев до нескольких лет). Острое течение тромбоза портальной вены. У пациентов внезапно появляются боли в правом верхнем квадранте живота; беспокоит тошнота; может повышаться температура тела. Развивается асцит . Могут возникать желудочно-кишечные кровотечения. Хроническое течение тромбоза портальной вены. В хронической фазе тромбоз портальной вены может манифестировать симптомами портальной гипертензии . В 90% случаев в период 4-12 лет от начала формирования тромбоза возникает кровотечение из варикозно-расширенных вен пищевода, желудка и кишечника. При наличии цирроза печени и признаков печеночной недостаточности , у пациентов с тромбозом портальной вены наблюдаются симптомы печеночной энцефалопатии, развивается асцит . При этом асцит и печеночная энцефалопатия - редкие осложнения, если у больного нет цирроза печени. Если у пациента имеются злокачественные новообразования, то симптомами тромбоза портальной вены являются: асцит , анорексия, снижение массы тела, боли в эпигастральной области или в верхнем правом квадранте живота. КИАРИ БОЛЕЗНЬ (H. Chiari, австрийский патолог, 1851—1916; син.: облитерирующий эндофлебит печеночных вен, первичный тромбоз печеночных вен) — заболевание, обусловленное частичной или полной непроходимостью печеночных вен и характеризующееся явлениями портальной гипертензии, асцитом и печеночной недостаточностью. Бадд (G. Budd) в 1846 г., рассматривая случай такой болезни, указывал, что первое клин, описание подобного состояния, сделанное в 1842 г., принадлежит Ламброану (Lambroan). Описание патол, изменений в организме человека при облитерирующем эндофлебите печеночных вен представил в 1899 г. Киари. В отечественной литературе сообщение об этом заболевании впервые было сделано в 1905 г. А. И. Абрикосовым. Некоторые авторы пользуются термином «болезнь Киари» для обозначения первичного облитерирующего эндо-флебита печеночных вен. Для всех прочих состояний, вызывающих препятствие оттоку крови из печени, предложен термин «синдром Бадда — Киари», хотя многие авторы употребляют этот термин в качестве синонима К. б. К 1978 г. -описано ок. 200 случаев К. б., изученных отечественными и зарубежными авторами. К. б.— редкое заболевание, развивающееся обычно в возрасте от 20 до 40 лет, хотя описаны отдельные случаи его у детей раннего возраста и новорожденных. Различают острую и хрон, формы К. б. Этиология и патогенез Причины возникновения Киари болезни самые различные: первичное воспаление (эндофлебит), спонтанный тромбоз, врожденные аномалии развития, повышение коагулирующих свойств крови, вторичные — вследствие закупорки нижней полой вены, внутрипеченочных или внепеченочных заболеваний. К числу последних относится пилефлебит (см.) — гнойное или гнилостное воспаление воротной вены в результате перехода воспалительного процесса на стенку вены с окружающих тканей (перифлебит, перипортальный лимфангиит), с соседних органов на стенку сосуда (воспаление червеобразного отростка, пенетрирующие язвы желудка и двенадцатиперстной кишки, толстой кишки, поддиафрагмальный абсцесс, абсцессы селезенки, печени, нагноившиеся лимф, мезентериальные узлы, гнойные процессы пупочной раны с развитием гнойного пилефлебита у новорожденных). Пилефлебит может ограничиться основным стволом воротной вены, однако чаще распространяется на ее внутрипеченочные разветвления, являясь источником абсцессов печени. Пилефлебит также может вести к облитерации сосуда с исходом в флебосклероз (см.). У большинства больных явных причин развития К. б. не обнаруживается. Большие трудности возникают при толковании механизма тромбозов печеночных вен: одни авторы считают, что первично возникает эндофлебит печеночных вен, осложняющийся затем тромбозом, другие, рассматривая внутрисосудистый тромбоз как ведущий процесс, оценивают фиброз как результат организации пристеночных тромбозов, а изменения свободных от тромбов сосудов связывают с хрон, венозным застоем. Патологическая анатомия 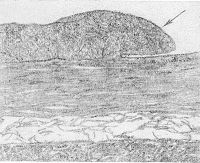 Рис. 1. Микропрепарат продольного среза нижней полой вены при болезни Киари: стрелкой указан подушковидный пристеночный тромб у места впадения печеночной вены.  Рис. 2. Микропрепарат крупной облитерированной печеночной вены при болезни Киари: 1— фиброзное утолщение стенки сосуда; 2— васкуляризованный обтурирующий тромб; 3—частично восстановленный просвет сосуда; 4— новообразованные мелкие сосуды в толще тромба. 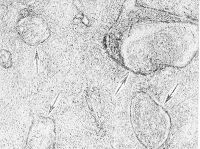 Рис. 3. Микропрепарат печени при болезни Киари: стрелками указаны Облитерирующие тромбы в просвете мелких печеночных вен с неравномерным фиброзным утолщением их стенок. Патологическая анатомия характеризуется тяжелыми морфологическими изменениями печени от резкого застойного полнокровия до застойного цирроза, обусловленными частичной или полной непроходимостью вен. Патология печеночной и нижней полой вены многообразна как по локализации, так и по характеру морфологических изменений. Поражение печеночных вен возможно как изолированное, так и сочетанное — с поражением нижней полой вены (оно может быть первичным и вторичным). При поражении только печеночных вен патол, процесс начинается с фиброза, затем развивается тромбоз (см.) и сужение устья печеночных вен на месте впадения их в нижнюю полую вену (рис. 1). Тромбоз и фиброзное утолщение стенок распространяются от устья на сосуды крупного и среднего калибра. Свежие пристеночные тромбы, постепенно прорастая соединительной тканью со стороны внутренней оболочки сосуда, превращаются в организованные тромбы, обтурирующие просвет. Иногда печеночная вена с фиброзно утолщенными стенками и облитерированным просветом может подвергнуться реканализации (рис. 2) с частичным восстановлением кровообращения. Изредка процессы тромбообразования и фиброза стенок могут распространяться и на более мелкие разветвления печеночных вен, сопровождаясь фиброзным утолщением их стенок и обтурацией просвета (рис. 3). Описанные процессы протекают медленно, без морфол. признаков воспаления и потому должны рассматриваться как флебофиброз и флеботромбоз (см.). 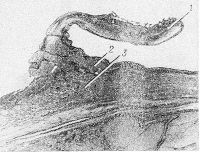 Рис. 4. Микропрепарат поперечного среза нижней полой вены при болезни Киари: 1— венозная мембрана в просвете сосуда; 2— внутренние слои эластических волокон стенки нижней полой вены, распространяющиеся на мембрану по ее поверхности; 3— очаговое скопление гиалинизированных пучков коллагеновых волокон в глубоком слое стенки, образующих составную часть мембраны Основную роль играет структурное поражение нижней полой вены на разных ее уровнях. Оно может быть сочетанным с поражением печеночных вен. Поражение связано с наличием мембран, вызывающих окклюзию сосуда на уровне заднепеченочного сегмента, на диафрагмальном и околопредсердном уровнях (у места впадения нижней полой вены в правое предсердие). Мембраны располагаются в просвете сосуда поперечно, прикрепляясь к внутренней окружности стенок, могут быть полными или неполными. Гистологически мембрана состоит из соединительной ткани, богатой эластическими волокнами, полностью соответствуя строению стенки нижней полой вены и являясь частью ее (рис. 4). Одной из разновидностей мембран является персистирующий клапан нижней полой вены (евстахиева заслонка) или его остатки, располагающиеся у самого входа нижней полой вены в правое предсердие. При изолированном поражении нижней полой вены наблюдается стеноз (по-видимому, врожденный), конусообразно суживающийся, оканчивающийся атрезией, а также опоясывающий стеноз, возможно, в результате стягивания мембраны. Встречается также опухолевая обтурация вследствие разрастания первичной сосудистой опухоли нижней полой вены или опухоли почки через почечную вену в нижнюю полую вену. Тромбоз и опухолевая обтурация, возникшие в поддиафрагмальной части нижней полой вены, могут распространиться и на печеночные вены. Вторичная непроходимость печеночных вен может возникнуть в результате их сдавления при различных заболеваниях печени и других внутренних органов. Изменения печени при К. б. вторичны. При острой форме печень увеличена, с гладкой напряженной поверхностью, багрово-синеватого цвета, с просвечивающим сквозь капсулу мускатным рисунком: характерным является увеличение хвостатой (спигелиевой) доли печени. При микроскопическом исследовании выявляется картина застойной атрофии: центральные вены и синусоиды резко расширены и полнокровны, печеночные клетки атрофированы. Иногда часть дольки заполнена кровью, гепатоциты сохраняются лишь по периферии вокруг портального тракта. Между зонами кровоизлияний и сохранившимся портальным трактом выявляются резко расширенные синусоиды. В хвостатой доле пролиферативно-регенераторные процессы и отек. В просвете расширенных печеночных вен красные свежие тромбы, пристеночные или обтурирующие. Селезенка не увеличена или увеличена мало. Наблюдается значительный асцит. Острая форма К. б. встречается чаще при изолированном поражении печеночных вен. При хрон, течении К. б. на передней брюшной стенке видны расширенные коллатерали. Печень увеличена, неравномерно бугриста, с западающими участками застойной атрофии, иногда уродливой формы за счет чрезмерно увеличенной хвостатой доли. На разрезе печень пронизана тяжами соединительной ткани; сочетание желтоватых некротических очагов кровоизлияний и коричневато-красных участков застойной индурации создает неоднородную пеструю картину. Стенки печеночных вен крупного и среднего калибра утолщены, закрыты тромбами, частично васкуляризованными. Селезенка увеличена, плотная; в брюшной полости асцит. При микроскопии печени обнаруживается картина застойного фиброза печени: на месте погибшей паренхимы в центре долек разрастаются ретикулиновые и коллагеновые волокна. Поля центрального фиброза соседних долек сливаются, образуя соединительнотканные прослойки. Вокруг портальных трактов происходит регенерация и компенсаторная гипертрофия гепатоцитов. В последующем соединительнотканные прослойки, разрастаясь, приводят к нарушению архитектоники печени и развитию цирроза. При длительном течении процесса обычно обнаруживается цирроз печени (см.). Клиническая картина Острая форма наблюдается примерно в 20% всех случаев К. б. При этом неопределенные абдоминальные явления иногда предшествуют острым, резким болям в животе. Боли могут появиться внезапно, иррадиируют в спину или правый бок и сопровождаются быстрым и массивным увеличением печени. Пальпаторно поверхность печени гладкая и болезненная, как при так наз. застойной печени. Желтуха обычно слабо выражена, показатели функц, состояния печени не всегда изменены. Бурно нарастает асцит (см.), плохо поддающийся терапии, возможен шок, иногда пищеводно-желудочное кровотечение (см. Желудочно-кишечное кровотечение) с одновременным развитием тяжелой печеночной недостаточности (см.). При хрон, форме наблюдаются постепенное увеличение печени, боли в животе различной выраженности, асцит. Заметно развито коллатеральное кровообращение на передней и боковых стенках брюшной полости. Повышенное печеночное давление (см. Портальная гипертензия) и интенсивное лимфообразование благоприятствуют просачиванию через печеночную капсулу богатой белком жидкости, чем объясняется наличие значительного количества белка в асцитической жидкости. Селезенка иногда увеличивается. При окклюзии нижней полой вены наблюдаются развитая сеть кава-кавальных коллатералей по боковым отделам брюшной стенки (снизу вверх), значительные отеки нижних конечностей, альбуминурия. В некоторых наблюдениях отмечается слабая и умеренная желтуха. Смерть больных при хрон, форме чаще наступает от присоединения тромбоза брыжеечных сосудов, острой блокады печеночных вен и тяжелой печеночной недостаточности. Диагноз Заболевание возможно у лиц с предрасполагающими к его развитию причинами в том случае, если у них обнаруживается увеличение печени и стойкий асцит в сочетании с другими симптомами заболевания. Вспомогательным диагностическим признаком К. б. может служить отсутствие гепатоюгулярного рефлюкса при надавливании на увеличенную печень. Диагностике способствуют рентгенол, и инструментальное исследование системы воротной вены, перитонеоскопия (см.), пункция печени (см.) и исследование портального давления. Общая информация Краткое описание Веноокклюзионная болезнь (синдром синусоидальной обструкции (ССО)) - нетромботическая окклюзия печеночных венул соединительной тканью. Крупные вены остаются интактными. Период протекания Описание: При синдроме синусоидальной обструкции (ССО), связанном с трансплантацией, пик манифестации происходит на 12-й день. Критерии диагностики ССО подразумевают полное развитие клинических признаков к 20-м суткам. Однако у 29-55% детей, которым не применялся циклофосфамид после трансплантации, клинические диагностические критерии формируются позже (после 20-ти суток). Классификация 1. Отдельные авторы выделяют 2 вида течения синдрома синусоидальной обструкции (ССО): - острое (связанное с трансплантацией) - развивается и диагностируется в сроки до 20 дней; - хроническое (связанное с токсическими поражениями) - клиника манифестирует в сроки более 100 дней. Клиническая ценность этой классификации сомнительна, так как возможны различные по срокам варианты манифестации. 2. Было предложено классифицировать ССО по тяжести: 2.1 Легкая тяжесть. Больные, которые соответствует диагностическим критериям ССО, но не нуждаются в лечении отеков и/или асцита, не нуждаются в лекарствах для купирования боли в правом подреберье и течение заболевания заканчивается самопроизвольным выздоровлением (самокупирующаяся форма заболевания). 2.2 Умеренная тяжесть. Больные соответствуют критериям ССО, нуждаются в медикаментозном лечении отеков и болей, лечение полностью купирует симптомы. При ССО, связанном с токсическими поражениями, заболевание имеет в основном подострое и хроническое течение. 2.3 Тяжелая форма. Заболевание приводит к смерти или не разрешается по истечении 100 дней с применением всех возможных форм терапии. Клиническая ценность этой классификации сомнительна для диагностики и/или выбора тактики и имеет значение в основном для ретроспективных исследований. Этиология и патогенез Этиология 1. Трансплантация костного мозга, печени, лечение стволовыми клетками. Ранее 25% случаев веноокклюзионной болезни были связаны с трансплантологией, однако по мере увеличения количества пересадок органов и тканей их роль выходит на первый план. 2. Воздействие токсических факторов: 2.1 Лекарственное поражение: преимущественно иммуносупрессивная (азатиоприн, бусульфан, циклофосфамид, даунорубицин, тиогуанин), арсфенамин (сальварсан), уретан, актиномицин Д. 2.2 Лучевая терапия. 2.3 Прием некоторых растительных пирролизидиновых алкалоидов (растения рода Crotalaria, Senecio - крестовники, Heliotropium - буранчиковые) в виде растительных чаёв (отсюда второе название заболевания - "Ямайская чайная болезнь" - Jamaican bush tea disease). Однако чаще всего отравления растительными алкалоидами носят случайный характер и обусловлены контактом пищи с вышеперечисленными растениями. Патофизиология остается неясной. Первичное повреждение, скорее всего, протекает как поражение синусоидальных эндотелиальных клеток печеночной венулы. Первые визуализируемые гистологические изменения характеризуются расширением субэндотелиальной зоны, экстравазацией эритроцитов, отложением фибрина и экспрессией фактора VIII (фактора фон Виллебранда) в стенах венул, с последующим перивенулярным некрозом гепатоцитов. Поздние гистологические признаки включают в себя отложения внеклеточного матрикса, увеличение числа звездчатых клеток и последующий синусоидальный фиброз. Этот процесс в конечном итоге приводит к полному уничтожению венул, обширному гепатоцеллюлярному некрозу и к массивному фиброзу и склерозу печеночной ткани. Многочисленные исследования показали ассоциации с различными гемостатическими расстройствами, однако никаких убедительных доказательств тромботической природы происхождения синдрома синусоидальной обструкции выявлено не было. Эпидемиология Признак распространенности: Крайне редко Заболевание встречается крайне редко, во всех возрастных группах. Различий по полу и расе не выявлено. Частота синдрома синусоидальной обструкции после трансплантаций определена как 5-60% вне зависимости от пола, возраста и расы. Факторы и группы риска Поскольку синдром синусоидальной обструкции по большей части связан с пересадкой костного мозга, следующие факторы риска должны быть определены и оценены до операции: 1. Патология печени (например, фиброз печени, гепатит, лучевая терапия органов брюшной полости, предтрансплантационное повышение трансаминаз неясного происхождения). 2. Использование миелоаблативного режима кондиционирования при трансплантации. 3. Кондиционирование бусульфаном, мелфаланом или обоими препаратами. 4. Применение циклофосфамида, кармустина (BCNU) и этопозида. 5. Применение препарата гемтузумаб озогамицин (Mylotarg, Pfizer), снят с рынка США в июне 2010 года. 6. Остеопетроз ("Остеопетроз" - Q78.2). 7. Трансплантация аллогенных гемопоэтических клеток при рецидиве лейкемии. 8. Неконтролируемая активация макрофагов (например, гемофагоцитарный лимфогистиоцитоз, синдром Грисцелли, гемофагоцитарный синдром). 9. Пожилой или дошкольный (менее 6,5 лет) возраст реципиента. 10. Доза облучения более 12 Грей. Клиническая картина Клинические критерии диагностики увеличение веса; гепатомегалия; слабость; отеки; асцит; субиктеричность склер; олигоурия; боли в области печени Cимптомы, течение Общие положения 1. Диагностические критерии: 1.1 Диагностические критерии синдрома синусоидальной обструкции (ССО) имеют специфичность около 90% и чувствительность около 50%(исследовательская группа Сиэтла - Seattle criteria, 1993). Определены как наличие 2-х или более из следующих признаков, возникающих в течение 20 дней после трансплантации: - гепатомегалия и слабая болезненность в области печени; - внезапное увеличение веса более чем на 2% от исходного веса тела (асцит, отеки); - общий уровень билирубина в сыворотке крови более 2,0 мг/дл (34,2 мкмоль/л). При присутствии 2-х из 3-х признаков, наличие ССО было подтверждено комплексным исследованием в последующем только в 42-56% случаев; при наличии всех 3-х признаков ССО был подтвержден в 91%. 1.2 Диагностические критерии ССО (исследовательская группа Балтимора - Baltimore criteria, 1987) включают в себя в качестве обязательного признака гипербилирубинемию (≥ 2 мг/дл) и 2 или более из следующих признаков, которые должны присутствовать в течение 21 дня после трансплантации стволовых клеток: - гепатомегалия (как правило, в сочетании с болезненностью в области печени); - асцит; - прибавка в весе более чем на 5% выше заданного диапазона. Балтиморские критерии являются менее чувствительными и специфичными по сравнению с диагностическими критериями Сиэтла. 2. Хроническая форма ССО развивается у лиц, которые принимали пирролизидиновые алкалоиды. Клинические признаки этого состояния аналогичны таковым при окклюзии печеночной вены: - гепатомегалия; - боли при пальпации печени; - боли в животе; - асцит; - утомляемость. Отсутствие специфических особенностей и неинвазивных методов выявления этой формы очень затрудняет диагностику. Биоптаты печени обычно показывают синусоидальный и перивенулярный фиброз, а также субэндотелиальный склероз. 3. Возникновение ССО часто приводит к последующему развитию почечной недостаточности, плеврального выпота, сердечной недостаточности, появлению легочных инфильтратов и кровотечениям, требующим переливания крови. Печеночный веноокклюзионный синдром (ВОС) является одним из частых и серьезных осложнений, возникающих у больных лейкозами, подвергшихся химиотерапии, а также у больных с апластической анемией после трансплантации гемопоэтических стволовых клеток. В основе патогенеза этого тяжелого осложнения лежит поражение эндотелиальных клеток и гепатоцитов в зоне печеночных ацинусов, в которых имеется высокая концентрация цитохрома Р-450 и глутатион-S-трансферазы, т. е. клеток, которые метаболизируют многие химиотерапевтические агенты и удаляют глутатион, что в конечном счете приводит к некрозу гепатоцитов и ЭК печени. Показано, что большое содержание в плазме крови ряда цитостатиков и их метаболитов (бусульфан, циклофосфамид и др.) ассоциируется с повышенным риском развития веноокклюзионного синдрома (ВОС). Еще в недавнем прошлом веноокклюзионный синдром (ВОС) возникал как проявление вторичной болезни у 15—20 % больных после химиотерапии и трансплантации костного мозга. Современный лекарственный мониторинг позволяет существенно снизить частоту и тяжесть этого осложнения. Тем не менее веноокклюзионный синдром (ВОС) остается крайне тяжелым, опасным для жизни патологическом процессом, который легко осложняется ДВС-синдромом или ТТП. Патогистологические и цитохимические исследования показывают, что при веноокклюзионном синдроме (ВОС) в наибольшей степени подвергается дистрофии эндотелий печеночных синусоидов, тогда как гепатоциты вовлекаются в патологический процесс вторично. Признаками этого тяжелого эндотелиоза служат значительное повышение содержания в плазме рецепторных гликопротеидов эндотелия: тромбомодулина, Z-селектина, снижение уровня эндотелиального активатора плазминогена и повышение его ингибитора (PAI-1) и др.. В результате этого поражения возникают центролобулярный некроз печеночных долек, болезненность и увеличение печени, желтуха, внутрипеченочная сосудистая гипертензия, фиброз, тромбирование и облитерация внутрипеченочных вен, приводящие в тяжелых случаях к развитию печеночной энцефалопатии (кома) в сочетании с асцитом. Наряду с флеботромбозами у больных могут развиться геморрагии разной локализации, тяжелая тромбоцитопения, вторичные иммунные нарушения. Клинические проявления и диагностика веноокклюзионного синдрома (ВОС) Веноокклюзионный синдром (ВОС) должен быть заподозрен во всех случаях, если после химиотерапии и трансплантации клеток костного мозга появляются боли в правом верхнем квадранте живота в сочетании с иктеричностью покровов, гипербилирубинемией. К этим симптомам часто присоединяются асцит, периферические отеки, застойные инфильтраты в легких, одышка. Все эти симптомы появляются вскоре после трансплантации стволовых клеток и химиотерапии лейкоза, особенно при недостаточном контроле за концентрацией цитостатиков и их метаболитов в крови. Ультразвуковое исследование и компьютерная томография, выявляющие увеличение печени и асцит, а также допплерография, обнаруживающая перегрузку сосудов портальной системы, подтверждают диагноз и позволяют исключить другие причины нарушения кровотока в печени (перикардит, синдром Бадда — Киари и др.). Исследование биоптатов печени и измерение в ней венозного давления очень важны в диагностике ВОС. Значение венозного печеночного давления выше 10 мм рт.ст. обладает 91% специфичностью, но чувствительность метода достигает только 52 %. Позднее в тяжелых случаях возникают печеночная энцефалопатия, а также мультиорганная недостаточность. Циркуляторные повреждения печени системного происхождения. Острая циркуляторная недостаточность и ш о к. Снижение перфузии (естественного кровоснабжения) печени возникает вследствие уменьшения как артериального, так и портального венозного кровотока и проявляется как часть общей циркуляторной недостаточности. Сначала повреждается микроциркуляторное русло, затем развивается некроз гепатоцитов, вызывающий острую воспалительную реакцию с инфильтрацией полиморфно-ядерными лейкоцитами. При биохимических анализах крови отмечается увеличение активности сывороточных аминотрансфераз. Сывороточный уровень билирубина тоже возрастает. Венозный застой. При быстро нарастающем (остром) системном венозном застое (застое в большом круге кровообращения) печень увеличивается, становится болезненной при пальпации. Макроскопически на разрезе отмечается большое количество темной венозной крови. Под микроскопом синусоиды резко расширены, гиперемированы, застойные явления особенно выражены в терминальных печеночных (центральных) венулах и перивенулярных участках синусоидов. При хроническом системном венозном застое макро- и микроскопические изменения выражаются в развитии «мускатной печени» (см. главу 3). При этом происходит утрата гепатоцитов из-за сдавления гиперемированными синусоидами и продолжительной гипоксии. Клинически может отмечаться небольшая желтуха, умеренное, а иногда и заметное, увеличение активности плазменной аминотрансферазы, а также снижение инактивации печенью всевозможных лекарств. При продолжительном венозном застое может происходить массовая гибель перивенулярных печеночных клеток, в некоторых случаях возникает компенсаторная гиперплазия гепатоцитов с формированием узелков и минимально выраженным Фиброзом. Такие изменения называются нодулярной регенеративной гиперплазией. В ряде случаев у больных развивается так называемый заместительный, или кардиальный, склероз («сердечный фиброз печени»). При этом участки перивенулярного склероза связаны фиброзными прослойками с портальными трактами. Изменения могут иметь диффузный характер с нарушением архитектоники печени, которая напоминает аналогичные процессы при циррозе. Такие изменения сопровождают недостаточность трехстворчатого клапана. Классификация печеночной недостаточности по интервалу времени от начала желтухи до развития печеночной энцефалопатии (по O’Grady et al.): 1. Сверхострая, если она развивается в течение 7 дней. 2. Острая, если она развивается в сроки от 8 до 28 дней. 3. Подострая, если она развивается в период с 29 дней до 12 недель. |
