Аналитика (1-14 вопросы). Дисциплина Аналитическая химия и фхма
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
4.Равновесие в гетерогенной системе “осадок - раствор”. Произведение растворимости. Факторы, влияющие на растворимость осадков. При соприкосновении какого–либо малорастворимого вещества с водой в системе осуществляются два процесса: 1) в результате взаимодействия ионов – в-ва с полярными молекулами воды, ионы отрываются от поверхности и вследствие диффузии распределяются по всему объему раствора. 2) по мере накопления ионов в растворе идет обратный процесс, ионы из раствора сталкиваются с поверхностью твердой фазы, притягиваются к ней и входят в состав кристаллической решетки. В конечном итоге в системе устанавливается равновесие между твердой фазой и ионами в растворе. υраст = υос 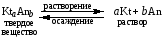 Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным. К данной равновесной системе можно применить закон действия масс и количественно охарактеризовать константой равновесия: 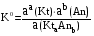 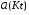 - активность катиона; - активность катиона; 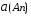 - активность аниона; - активность аниона; 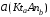 - активность твердого вещества; К0 – термодинамическая константа равновесия. - активность твердого вещества; К0 – термодинамическая константа равновесия.Т.к. активность твердого вещества – постоянная величина, следовательно К0∙ 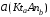 = const. Эта константа обозначается ПР0 и называется произведением растворимости. = const. Эта константа обозначается ПР0 и называется произведением растворимости.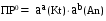 Произведением растворимости называется произведение активностей ионов малорастворимого электролита в его насыщенном растворе, в степенях, равных соответствующим стехиометрическим коэффициентам. Произведение растворимости является для каждого малорастворимого электролита при данной температуре величиной постоянной и не зависит от активностей ионов (при этом относительные концентрации ионов могут изменяться в широких пределах). Величину ПР0 называют также термодинамическим произведением растворимости или произведением активности. В реальных растворах удобнее пользоваться не активностями, а концентрациями ионов: ПР = [Kt]а·[An]b Величину ПР называют концентрационным (или реальным) произведением растворимости. Эта величина в отличие от ПР0 зависит не только от природы электролита и растворителя, но и от ионной силы раствора. ПР0 = [Kt]а·[An]b·γ а(Kt) ·γ b(An) Отсюда связь между различными произведениями растворимости выражается формулой: 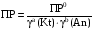 В тех случаях, когда произведение растворимости невелико (для бинарных электролитов ПР0 < 10-7 ) величина активности близка к концентрации (а ≈ с, γ ≈1) и для расчетов можно пользоваться концентрационным произведением растворимости. Условия образования осадков В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества. Раствор, содержащий вещества меньше, чем в насыщенном растворе называется ненасыщенным. В таком растворе может раствориться дополнительное количество вещества до достижения состояния насыщения. В ненасыщенном растворе скорость растворения больше, чем скорость осаждения(υраст > υос), а произведение активностей (концентраций) ионов меньше произведения растворимости. При определенных условиях для некоторых веществ могут существовать пересыщенные растворы, в которых содержится вещества больше, чем в насыщенных. Такие растворы не устойчивы, из них легко осаждается избыточное количество вещества до тех пор, пока раствор не станет насыщенным. В пересыщенном растворе скорость осаждения больше скорости растворения (υос > υраст), а произведение активностей (концентраций) ионов больше произведения растворимости. На основании этих закономерностей можно предсказать, выпадет ли осадок при смешении растворов определенной концентрации. Растворимость Растворимость (S) представляет собой концентрацию вещества в его насыщенном растворе при данной температуре. Как правило, растворимость измеряют в моль/л. Обычно величину произведения растворимости вычисляют на основании данных растворимости, найденных экспериментальным путем. В то же время, зная ПР, можно рассчитать растворимость вещества. Ионная растворимость равна S = 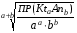 Для бинарных электролитов (a=b=1): S = 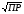 Факторы, влияющие на растворимость осадков Влияние добавления электролита, имеющего с осадком общий ион В растворе сульфата бария устанавливается равновесие ВaSO4 ⇄ Вa2+ + SO42– осадок раствор Это равновесие характеризуется произведением растворимости ПР = [Вa2+]∙[SO42–] = 1,1·10–10 Если в систему добавить растворимый электролит, имеющий с осадком общий ион (Вa2+ или SO42–), то концентрация этого иона увеличивается по сравнению с исходной. Но произведение растворимости является постоянной величиной, поэтому концентрация другого иона уменьшится. Например, добавим в систему 0,01 моль/л К2SO4; при этом увеличится концентрация ионов SO42–, и соответственно уменьшится концентрация ионов Вa2+. В водном растворе ВaSO4 концентрации ионов равны, следовательно, растворимость: S (ВaSO4) = [Вa2+] = [SO42–]. Рассчитаем растворимость ВaSO4 в воде: S (ВaSO4) = 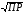 = =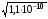 = 1,05·10–5 моль/л. = 1,05·10–5 моль/л.В присутствии К2SO4 растворимость ВaSO4 следует рассчитывать по концентрации ионов Вa2+: S (ВaSO4) = [Вa2+] = 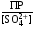 . .Концентрация ионов SO42– в системе [SO42–] = 0,01 моль/л. Тогда растворимость сульфата бария в присутствии 0,01 моль/л К2SO4 составит: S'(ВaSO4) = 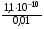 = 1,1·10–8 моль/л. = 1,1·10–8 моль/л.То есть растворимость осадка уменьшилась почти в 1000 раз. Таким образом, добавление раствора сильного электролита, имеющего с осадком общий ион, приводит к уменьшению растворимости осадка. Влияние добавления постороннего электролита На растворимость осадков влияет не только добавление электролита с одноименным ионом, но и добавление электролита, не имеющего такого иона. В этом случае растворимость осадка повышается; это явление называется “солевым эффектом”. Для системы ВaSO4 ⇄ Вa2+ + SO42– осадок раствор Посторонними электролитами являются, например, NaCl, NaNO3, и др. В присутствии подобных электролитов растворимость ВaSO4 возрастает, причем тем сильнее, чем выше концентрация постороннего электролита. Увеличение растворимости связано с тем, что при добавлении постороннего электролита в растворе взрастает общее число ионов, соответственно увеличивается ионная сила раствора и уменьшаются коэффициенты активности ионов Вa2+ и SO42–, которые будут уже заметно отличаться от единицы. Поэтому произведение растворимости следует выражать через активности ионов: ПР0(ВaSO4) = [Вa2+]∙[ SO42–]·γ (Вa2+) ·γ(SO42–) или [Вa2+]∙[ SO42–] = 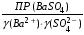 Таким образом, добавление в гетерогенную систему раствора постороннего сильного электролита приводит к увеличению растворимости осадка. Влияние реакций комплексообразования Во многих случаях осаждаемые ионы способны взаимодействовать с различными лигандами, в результате чего происходит уменьшениие равновесной концентрации ионов в насыщенном растворе малорастворимого соединения. Это смещает равновесие в системе осадок–раствор и приводит к увеличению растворимости осадков. Смещение равновесия зависит от произведения растворимости осадка, устойчивости образовавшегося комплекса, концентрации лиганда, кислотности раствора и других условий. Влияние концентрации ионов водорода Малорастворимые соли сильных кислот не растворяются в кислотах, однако растворимость малорастворимых солей слабых кислот, гидроксидов, основных солей в присутствии сильных кислот увеличивается. Если осадок не растворяется в кислотах и щелочах, но РН на растворимость не влияет. Влияние температуры Произведение растворимости является постоянной величиной только при неизменной температуре. При изменении температуры меняется и произведение растворимости, и, соответственно, растворимость осадков. Большинство твердых веществ растворяются с поглощением теплоты и при увеличении температуры растворимость увеличивается. Если вещества растворяются с выделением теплоты, то при увеличении температуры растворимость падает. Влияние природы растворителя Растворимость большинства соединений довольно резко изменяется с изменением свойств растворителя. Растворимость тем выше, чем ближе друг к другу растворитель и растворяемое вещество по природе химических связей. Поэтому вещества с ионным или полярным типом связи (например, неорганические соли) легче растворяются в полярных растворителях (например, в воде), а соединения с органическими анионами (диметилглиоксиматы, оксихинолинаты металлов) растворяются в органических растворителях лучше, чем в воде. Добавление к воде органических растворителей широко используют в практике анализа для уменьшения растворимости и количественного выделения соединений из раствора. Этот процесс часто называют высаливанием. Например, такие соли как СaSO4, КClO4 сравнительно хорошо растворимы в воде, а при добавлении к водному раствору 50% этанола приводит к практически полному осаждению этих соединений. 5.Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость. Если к воде или водным растворам сильных кислот и оснований и многих солей добавить небольшое количество сильной кислоты или сильного основания рН раствора сильно изменится. Если к 1 литру воды (рН=7) прибавить 0,001 моль р-ра HCl (С HCl=10-3 моль/л), то рН раствора станет равное 3 (рН=3). Во многих случаях при проведении анализа необходимо поддерживать рН на определенном уровне, для этого используют буферные растворы, в которых при добавлении небольшого количества сильной кислоты или сильного основания рН изменяется не значительно. Буферные растворы регулируют концентрацию ионов Н+ и ОН- уменьшая влияние различных факторов изменения рН. Как правило, буферные растворы состоят из слабой кислоты и ее соли (СН3СООН+СН3СООNa–ацетатный кислотный буферный раствор) или слабого основания и его соли (NH3·H2O+NH4Cl–аммиачный (аммонийный) щелочной раствор). Расчет рН в буферных растворах 1) для кислотного буферного р-ра 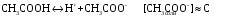 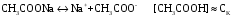 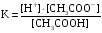 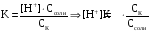 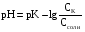 Если 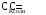 , тогда pH=pK , тогда pH=pK2) для щелочного буферного р-ра 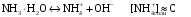 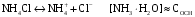 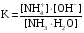 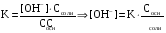 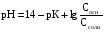 Если 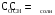 , тогда pH=14-pK , тогда pH=14-pKСущность буферного действия При добавлении к буферному раствору небольшого количества сильной кислоты или щелочи, один из компонентов буферного раствора взаимодействует с добавленным реагентом, при этом концентрации компонентов изменяются, но их отношение, а особенно логарифм этого отношения изменяется незначительно. Пример. Как изменяется рН ацетатного буферного раствора, содержащего по 1 моль/л каждого из компонентов: а) при добавлении 0,1моль/л НСl; б) при добавлении 0,1 моль/л NaOH. Ск-ты=1моль/л, Ссоли=1 моль/л, С NaOH=0,1 моль/л, СHCl=0,1 моль/л, КК=1,8*10-5. Рассчитаем рН исходного буферного р-ра: рН=рК=-lg 1,8·10-5=4,75. CH3COONa+HCl 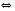 CH3COOH + NaCl. CH3COOH + NaCl.Концентрация соли уменьшается, концентрация кислоты увеличивается на столько, на сколько добавлено реагентов 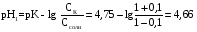 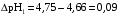 . .CH3COOH+NaOH  CH3COONa+H2O CH3COONa+H2O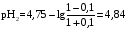 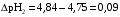 Буферная емкость Способность буферного раствора поддерживать рН количественно характеризуется буферной емкостью (π). π – это количество сильной кислоты или основания, которое следует добавить к 1 литру буферного раствора, чтобы его рН изменился на 1. Буферная емкость зависит от качественного состава буферного раствора и от концентрации компонентов. Чем больше концентрация, тем выше буферная емкость. При прочих равных условиях максимальной буферной емкостью обладают растворы с одинаковой концентрацией компонентов. 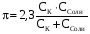 ; ; 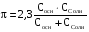 Наиболее часто в химическом анализе применяются следующие буферные растворы (рН приведено для одинаковой концентрации компонентов):
|
