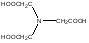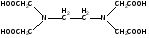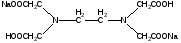Аналитика (1-14 вопросы). Дисциплина Аналитическая химия и фхма
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
Кривые титрования в методах нейтрализации Чтобы правильно выбрать индикатор надо знать, как изменяется рН в процессе титрования, и чему он равен в точке эквивалентности. Для этого строят кривые титрования, которые представляют собой графическое изображение изменения рН при добавлении титранта к раствору анализируемого вещества. На оси ординат откладывают рН, на оси абсцисс объем добавленного титранта и степень оттитрованности раствора. Примерный вид кривой титрования 0,1М HCl 0,1 M раствором NaOH (без соблюдения масштаба) показан на рисунке. В начале титрования рН изменяется очень медленно. После добавления 90% щелочи рН изменяется всего на единицу (от 1 до 2). Вблизи точки эквивалентности наблюдается резкое изменение рН – скачок титрования (при добавлении щелочи от 99,9 % до 100,1 % рН изменяется от 4 до 10). 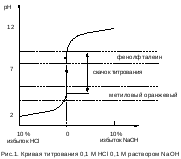 Индикатор для метода нейтрализации выбирают таким образом, чтобы интервал окраски индикатора полностью или частично перекрывался со скачком титрования. 1) фенолфталеин рН = 8-10 2) метиленовый красный рН = 4,4-6,2 3) метиленовый оранжевый рН = 3,1-4,4 Титрование можно проводить со всеми тремя индикаторами. Величина скачка титрования тем больше, чем сильнее кислота и основание и чем выше концентрация раствора. 10. Комплексонометрия: сущность метода, общая характеристика, область применения. Металл – индикаторы, механизм их действия. Комплексонометрия – метод количественного титриметрического анализа, основанный на образовании комплексных соединений ионов металлов с комплексонами. Комплексонами называют органические соединения, молекулы которых содержат как кислотные, так и основные группы и потому способные образовывать с ионами металлов внутрикомплексные соединения. Внутрикомплексные соединения образуются в тех случаях, когда ионы металла-комплексообразователя с одной стороны замещают активные ионы водорода кислотных функциональных групп, а с другой стороны образуют связь по донорно-акцепторному механизму за счет свободных орбиталей иона металла и атомов основных групп, имеющими неподеленные электронные пары. К числу функциональных групп, содержащих ионы водорода, способные замещаться ионами металла-комплексообразователя, относятся: −COOH, −OH, −SO3H, −NH2, −SH, =NH. К числу функциональных групп, с которыми ионы металла-комплексооб разователя способны образовывать связь по донорно-акцепторному механизму, относятся: ≡N, =NH, −NH2, −OH, =C=O, − S −, −N=N−. С помощью метода комплексонометрии определяют содержание в растворе различных ионов металлов: Mg2+, Ca2+, Zn2+, Cd2+, Al3+, Ni2+, Cu2+, Co2+, Fe3+ и др. В практике химического анализа как правило используют аминополикарбоновые кислоты или их соли.
Чаще всего в качестве комплексона используют ЭДТА (двузамещенный этилендиаминтетраацетат натрия)
При взаимодействии с ЭДТА ион металла замещает ионы водорода карбоксильных групп и образует координационную связь за счет неподеленных электронных пар атомов азота и свободных орбиталей иона металла. При этом образуется хелатный комплекс с тремя пятичленными циклами. Схематично эту реакцию можно выразить уравнением: 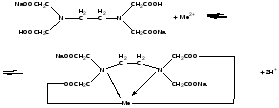 Однако показанный на схеме реакции комплекс в действительности имеет следующее строение: 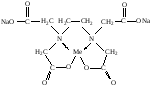 При титровании ЭДТА солей металлов-комплексообразователей протекают следующие реакции: 1) диссоциация комплексона: Na2H2Y  2Na+ + H2Y2− 2Na+ + H2Y2−2) взаимодействие с металлами: Me2+ (Ca2+) + H2Y2−  MeY2− + 2H+ MeY2− + 2H+ Me3+ (Al3+) + H2Y2−  MeY− + 2H+ MeY− + 2H+ Me4+ (Th4+) + H2Y2-  MeY + 2H+ MeY + 2H+ Реакции с участием комплексонов протекают стехиометрично, образуются очень прочные комплексы с соотношением металла к лиганду 1:1 не зависимо от заряда иона металла. Комплексы не удовлетворяют требованиям предъявляемым первичным стандартным веществам, поэтому их точную концентрацию устанавливают путем стандартизации. В качестве первичных стандартных веществ используют соли Са2+ и Mg2+, приготовленные из фиксаналов или металлический цинк. В последнем случае, гранулы цинка взвешивают на аналитических весах, помещают в мерную колбу и растворяют в небольшом количестве НСl или H2SO4, после растворения Zn, раствор нейтрализуют и доводят объем до метки. По массе цинка и объему полученного раствора рассчитывают точную концентрацию первичного стандартного раствора. При проведение комплексонометрического определения необходимо соблюдать определенные условия, важнейшим из которых является рН раствора. В сильно кислых растворах (рН<3) образуются малоустойчивые кислые комплексы. При повышении рН устойчивость образовавшихся комплексов возрастает, однако в сильно щелочных средах рН>10 происходит образование малоустойчивых оксокомплексов или гидрооксиды Ме. Из выше приведенных реакций следует, что образование комплексонатов происходит с выделение кислоты, что приводит к увеличению рН. Поэтому, как правило, титрование проводят в присутствии соответствующих буферных растворов поддерживающих рН на определенном уровне. В комплексонометрии используют методы прямого и обратного титрования, а также метод замещения. Метод прямого титрования. Анализируемый раствор, содержащий катионы определенного металла, титруют стандартным раствором ЭДТА в присутствии буферного раствора. Этим методом определяют Mg2+, Ca2+, Zn2+, Cd2+, Al3+, Ni2+, Cu2+, Co2+, Fe3+, Pb2+, Ba2+ и другие катионы. Метод обратного титрования. В тех случаях, когда по тем или иным причинам невозможно провести прямое титрование, используют обратное титрование. К анализируемому раствору прибавляют точно измеренный объем стандартного раствора комплексона, нагревают до кипения для завершения реакции комплексообразования, а после охлаждения оттитровывают избыток комплексона стандартными растворами MgSO4 или ZnSO4. Этот метод применяют в тех случаях, когда нет подходящего индикатора, когда в буферном растворе выпадает осадок гидроксида металла и когда реакция комплексообразования протекает медленно. Методом обратного титрования также определяют содержание катионов в нерастворимых в воде соединениях (Ca2+ в CaC2O4, Mg2+ в MgNH4PO4, Pb2+ в PbSO4 и т.п.). Метод замещения. Метод основан на том, что ионы Mg2+ дают с комплексоном менее устойчивое комплексное соединение, чем подавляющее большинство других катионов. Поэтому при добавлении определяемого катиона к комплексонату Mg произойдет реакция обмена. Например, при определении ионов тория, к анализируемому раствору добавляют комплексонат магния MgY2-, а затем оттитровывают выделившиеся ионы Mg2+ стандартным раствором ЭДТА (6): Th4+ + MgY2−  ThY + Mg2+ (5) ThY + Mg2+ (5)Mg2+ + H2Y2−  MgY2− + 2H+ (6) MgY2− + 2H+ (6)Вследствие того, что Th4+ образует с комплексоном более устойчивое комплексное соединение, чем Mg2+ , равновесие реакции (5) смещается вправо. 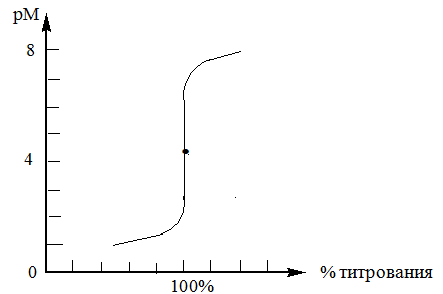 Выбор индикатора для комплексонометрии осуществляется с помощью кривых титрования. При этом кривую титрования строят по аналогии с кривыми для кислотно-основного титрования, откладывая на оси ординат значение рМ= − lg [Mn+], а на оси абсцисс – количество добавленного комплексона или процент титрования. При постепенном прибавлении раствора ЭДТА к раствору соли металла происходит уменьшение концентрации свободных ионов металла, вблизи точки эквивалентности наблюдается её резкое уменьшение − скачок титрования. Величина скачка титрования имеет большое значение: чем он больше, тем легче установить конечную точку титрования. Величина скачка зависит от природы иона металла, устойчивости образующегося комплекса (чем устойчивее комплексонат, тем больше скачок), рН среды и концентрации растворов. Как правило, для фиксирования точки конца титрования в комплексонометрии используют так называемые металл-индикаторы, которые представляют собой органические красители, образующие с катионами определяемых металлов растворимые в воде окрашенные комплексные соединения. Получаемые при этом комплексы менее устойчивы, чем комплексы металлов с комплексонами. При добавлении индикатора к раствору соли металла образуется комплекс металла с индикатором, окрашенный определенным образом. При титровании ЭДТА полученного раствора, малоустойчивый комплекс металла с индикатором разрушается и образуется более устойчивый неокрашенный комплекс металла с комплексоном, а индикатор выделяется в свободном виде, и в конечной точке раствор приобретает окраску, свойственную индикатору. Эриохром черный Т В качестве примера рассмотрим кислотный хромоген черный специальный (эриохром черный Т), который очень широко применяется в комплексонометрии. Эриохром черный Т является органическим азокрасителем группы о,о' –диоксиазонафталина. Анион индикатора, который можно обозначить как H2Ind−, имеет формулу: 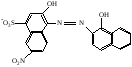 Этот ион проявляет себя как кислотно-основной индикатор. В зависимости от рН раствора индикатор существует в трех окрашенных формах: при рН < 6 реагент красного цвета, при рН от 7 до 11 – синего, при рН >11,5 – желто-оранжевого: 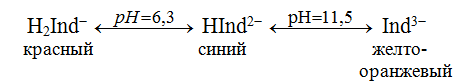 В молекулу индикатора входят две фенольные группы и хромофорная азогруппа. Поэтому эриохром черный Т способен реагировать с ионами металла-комплексообразователя с образованием комплексных соединений. В нейтральной и слабощелочной среде этот индикатор образует с большинством ионов металлов комплексы красного цвета следующего состава: 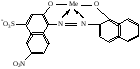 Сущность действия металл-индикатора на примере эриохрома черного Т можно представить следующим образом: 1) при добавлении индикатора к раствору соли металла (рН=8−10) образуется комплекс металла с индикатором красного цвета: Me2+ + HInd2−  MeInd− + H+ MeInd− + H+красный 2) при титровании полученного раствора ЭДТА этот комплекс разрушается, образуется более устойчивый бесцветный комплекс металла с комплексоном, а индикатор выделяется в свободном виде, придавая раствору синюю окраску: MeInd− + Na2H2Y  MeNa2Y + HInd2− + H+ MeNa2Y + HInd2− + H+красный б/цв. б/цв. синий Для поддержания рН раствора на требуемом уровне обычно в титруемый раствор добавляют аммиачную буферную смесь. Индикаторы подбираются таким образом, чтобы интервал перехода их окраски находился в пределах скачка титрования. В настоящее время известно около 150 металл-индикаторов. Кроме металл-индикаторов для фиксирования точки конца титрования в комплексонометрии используют обычные кислотно-основные индикаторы, так как реакция комплексообразования сопровождается выделением ионов водорода H+ в количестве, эквивалентном количеству определяемого катиона. Выделившуюся кислоту определяют методом нейтрализации с обычными кислотно-основными индикаторами. 11.Окислительно-восстановительное титрование: сущность и методы. Окислительно-восстановительный потенциал и направление окислительно-восстановительных реакций. Фиксирование точки конца титрования в методах окислительно-восстановительное титрование. Редокс – индикаторы и требования к ним. Методы окислительно-восстановительного титрования, или редокс-методы основаны на реакциях окисления – восстановления, связанных спереходом электронов от одних атомов, ионов или молекул к другим. Вещество, атомы, ионы или молекулы которого отдают электроны, окисляется и является восстановителем; вещество, атомы, ионы или молекулы которого принимают электроны, восстанавливается и является окислителем. Схематически это может быть выражено следующими уравнениями: Вос1 – ne → Ок1 Ок2 + ne → Вос2 , где Вос – восстановленная форма; Ок – окисленная форма. Восстановленная форма одного вещества Вос1, отдавая электроны, переходит в окисленную форму Ок1 того же вещества. Обе эти формы образуют одну редокс-пару Ок1 /Вос1. Окисленная форма Ок2 второго вещества, участвующего в окислительно-восстановительной реакции, принимая электроны, переходит в восстановленную форму Вос2 того же вещества. Обе эти формы также образуют редокс-пару Ок2 /Вос2. В любой окислительно-восстановительной реакции участвуют, по крайней мере, две редокс-пары. Методы окислительно-восстановительного титрования классифицируются по характеру основного титранта:
Достоинства метода окислительно-восстановительного титрования 1. Методы отличаются большой точностью и хорошей воспроизводимостью результатов. 2. Многие методы характеризуются быстротой выполнения и могут быть использованы для автоматического контроля. 3. Методы отличаются большим разнообразием, с их помощью можно определять не только окислители и восстановители, но и вещества, не проявляющие окислительно-восстановительных свойств. 4. Точку эквивалентности можно фиксировать с помощью индикаторов, а также безиндикаторными и инструментальными методами. 5. Определения можно проводить прямым или обратным титрованием, а также методами замещения. 6. Многие окислители и восстановители легко получить в химически чистом виде, поэтому их титрованные растворы готовят по точной навеске. Приготовленные растворы можно использовать как для титрования, так и для стандартизации других растворов. 7. Титрование окислителями и восстановителями можно осуществлять во всех средах. О/В потенциалы. Направление о/в реакций Окислители и восстановители различаются по своей силе, т.е. по химической активности. Сила окислителей и восстановителей определяется величиной их стандартного окислительно-восстановительного потенциала. Стандартным называется окислительно-восстановительный потенциал системы с концентрацией (активностью) окисленной и восстановленной форм равными 1 моль/л и измеренный по отношению к стандартному водородному электроду, потенциал которого принят равным нулю. Чем больше стандартный окислительно-восстановительный потенциал данной пары, тем более сильным окислителем является окисленная форма и тем более слабым восстановителем ― восстановленная форма. Наиболее сильными окислителями являются: KMnO4 и K2Cr2O7 в кислой среде, F2, Cl2, Br2, I2, Fe3+, Sn4+ и др. Наиболее сильными восстановителями являются: щелочные и щелочноземельные металлы, Mg, Al, Zn, AsH3, V2+, Ti3+, S2–, Sn2+ и др. Когда комбинируются две окислительно-восстановительные пары, то более сильный из двух окислителей отнимает электроны у более сильного восстановителя, при этом образуются более слабые восстановитель и окислитель. Например: Е0(Fe3+/Fe2+) = 0,77В, Е0(Sn4+/Sn2+) = 0,15 В, т.е. для данных пар Fe3+ является более сильным окислителем, чем Sn4+, а Sn2+ — более сильным восстановителем, чем Sn2+. Поэтому реакция между ними пойдет в следующем направлении: 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ Стандартные окислительно-восстановительные потенциалы дают представление о возможном направлении окислительно-восстановительных реакций, но в реальных условиях это направление может быть иным. В процессе окислительно-восстановительного титрования наблюдается изменение окислительно-восстановительных потенциалов взаимодействующих друг с другом систем. Зависимость окислительно-восстановительного потенциала от концентраций окисленной и восстановленной форм выражается уравнением Нернста: 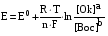 , (1.1) , (1.1)где E –окислительно-восстановительный потенциал пары, В; E0 – стандартный окислительно-восстановительный потенциал пары, В; R – универсальная газовая постоянная (8,314 Дж/моль∙К); Т – температура, К; n – число электронов, отданных или принятых одним атомом, ионом или молекулой; F – постоянная Фарадея (96500 Кл/моль); [Ок] и [Вос] – концентрации соответственно окисленной и восстановленной форм, моль/л; a и b – стехиометрические коэффициенты окислительно-восстановительной реакции. Если подставить значения R, F, T = 298 K и перейти от натурального логарифма к десятичному, уравнение Нернста принимает вид: 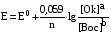 (1.2) (1.2)Если превращение окисленной формы в восстановленную (или наоборот) происходит при участии ионов H+ или OH−, то их концентрация входит в уравнение Нернста. Например, для полуреакции восстановления Cr2O72− + 14Н+ + 6е 2Cr3+ + 7Н2О уравнение Нернста имеет вид: 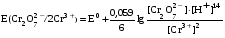 (1.3) (1.3)Изменяя концентрации окисленной и восстановленной форм, а также концентрацию ионов H+, можно менять окислительно-восстановительную активность веществ. Если стандартные окислительно-восстановительные потенциалы взаимодействующих пар относительно близки, то изменяя концентрации окисленной и восстановленной форм можно изменить направление реакции на противоположное. Например: Е0(Fe3+/Fe2+) = 0,77В, Е0(I2/2I-) = 0,54 В, т.е. реакция (1.4) будет протекать в прямом направлении: 2Fe3+ + 2I− ↔ 2Fe2+ + I2 (1.4) В присутствии NaF ионы Fe3+ связываются в довольно прочный комплекс: Fe3+ + 6F– = [FeF6]3−. Концентрация свободных ионов Fe3+ при этом понижается, и реакция (1.4) прекращается, т.к. Е([FeF6]3−/Fe2+) = 0,4 В. В присутствии оксалат-иона С2О42– образуется еще более прочный комплекс [Fe(С2О42−)3]3−. В этом случае потенциал пары становится равным Е([Fe(С2О42-)3]3-/Fe2+) = – 0,02 В и реакция (1.4) будет протекать в обратном направлении. Однако если стандартные окислительно-восстановительные потенциалы взаимодействующих пар значительно отличаются друг от друга, никаким изменением концентраций нельзя изменить направление реакции на противоположное. Например, Е0(Fe3+/Fe2+) = 0,77В, Е0(MnO4−/Mn2+) = 1,51 В 5Fe2+ + MnO4− + 8H+ = 5Fe3+ + Mn2+ + 4H2O Реакцияможет протекать только в прямом направлении. Константа равновесия о/в реакций Возможность изменения направления окислительно-восстановительных реакций свидетельствует об их обратимости. В обратимых реакциях устанавливается химическое равновесие, которое характеризуется константой равновесия. Для реакции 2Fe3+ + Sn2+ ↔ 2Fe2+ + Sn4+ выражение константы равновесия имеет вид: 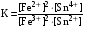 . .Окислительно-восстановительный потенциал системы в любой момент реакции может быть вычислен по одной из формул: 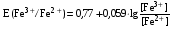 (1.5) (1.5)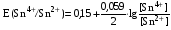 (1.6) (1.6)(Е0(Fe3+/Fe2+) = 0,77В, Е0(Sn4+/Sn2+) = 0,15В). По мере протекания реакции концентрации ионов Fe3+ и Sn2+ уменьшаются, а Fe2+ и Sn4+ − увеличиваются. Соответственно уменьшается потенциал пары Fe3+/Fe2+ и увеличивается − Sn4+/Sn2+. Когда потенциалы становятся равными, переход электронов от восстановителя к окислителю прекращается и в системе наступает равновесие. Тогда Е (Fe3+/Fe2+) = Е (Sn4+/Sn2+) и 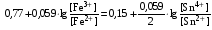 , отсюда , отсюда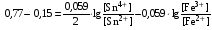 (1.7) (1.7)Выражение 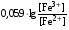 представим в виде: представим в виде: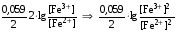 , ,подставим в формулу (1.7) и проведем преобразования: 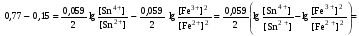 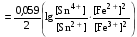 отсюда отсюда 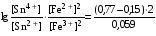 . .Под знаком логарифма получили константу равновесия. Таким образом, для любой окислительно-восстановительной реакции 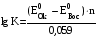 (1.8) (1.8)Для рассматриваемой реакции 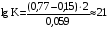 , отсюда К ≈ 1021, т.е. реакция является практически необратимой. , отсюда К ≈ 1021, т.е. реакция является практически необратимой.Из формулы (1.8) видно, что константа равновесия тем больше, чем больше разность потенциалов обеих пар, и если она велика, реакция идет практически до конца. Фиксирование ТКТ в методах о/в титрования Для фиксирования точки конца титрования в методах окислительно-восстановительного титрования широко применяются физико-химические (инструментальные) методы (потенциометрический, амперометрический, кондуктометрический, спектрофотометрический и др.). Из химических методов фиксирования точки конца титрования, можно выделить три основных способа. 1. Безиндикаторное титрование. В ряде случаев фиксирование точки конца титрования производят по изменению окраски раствора, вызванного избытком окрашенного раствора окислителя или восстановителя. Такое титрование возможно, например, при титровании восстановителей перманганатом в кислой среде. Красно-фиолетовая окраска иона MnO4– при этом исчезает в результате его восстановления до бесцветного иона Mn2+. Когда весь восстановитель будет оттитрован, одна лишняя капля KMnO4 окрашивает раствор в розовый цвет, появление которого свидетельствует о завершении титрования. Без индикатора можно также титровать восстановители раствором йода, т.к. при этом его бурая окраска исчезает, и одна лишняя капля раствора I2 окрасит раствор в бледно-желтый цвет. Однако, в этом случае результаты могут получиться менее точными, т.к. в интенсивность окраски от одной лишней капли йода меньше, чем для KMnO4. Безиндикаторное титрование применимо в тех случаях, когда окраска окисленной и восстановленной форм резко отличается и если в растворе отсутствуют другие окрашенные вещества. 2. Использование специфических индикаторов. Это вещества, специфически реагирующие с одной из форм окислительно-восстановительной пары с изменением окраски. В методах, основанных на титровании стандартным раствором йода или на выделении I2, точку эквивалентности устанавливают при помощи специфического индикатора – крахмала, образующего с йодом комплексно-адсорбционное соединение синего цвета. При титровании восстановителей раствором йода в присутствии крахмала, одна лишняя капля раствора I2 вызовет появление синей окраски, если же титруют восстановителем раствор йода, то в конечной точке синее окрашивание исчезает. В некоторых случаях конец титрования определяют по обесцвечиванию красной окраски тиоцианата железа (III) Fe(SCN)3 в присутствии избытка восстановителя. Эти способы фиксирования точки эквивалентности находят ограниченное применение. 3. Использование окислительно-восстановительных или редокс-индикаторов. Это вещества, которые изменяют свою окраску в зависимости от окислительно-восстановительного потенциала системы. Как правило, редокс-индикаторы представляют собой органические вещества, способные обратимо окисляться и восстанавливаться, и у которых окисленная и восстановленная формы имеют разную окраску. Схематично это можно представить следующим образом: Ind(ок) + ne ↔ Ind(вос), где Ind(ok) – окисленная, Ind(воc) – восстановленная форма индикаторов; n – число электронов, принимающих участие в окислительно-восстановительном процессе. Потенциал такой индикаторной системы может быть рассчитан по уравнению Нернста: 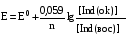 , (1.15) , (1.15)где Е0 – стандартный потенциал данной пары, когда [Ind(ок)] = [Ind(вос)]. Если к раствору восстановителя (окислителя) добавить 1-2 капли индикатора, то он окрасится определенным образом. При титровании этого раствора окислителем (восстановителем) отношение [Ind(ок)] / [Ind(вос)] будет меняться, но изменение окраски раствора будет заметно, когда концентрация одной из форм в 10 раз превысит концентрацию другой. Интервал перехода окраски индикатора будет определяться следующим образом: 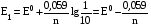 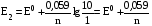 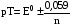 К редокс-индикаторам относятся дифениламин, дифениламинсульфокислота, фенилантраниловая кислота, ферроин и др. Рассмотрим примеры некоторых редокс-индикаторов. Дифениламин. Это соединение является одним из первых редокс-индикаторов, описанных в литературе. Сначала индикатор необратимо окисляется до бесцветного дифенилбензидина, который обратимо окисляется до дифенилбензидина фиолетового: 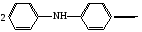 Дифениламин (бесцветный)  Дифенилбезидин (бесцветный) 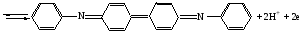 Дифенилбензидин (фиолетовый) Стандартный потенциал дифениламина Е0 = 0,76 В при [H+] = 1моль/л, интервал перехода рТ = 0,76 ± 0,03. Если Е ≤ 0,73 В, индикатор бесцветен, при Е ≥ 0,79 В имеет интенсивную сине-фиолетовую окраску. В качестве окислительно-восстановительного индикатора используется также дифениламинсульфокислота. Её преимущество заключается в том, что в виде натриевой или бариевой соли она хорошо растворяется в воде. Механизм изменения окраски тот же, что и у дифениламина, но переход окраски наблюдается при потенциале 0,85 В – значительно выше, чем в случае использования дифениламина. N-фенилантраниловая кислота. Реакция окисления аналогична реакциям, протекающим с другими дифениламинами: 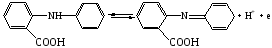 Стандартный потенциал данного индикатораЕ0 = 1,08 В. У фенилантраниловой кислоты восстановленная форма бесцветная, окисленная – красно-фиолетовая рТ = 1,022 —1,138 В. Такой интервал изменения окраски соответствует скачку титрования раствора FeSO4 раствором KMnO4. Т.е. при добавлении данного индикатора к раствору FeSO4 он будет находиться в восстановленной бесцветной форме, а после достижения точки эквивалентности одна лишняя капля KMnO4 окислит индикатор и он перейдет в окисленную красно-фиолетовую форму. Данный индикатор применяется при определении содержания хрома методом перманганатометрии, т.к. образуется раствор, окрашенный в зеленый цвет и безиндикаторное титрование невозможно. Ферроин. Этот индикатор представляет собой комплексное соединение железа (II) с 1,10-фенантролином. Комплекс окрашен в красный цвет: 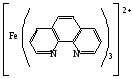 При окислении ферроина образуется комплекс железа (III) бледно-голубого цвета: [FeII(C12H8N2)3]2+  [FeIII(C12H8N2)3]3+ + e [FeIII(C12H8N2)3]3+ + eСтандартный потенциал данного индикатораЕ0 = 1,06 В в 1М серной или соляной кислотах. Потенциал ферроина можно в значительной степени изменить введением в ядро 1,10-фенантролина различных заместителей. При этом реальный потенциал можно варьировать от 0,84 до 1,10 В. |