Экзаменационный билет 1
 Скачать 3.38 Mb. Скачать 3.38 Mb.
|
|
Для получения кривых распределения по методу капиллярной конденсации используют десорбционную ветвь изотермы адсорбции, так как для всех без исключения пор она соответствует сферическим менискам, радиусы которых принимают за радиусы пор.
Все дисперсные системы в зависимости от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободноднсперсной системы). Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем: 1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана. 2. Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации) 3. Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении. 4. Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени. 5. Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды. 6. Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно. Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах, и об агрегативной устойчивости таких систем судят по скорости коагуляции. Смолуховским была рассмотрена кинетика коагуляции монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского движения. Критическое расстояние, на котором осуществляется взаимодействие между частицами, принято приблизительно равным сумме радиусов частиц, что соответствует непосредственному их контакту. Согласно представлениям Смолуховского при коагуляции происходят взаимодействия только между двумя частицами, так как вероятность одновременного столкновения большого числа частиц очень мала. Таким образом, сталкиваются частицы одиночные, образуя двойные, одиночные с двойными, двойные друг с другом, тройные с одиночными и т. д. Такое представление процесса коагуляции позволяет формально применить к нему теорию бимолекулярных химических реакций. Относительное смещение двух частиц. Δn—Δm с коэффициентом относительной диффузии Dnm связано законом Эйнштейна — Смолуховского: В соответствии с первым законом Фика поток через сферическую поверхность s выражается уравнением Интегрируя уравнение данное после разделения переменных в пределах от Rnm до ∞ и соответственно от 0 до νn, получим: Данное уравнение отражает также число столкновении на данной стадии процесса коагуляции, т. е. число частиц, сталкивающихся в единицу времени с одной центральной частицей. Общее число столкновений между частицами в системе в единицу времени в данный момент составляет Чтобы рассчитать скорость уменьшения числа частиц в результате коагуляции, т. е. скорость коагуляции, необходимо принять, что все столкновения приводят к агрегации. Необходимо учесть стерический множитель P, учитывающий благоприятные пространственные расположения частиц при столкновении, их форму, размеры. Тогда скорость коагуляции в данный момент времени составит: Сравнение с уравнением для скорости бимолекулярной реакции Общее число частиц в результате коагуляции уменьшается. Чтобы определить, каким оно будет через время τ, необходимо провести интегрирование в пределах от ν∑ = ν0 при τ = 0 до ν∑ при τ: Константу скорости коагуляции теоретически определить трудно, поэтому Смолуховский ввел понятие времени (периода) половинной коагуляции θ — времени коагуляции, в течение которого общая концентрация частиц уменьшается до половины от начальной концентрации первичных (единичных) частиц. Из уравнения общего числа частиц следует: О 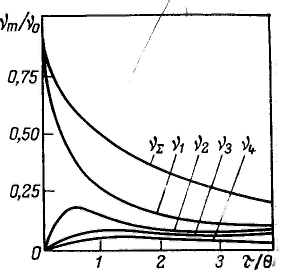 бщее число частиц ν∑ в единице объема системы представляет собой уменьшающуюся в процессе коагуляции сумму частиц всех порядков: бщее число частиц ν∑ в единице объема системы представляет собой уменьшающуюся в процессе коагуляции сумму частиц всех порядков:Этот ряд является суммой геометрической прогрессии со знаменателем Отсюда легко определить число частиц каждого порядка (m-мерных): Согласно теории кинетики коагуляции различают быструю и медленную коагуляцию. Для такого разделения можно воспользоваться уравнением константы скорости коагуляции. При быстрой коагуляции все столкновения частиц эффективны, т. е. приводят к слипанию частиц. При медленной коагуляции это утверждение не соблюдается.
 Экзаменационный билет № 24
Пористые тела — это твердые тела, внутри которых имеются поры, обусловливающие наличие внутренней межфазной поверхности. Поры могут быть заполнены газом или жидкостью. Высокодисперсные пористые неорганические материалы, в частности, адсорбенты и катализаторы, получают в основном двумя методами. Один из них заключается в синтезе гидрозоля с последующей его коагуляцией для образования геля; гель высушивают. Частицы дисперсной фазы (корпускулы) в результате этих операций срастаются с образованием твердого каркаса. Так как частицы золя высокодисперсны, то получаемый пористый материал имеет большую удельную поверхность. Таким методом получают адсорбенты корпускулярной структуры. Второй метод получения высокодисперсных пористых адсорбентов и катализаторов заключается в обработке крупнопористых материалов агрессивными газами или жидкостями. При такой обработке получаются пористые тела губчатой структуры. Наибольшее распространение получила классификация пористых тел, предложенная M. M. Дубининым. По этой классификации за основу приняты размеры пор и механизм протекающих в них адсорбционных процессов. По классификации M. M. Дубинина пористые тела делятся на макропористые, переходнопористые, микропористые в зависимости от линейного размера, под которым понимают полуширину для щелевидной поры или радиус для сферической или цилиндрической поры. Макропористые тела имеют поры радиусом больше 100,0 — 200,0 нм, удельная поверхность макропористых тел находится в пределах 0,5 — 2 м2/г. В связи с тем, что такие поры намного больше адсорбируемых молекул, то их стенки по сравнению с молекулами можно рассматривать как ровные поверхности, поэтому для макропористых тел применима обобщенная теория адсорбции Ленгмюра. Переходнопористые тела (или капиллярно-пористые, или мезопористые) имеют размеры пор в пределах от 1,5 до 100,0 — 200,0 нм их удельная поверхность составляет от 10 до 500 м2/г. Ha стенках этих пор при малых давлениях происходит полимолекулярная адсорбция паров, которая с увеличением давления заканчивается капиллярной конденсацией. Микропористые тела обладают порами, соизмеримыми с размерами адсорбируемых молекул. Радиусы пор лежать в пределах от 0,5 до 1,5 нм. Удельная поверхность таких тел 500 — 1000 м2/г и выше. Отличительной чертой микропор является настолько близкое расположение противоположных стенок, что их поля поверхностных сил перекрываются и они действуют во всем объеме микропор. Одной из основных характеристик пористой структуры тела является пористость — отношение объема пор Vп к общему объему тела Vобщ: Если принять, что поры в пористых телах и порошках имеют правильную форму, то их размеры можно оценить, зная пористость и удельную поверхность: Для определения пористости и удельной поверхности пористых тел широко используются адсорбционные методы.
Все дисперсные системы в зависимости от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободноднсперсной системы). Наличие гидрофильной и олеофильной частей у молекул ПАВ является характерной отличительной особенностью их строения. По способности к диссоциации в водных растворах поверхностно-активные вещества делят на ионогенные и неионогенные. В свою очередь ионогенные ПАВ подразделяют на анионные, катионные и амфолитпые (амфотерные). 1) Анионные ПАВ диссоциируют в воде с образованием поверхностно-активного аниона. 2) Катионные ПАВ диссоциируют в воде с образованием поверхностно-активного катиона. 3) Амфолитные ПАВ содержат две функциональные группы, одна из которых имеет кислый, а другая основный характер, например карбоксильную и аминную группы. В зависимости от рН среды амфолитные ПАВ проявляют анионоактивные или катионоактивные свойства. Все ПАВ относительно поведения их в воде делят на истинно растворимые и коллоидные. Истинно растворимые ПАВ в растворе находятся в молекулярно-дисперсном состоянии вплоть до концентраций, соответствующих их насыщенным растворам и разделению системы на две сплошные фазы. Главной отличительной особенностью коллоидных ПАВ является способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы (ассоциативные, или мицеллярные, коллоиды). К основным свойствам коллоидных ПАВ, обусловливающим их ценные качества и широкое применение, относятся высокая поверхностная активность; способность к самопроизвольному мицеллообразованию — образованию лиофильных коллоидных растворов при концентрации ПАВ выше некоторого определенного значения, называемого критической концентрацией мицеллообразования (KKM); способность к солюбилизации — резкому увеличению растворимости веществ в растворах коллоидных ПАВ вследствне их «внедрения» внутрь мицеллы; высокая способность стабилизировать различные дисперсные системы. При концентрациях выше KKM молекулы ПАВ собираются в мицеллы (ассоциируют) и раствор перехолит в мицеллярную (ассоциативную) коллоидную систему. Под мицеллой ПАВ понимают ассоциат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю, а лиофобные группы соединяются друг с другом, образуя ядро мицеллы. Число молекул, составляющих мицеллу, называют числом ассоциации, а общую сумму молекулярных масс молекул в мицелле, или произведение массы мицеллы на число Авогадро, — мицеллярной массой. Определенное ориентирование дифильных молекул ПАВ в мицелле обеспечивает минимальное межфазное натяжение на границе мицелла — среда. П 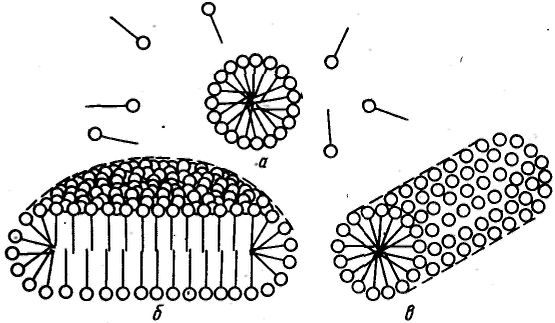 ри концентрациях ПАВ в водном растворе, несколько превышающих KKM, согласно представлениям Гартли образуются сферические мицеллы (мицеллы Гартли). Внутренняя часть мицелл Гартли состоит из переплетающихся углеводородных радикалов, полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл равен удвоенной длине молекул ПАВ. Число молекул в мицелле быстро растет в пределах узкого интервала концентраций, а при дальнейшем увеличении концентрации практически не изменяется, а увеличивается число мицелл. Сферические мицеллы могут содержать от 20 до 100 молекул и более. ри концентрациях ПАВ в водном растворе, несколько превышающих KKM, согласно представлениям Гартли образуются сферические мицеллы (мицеллы Гартли). Внутренняя часть мицелл Гартли состоит из переплетающихся углеводородных радикалов, полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл равен удвоенной длине молекул ПАВ. Число молекул в мицелле быстро растет в пределах узкого интервала концентраций, а при дальнейшем увеличении концентрации практически не изменяется, а увеличивается число мицелл. Сферические мицеллы могут содержать от 20 до 100 молекул и более.При увеличении концентрации ПАВ мицеллярная система проходит ряд равновесных состояний, различающихся по числам ассоциации, размерам и форме мицелл. При достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что способствует их деформации. Мицеллы стремятся принять цилиндрическую, дискообразную, палочкообразную, пластинчатую форму. Мицеллообразование в неводных средах, как правило, является результатом действия сил притяжения между полярными группами ПАВ и взаимодействия углеводородных радикалов с молекулами растворителя. Образующиеся мицеллы обращенного вида содержат внутри негидратированные или гидратированные полярные группы, окруженные слоем из углеводородных радикалов. Число ассоциации (от 3 до 40) значительно меньше, чем для водных растворов ПАВ. Как правило, оно растет с увеличением углеводородного радикала до определенного предела. Критическая концентрация мицеллообразования — важнейшая характеристика растворов ПАВ. Она зависит прежде всего от строения углеводородного радикала в молекуле ПАВ и характера полярной группы, наличия в растворе электролитов и неэлектролитов, температуры и других факторов. Факторы, влияющие на ККМ: 1) При увеличении длины углеводородного радикала повышается растворимость ПАВ и возрастает KKM. Разветвленность, непредельность и циклизация углеводородного радикала уменьшают склонность к мицеллообразованию и увеличивают KKM. Характер полярной группы играет существенную роль при мицеллообразовании в водных и неводных средах. 2) Введение электролитов в водные растворы неионогенных ПАВ слабо влияет на KKM и размер мицеллы. Для ионогенных ПАВ это влияние существенно. 3) Введение неэлектролитов (органических растворителей) в водные растворы ПАВ также приводит к изменению KKM. 4) Температура Методы определения KKM основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ в зависимости от концентрации (например, поверхностного натяжения σ, мутности τ, эквивалентной электропроводности λ, осмотического давления π, показателя преломления n). На кривой зависимости свойство — состав в области KKM обычно появляется излом. 1 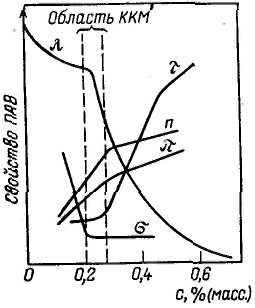 ) Кондуктометрический метод применяется для определения KKM ионогенных ПАВ. ) Кондуктометрический метод применяется для определения KKM ионогенных ПАВ.2) Другой метод' определения KKM основан на измерении поверхностного натяжения водных растворов ПАВ, которое резко уменьшается с ростом концентрации вплоть до KKM, а затем остается постоянным. 3) Солюбилизация красителей и углеводородов в мицеллах позволяет определять KKM ионогенных и неионогенных ПАВ как в водных, так и неводных растворах. При достижении в растворе ПАВ концентрации, соответствующей KKM, растворимость углеводородов и красителей резко увеличивается. 4) Измерение интенсивности светорассеяния при мицеллообразовании позволяет не только находить KKM по резкому увеличению наклона концентрационной кривой, но и опоеделять мицеллярную массу и числа ассоциации.
|
