Этиологические факторы хронических гастритов у детей. Этиологические факторы хронических гастритов у детей Г. В. Волынец
 Скачать 203.45 Kb. Скачать 203.45 Kb.
|
|
Этиологические факторы хронических гастритов у детей Г.В. Волынец Московский НИИ педиатрии и детской хирургии Росздрава В статье представлены данные исследования этиологических факторов различных типов хронического гастрита у 145 детей. У 40% больных на основании обнаружения аутоантител к париетальным клеткам желудка диагностирован аутоиммунный гастрит — гастрит типа А. инфекция Нelicobacter pylori (Н. pylori) выявлена у 44,8% детей. у 27,6% пациентов диагностирован гастрит типа С. Выявлена связь аутоиммунного гастрита у детей с активной фазой хронической Эпштейна-Барр вирусной инфекции. этиологическими факторами неаутоиммунного гастрита является Н. pylori (гастрит типа B) и множественные дуоденогастральные рефлюксы (гастрит типа С). Ключевые слова: дети, хронический гастрит, этиологические факторы, аутоиммунный гастрит, неаутоиммунный гастрит, хроническая активная Эпштейна-Барр вирусная инфекция, Нelicobacter pylori. Etiological factors of chronic gastritis in children Moscow Research Institute of Pediatrics and Children's Surgery, the Federal Agency for Healthcare and Social Development (Roszdrav) In the article the data on the study of the etiological factors of various types of chronic gastritis in children are presented. Based on revealing of the autoantibodies to parietal gastric cells in 40,0% of children autoimmune gastritis (A type gastritis) is diagnosed. Helicobacter pylori infection is revealed in 44,8% of children. In 27,6% of children type C gastritis is diagnosed. Autoimmune gastritis in children has been linked to the active phase of chronic Epstein-Barr virus infection. The etiological factors of nonautoimmune gastritis are Helicobacter pylori infection (type B gastritis) and multiple duodenogastric refluxes (type C gastritis). Key words: children, chronic gastritis, etiological factors, autoimmune gastritis, nonautoimmune gastritis, active phase of chronic Epstein-Barr virus infection, Helicobacter pylori infection. Актуальность исследования этиологических факторов хронического гастрита у детей связана с их непосредственным участием в патогенезе заболевания и до настоящего времени остающихся недостаточно изученными. В модифицированной Сиднейской классификации выделяют следующие типы хронических гастритов: атрофический (аутоиммунный — тип А и мультифокальный); неатрофический, или ассоциированный с H. pylori (тип В), и особые формы (химический, или реактивный рефлюкс-гастрит — тип С, радиационный, лимфоцитарный, неинфекционный гранулёматозный, эозинофильный) [1, 2]. Многочисленные исследования, посвящённые изучению роли H. pylori в патологии верхних отделов желудочно-кишечного тракта показывают, что не всегда антихеликобактериальная терапия обеспечивает эрадикацию возбудителя и купирование эндоскопически визуализируемых изменений слизистой оболочки желудка [3-5]. Имеются наблюдения, когда успешная эрадикация H. pylori не сопровождается исчезновением воспалительных изменений в слизистой оболочке желудка [6, 7]. Довольно часто у детей с хроническим гастродуоденитом встречаются нарушения моторно-эвакуаторной функции желудка и двенадцатиперстной кишки, сопровождающиеся дуоденогастральными рефлюксами. Кроме H. pylori, роль которого в возникновении хронического гастрита считается доказанной, остаётся неизученной роль вирусных инфекций, которые также могут способствовать возникновению заболеваний верхних отделов органов пищеварения. В последние годы появились сообщения о возможной триггерной роли герпесвирусов, энтеровирусов, хламидий и других возбудителей, персистирующих в организме человека, в запуске иммунопатологических механизмов в различных органах и тканях [8-12]. При этом особую тропность к эпителию слизистой оболочки желудочно-кишечного тракта в связи с развитой в ней лимфоидной системой имеет вирус Эпштейна-Барр [13-16]. Среди группы атрофических гастритов у взрослых особое место занимает аутоиммунный гастрит [1]. Аутоиммунный гастрит впервые был описан McIntyre et al. в 1965 г. у пациентов с пернициозной анемией. У этих больных наблюдались гистаминоустойчивая ахлоргидрия, атрофия слизистой оболочки желудка и антитела к внутреннему фактору Кастла [17]. Считается, что аутоиммунный гастрит обычно развивается в пожилом возрасте, а у детей он встречается редко и в структуре хронических гастритов составляет от 1-3 до 14% [18, 19]. В основе этого заболевания лежит воспаление фундального отдела желудка в результате поражения его слизистой оболочки аутоантителами к париетальным клеткам желудка, что приводит к их атрофии [1, 20-26]. Аутоантитела к микросомальным элементам париетальных клеток являются органо- и клеточноспецифичными. Они связываются с микроворсинками внутриклеточной системы канальцев париетальных клеток [27]. Среди антител к париетальным клеткам желудка есть антитела к гастрин-связывающим белкам, блокирующие рецепторы гастрина [28]. У 30% больных аутоиммунным гастритом выявляются антитела против H+/K+-АТФазы, обеспечивающей функцию протонного насоса при секреции кислоты. Антитела к протонному насосу способны блокировать его функцию [21, 29]. Установлена связь между уровнем аутоантител к париетальным клеткам желудка и степенью ингибиции данного фермента, что свидетельствует о ведущей патогенетической роли аутоантител к H+/K+-АТФазе в развитии гипо- и ахлоргидрии при аутоиммунном гастрите [21, 30, 31]. Цитотоксичность циркулирующих аутоантител не доказана. Не исключено, что гастрит инициируется различными внешними факторами, а затем в патогенез включаются аутоиммунные процессы, ведущие к прогрессированию заболевания у генетически предрасположенных людей. Имеются сведения о том, что аутоантитела к париетальным клеткам желудка могут оказывать специфическое цитотоксическое действие на париетальные клетки с участием факторов комплемента [28]. При этом развиваются антитело- и комплементзависимые цитотоксические реакции, которые приводят к деструкции слизистой оболочки желудка [30]. В фундальном отделе развивается тяжёлый атрофический гастрит с гибелью специфических желёз, замещающихся псевдопилорическими железами и кишечным эпителием [32-35]. В отличие от гастрита типа В, антральный отдел желудка сохраняет свое строение [36]. Однако у 36% пациентов атрофический фундальный гастрит сочетается с антральным, который может быть не только поверхностным, но и атрофическим [37]. Этот факт можно объяснить или особенностями течения аутоиммунного гастрита, или его сочетанием с гастритом типа В [36]. Однако при антральном гастрите аутоиммунного генеза у больных с пернициозной анемией Н. pylori обнаруживается лишь в 6,5% случаев. При этом аутоантитела к париетальным клеткам пилорического отдела желудка не описаны [37]. Аутоиммунный гастрит развивается много лет и характерными его симптомами у взрослых считаются гипо-, а затем и ахлоргидрия, что является результатом атрофии париетальных клеток. Эта форма гастрита часто встречается у лиц, имеющих не только пернициозную анемию но и другие аутоиммунные болезни [21, 38]. Описаны случаи пернициозной анемии, ассоциированной с аутоиммунным гастритом, у детей 11 и 12 лет [39]. Аутоантитела против микросомальных антигенов париетальных клеток, специфичные для гастрита типа А, встречаются при таких заболеваниях, как сахарный диабет I типа, тиреоидит, болезнь Аддисона. Предполагается, что аутоиммунный гастрит связан с диффузным тиреотоксическим зобом, особенно у пациентов с выраженным аутоиммунным процессом [38, 40]. Имеются работы, показывающие ассоциацию аутоиммунного гастрита с первичным билиарным циррозом [41]. Остаются неясными отношения между Н. pylori и аутоиммунным гастритом. В некоторых случаях, антитела к Н. pylori могут действовать как антитела к париетальным клеткам и вести к атрофическому аутоиммунному гастриту [42, 43]. В оболочке Н. pylori предполагается наличие антигена, который фиксируется на эпителиальных клетках слизистой оболочки желудка. Остаётся неясным механизм привлечения его к образованию антител к париетальным клеткам желудка, которые выявляются у 30-50% взрослых больных аутоиммунным гастритом. Связь Н. руlori-инфекции с аутоиммунным гастритом у детей отражена лишь в единичных работах [23, 44-46]. Выявлено, что антитела к париетальным клеткам желудка, часто обнаруживаемые у взрослых, инфицированных Н. pylori, не выявляются у детей [47]. Однако имеются сведения, о том что у 27,7% детей с Н. pylori-ассоциированным гастритом определяются антитела к H+/K+-АТФазе. Этот факт позволил сделать вывод о том, что у детей, имеющих наследственную предрасположенность к аутоиммунным заболеваниям, на фоне хеликобактериоза может развиваться начальная стадия аутоиммунного хронического гастрита [48-50]. Сведения о связи аутоиммунного гастрита с Н. pylori -инфекцией у взрослых позволили S. Eight et al. в 1996 г. выделить особую форму аутоиммунного гастрита — «активный аутоиммунный гастрит», возникающий на фоне Н. pylori-инфекции [51]. Эту форму гастрита описывают и другие исследователи [52]. M. Stolte et al. (1998) приводят пример излечения пациента с аутоиммунным гастритом после эрадикации Н. pylori [53]. Имеются сообщения о том, что у пациентов с атрофическим гастритом эрадикация Н. pylori приводит к уменьшению патологических морфологических проявлений заболевания, хотя полного излечения на этой стадии добиться не удаётся [54, 55]. Учитывая всё выше изложенное, было проведено настоящее исследование, целью которого явился анализ этиологических факторов хронических гастритов у детей. ПАЦИЕНТЫ И МЕТОДЫ Под нашим наблюдением в отделении гастроэнтерологии и эндоскопических методов исследования МНИИ педиатрии и детской хирургии Росздрава с января 2002 г. по январь 2006 г. находились 145 детей (79 мальчиков и 66 девочек) в возрасте от 3 до 17 лет (средний возраст — 10,1 ± 0,3 года) с заболеваниями верхних отделов органов пищеварения. Все больные были разделены на 3 группы. Первую группу составили 70 пациентов (37 мальчиков и 33 девочки) с неаутоиммунным гастритом в возрасте от 3 до 17 лет (средний возраст 10,1 ± 0,5 года). У детей этой группы ни на момент включения в исследование, ни при динамическом наблюдении через 6 мес и через год, а в некоторых случаях через 2 года не обнаруживались аутоантитела к микросомам париетальных клеток желудка, являющихся маркёрами аутоиммунного гастрита. В зависимости от наличия или отсутствия Н. pylori дети первой группы были разделены на 2 подгруппы. Первую подгруппу составили 30 больных с гастритом типа В, ассоциированным с Н. pylori-инфекцией. Вторую подгруппу составили 40 детей с гастритом типа С без Н. pylori-инфекции. Вторую группу составили 58 детей (35 мальчиков и 23 девочки) с аутоиммунным гастритом в возрасте от 4 до 17 лет (средний возраст — 10,8 ± 0,5 года). У всех детей этой группы выявлялись аутоантитела к микросомам париетальных клеток желудка. Дети с аутоиммунным гастритом по наличию или отсутствию Н. pylori также были разделены на 2 подгруппы. Первую подгруппу составили 23 ребёнка, не имеющих Н. pylori-инфекции (гастрит типа А). Вторую подгруппу составили 35 пациентов с Н. pylori-инфекцией (гастрит типа А+В). Из обеих групп были исключены дети с редко встречающимися формами хронического гастрита (радиационным гастритом, гастритом, ассоциированным с целиакией, неинфекционным гранулематозным гастритом, эозинофильным гастритом), а также больные, получающие нестероидные противовоспалительные препараты. Третью группу (группу сравнения) составили 17 детей — средний возраст 7,0 ± 0,8 года — у которых имели место нарушения моторики желудка и двенадцатиперстной кишки, не сопровождавшиеся эндоскопическими и морфологическими признаками хронического гастрита. У детей группы сравнения не было обнаружено ни инфекции Н. pylori, ни хронической Эпштейна-Барр вирусной инфекции. Диагноз хронического гастрита верифицировался с помощью эндоскопического исследования гастроинтестинальным видеоскопом ЭВИС ЭКСЕРА «OLYMPUS СV-160» (Япония). При этом проводилась прицельная биопсия слизистой оболочки антрального отдела желудка с проведением экспресс-теста диагностики Н. pylori с помощью определения уреазной активности Н. pylori в биоптате («Биохит», Россия). В биоптатах слизистой оболочки фундального и антрального отделов желудка проводилось определение ДНК Н. pylori методом ПЦР с использованием коммерческого набора АмплиСенс Helicobacter pylori (Интерлабсервис ЦНИИ эпидемиологии МЗ РФ, Россия). Кроме того, в сыворотке крови исследовались антитела класса IgG к Н. pylori методом иммуноферментного анализа (ИФА). Диагноз аутоиммунного гастрита устанавливался на основании обнаружения аутоантител к микросомам париетальных клеток желудка в титрах 1:20 и более методом непрямой иммунофлюоресценции в лаборатории клинической иммунологии Института ревматологии РАМН. Титр аутоантител 1:10 считался слабоположительным, расценивался как «сомнительный» и в разработку не входил. Для выявления роли герпесвирусной инфекции в формировании хронического гастрита всем детям проведено серологическое исследование крови методом ИФА на антитела (IgM, IgG) к вирусам герпеса 1-2 типов, антитела IgM, IgG к цитомегаловирусу (ЦМВ), а также к вирусу Эпштейна-Барр с помощью коммерческих тест-систем фирм «HUMAN» (Германия), BioRad (Франция), «Вектор-Бест» (Россия). Всем пациентам проводилось определение ДНК вируса герпеса 1 и 2 типов, цитомегаловируса и вируса Эпштейна-Барр в крови, а также слизистой оболочке желудка методом ПЦР. Для выделения ДНК вируса Эпштейна-Барр использовался коммерческий набор «ДНК-сорб-В» фирмы «АмплиСенс» Центрального НИИ эпидемиологии МЗ и СР РФ. Для выявления амплификации участка ДНК вируса Эпштейна-Барр 290 п.н. использовался набор «Ампли-Сенс-100-R» (кат. N V-9-100-R), заявленная чувствительность 1000 копий-эквивалент вирусного генома/мл (исследование проводилось в лаборатории клинико-вирусо-логической диагностики гепатитов и СПИДа Гематологического научного центра РАМН). Выявление вируса Эпштейна-Барр в биоптатах слизистой оболочки желудка методом непрямой иммунофлюоресценции с использованием поликлональных антител производства НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи проводилось в лаборатории эпидемиологии оппортунистических инфекций НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи. На основании результатов серологического исследования, а также по данным ПЦР-диагностики выделялись латентная и активная фазы Эпштейна-Барр вирусной инфекции. Маркёрами латентной фазы являлись: • наличие антител класса IgG к ядерному позднему антигену вируса в сыворотке крови в количестве больше 10-15 у.е.; • отсутствие антител класса IgM к капсидному антигену вируса в сыворотке крови; • отсутствие антител класса IgG к раннему поверхностному антигену вируса; • отрицательная ПЦР диагностика ДНК вируса в крови и в биоптатах слизистой оболочки желудка. Маркёрами активной фазы хронической Эпштейна-Барр инфекции были: • наличие антител класса IgG к ядерному позднему антигену вируса в сыворотке крови в количестве больше 10-15 у.е.; • наличие антител класса IgG к раннему поверхностному антигену вируса и/или • наличие в сыворотке крови антител класса IgM к капсидному антигену вируса и/или • положительный результат определения ДНК вируса в крови и/или в биоптатах слизистой оболочки желудка по данным ПЦР Для определения состояния кислотообразующей функции желудка всем детям проводилась суточная внутрижелудочная рН-метрия с использованием аппарата "Гастроскан-5" фирмы "Исток-Система" (Россия). Для верификации дуоденогастральных и гастроэзофагеальных рефлюксов, а также определения электрической активности желудка и двенадцатиперстной кишки при заболеваниях верхних отделов органов пищеварения проводилась периферическая компьютерная электрогастроэнтерография аппаратом "Миограф" фирмы "Исток-Система" (Россия). РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Обследование на вирус герпеса 1 и 2 типов показало, что антител класса IgM не было обнаружено ни у одного ребёнка. Антитела класса IgG к вирусам герпеса 1 и 2 типов в титре от 1:800 до 1:12800 были выявлены у 16 детей (11,1%); при этом у 14 (9,7%) больных титры антител превышали 1:1600. ДНК вируса герпеса 1-2 типов в клетках крови не обнаружены ни у одного ребёнка. В слизистой оболочке желудка ДНК определилась — у 2 (1,4%) детей. Обследование на ЦМВ показало, что антитела класса IgM к цитомегаловирусу в сыворотке крови выявлены у 6 (4,2%) детей; антитела класса IgG в титрах от 1:800 до 1:6400 — у 21 (14,6%) ребёнка, при этом у 11 (7,6%) детей титр антител превышал 1:1600. ДНК цитомегаловируса в клетках крови обнаружена у трёх больных, в слизистой оболочке желудка — у 4 (2,1%) детей. Одновременное наличие ДНК цитомегаловируса в крови и биоптатах слизистой оболочки желудка наблюдалось лишь у 1 (0,7%) ребёнка. При этом у него были положительными антитела класса IgM и IgG. По результатам совокупности серологических методов исследования и ПЦР диагностики ДНК в крови и биоптатах слизистой оболочки желудка хроническая вирусная Эпштейна-Барр инфекция диагностирована у 111 (76,6%) пациентов. При этом латентная фаза определялась у 35 (31,5%), активная фаза — у 76 (68,5%) детей. У 44 обследованных пациентов в биоптатах слизистой оболочки желудка определялась ДНК вируса Эпштейна-Барр. На основании совокупности ПЦР диагностики ДНК Н. pylori в биоптатах слизистой оболочки желудка, бактериоскопического метода выявления инфекции и серологического метода исследования крови на наличие антител класса IgG к Н. pylori методом ИФА этот инфекционный агент был выявлен у 65 (44,8%) обследованных детей. Нарушения моторики желудка и двенадцатиперстной кишки на основании данных эндоскопического метода исследования, суточной рН-метрии и периферической компьютерной электрогастроэнтерографии выявлены у 117 из 145 (80,7%) детей. При этом гастроэзофагеальный рефлюкс определялся у 93 (64,1%) из 145 пациентов, дуоденогастрофазеальный рефлюкс — у 73 (50,3%) из 145. Одновременно гастроэзофагеальный рефлюкс и дуоденогастральный рефлюкс диагностированы у 49 (33,8%) из 145 детей. У 58 обследованных детей (40,0%) обнаружены аутоантитела к париетальным клеткам желудка, служащие критерием диагностики аутоиммунного гастрита. При этом другие аутоиммунные заболевания, сопровождающиеся диспротеинемией, гипергаммаглобулинемией, повышением уровня С-реактивного белка, наличием аутоантител в диагностических титрах выявлены не были. Недиагностические титры аутоантител (1:20-1:40) обнаруживались в некоторых случаях (табл.), но при динамическом наблюдении и повторных исследованиях положительных результатов или нарастания титров аутоантител до диагностических не наблюдалось. Это позволяет сделать заключение о том, что у наблюдаемых пациентов аутоиммунный гастрит являлся самостоятельным заболеванием, а не сопутствующим при других аутоиммунных процессах. У 26 обследованных детей ни H. pylori, ни хроническая гер-песвирусная инфекции не выявлялись. У 17 65,4%) пациентов (имели место нарушения моторно-эвакуаторной функции желудка и двенадцатиперстной кишки, не сопровождавшиеся эндоскопическими и морфологическими признаками хронического гастрита. У 9 (34,6%) детей этой группы диагностированы нарушения моторно-эвакуаторной функции желудка и двенадцатиперстной кишки со множественными дуоденогастральными рефлюксами и хроническим гастритом типа С. Частота обнаружения аутоантител к париетальным клеткам желудка в зависимости от инфицированности вирусом Эпштейна-Барр, её активности и наличия H. pylori показана на рис. 1. Из представленных данных следует, что аутоиммунный гастрит статистически значимо чаще диагностировался при хронической Эпштейна-Барр инфекции (55 случаев из 111 — 49,5% против 3 случаев из 34 — 8,8% при её отсутствии; χ2 = 16,330; p < 0,001). При этом на фоне латентной фазы хронической вирусной инфекции частота обнаружения аутоантител к париетальным клеткам желудка (5 случаев из 35 — 14,3%) статистически значимо не отличалось (χ2 = 0,111; p = 0,740) от таковой при отсутствии хронической Эпштейна-Барр инфекции. Этот факт при дальнейшем анализе полученных результатов исследования позволил нам объединить эти две группы. У детей с активной фазой хронической Эпштейна-Барр инфекции частота выявления аутоантител к париетальным клеткам желудка составляла 50 (65,8%) случаев из 76, что статистически значимо выше, чем в латентную фазу (χ2 = 23,411; p < 0,001). Особенно высока была связь между наличием аутоантител к париетальным клеткам желудка и обнаружением ДНК вируса Эпштейна-Барр, свидетельствующая об активной репликации вируса в биоптатах слизистой оболочки желудка (40 случаев из 44 — 90,9%). Исследования ассоциации H. pylori с аутоиммунным гастритом у детей показало следующее. При сочетании H. pylori с латентной фазой хронической Эпштейна-Барр инфекцией или её отсутствием антитела к париетальным клеткам желудка выявлялись лишь в 4 случаях из 24 (16,7% случаев). При сочетании H. pylori с активной фазой хронической Эпштейна-Барр инфекцией — в 31 (75,6%) случае из 41, что имеет высокую статистическую значимость различий (χ2 = 18,858; p < 0,001). Активная фаза хронической Эпштейна-Барр инфекции без H. pylori сопровождались наличием аутоантител к париетальным клеткам желудка в 19 (54,3%) случаях из 35. При активной фазе хронической Эпштейна-Барр инфекции, сопровождавшейся наличием H. pylori, аутоантитела к париетальным клеткам желудка определялись в 31 (75,6%) случае из 41, что можно расценить как тенденцию к более высокой частоте встречаемости (х2 = 2,926; p = 0,087) аутоиммунного гастрита при активной фазе хронической Эпштейна-Барр инфекции в сочетании с Н. pylori, чем без неё. Таблица. Частота встречаемости аутоантител у детей с хроническим гастритом
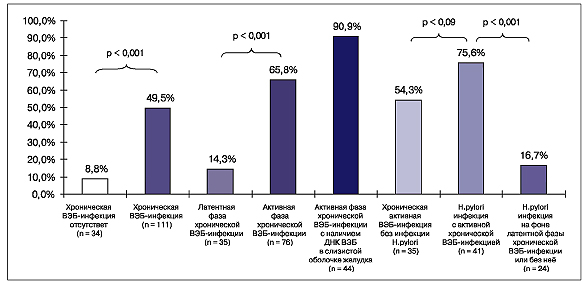 Рис. 1. Частота обнаружения аутоантител к париетальным клеткам желудка (в %) в зависимости от инфицированности вирусом Эпштейна-Барр (ВЭБ), активности хронической ВЭБ инфекции и инфицированности H. pylori Всего хроническая Эпштейна-Барр вирусная инфекция в сочетании с Н. pylori выявлена в 57 (51,4%) случаях из 111, из них аутоиммунный гастрит диагностирован в 32 (56,1%) случаях из 57. Хроническая Эпштейна-Барр вирусная инфекция без Н. pylori выявлена в 54 (48,6%) случаях из 111, при этом аутоиммунный гастрит диагностирован в 22 (40,7%) случаях из 54. Статистически значимой разницы (χ2 = 2,1; p = 0,152) при сравнении частоты выявления аутоантител к париетальным клеткам желудка в этих группах не получено. Это позволяет заключить, что на фоне хронической Эпштейна-Барр инфекции аутоиммунный гастрит развивается независимо от наличия или отсутствия инфекции Н. pylori. При выявлении ДНК вируса Эпштейна-Барр в слизистой оболочке желудка в сочетании с Н. pylori аутоиммунный гастрит развивался в 26 (89,7%) случаях из 29, без Н. pylori — в 14 (93,3%) случаях из 15; χ2 = 0,023; p = 0,880. Это также позволяет заключить, что аутоиммунный гастрит развивался у пациентов с хронической Эпштейна-Барр инфекцией, имеющих ДНК вируса Эпштейна-Барр в слизистой оболочке желудка, независимо от инфицированности Н. pylori. Анализ этиологии аутоиммунного гастрита показал, что у 23 (39,7%) пациентов из 58 не было выявлено инфекции Н. pylori, из них в 5 (8,6%) случаях гастрит типа А сопровождался множественными дуоденогастральными рефлюксами и гастритом типа С, что позволило расценивать этот вариант аутоиммунного гастрита, как гастрит типа А+С (аутоиммунный гастрит типа А, сопровождающийся множественными дуоденогастральными рефлюксами и гастритом типа С). У всех 23 детей с гастритом типа А диагностирована хроническая Эпштейна-Барр инфекция, что позволило считать этот вариант аутоиммунного гастрита ассоциированным с вирусом Эпштейна-Барр (рис. 2). У 35 (60,3%) детей из 58 выявлена Н. pylori-инфекция, при этом у 32 имела место хроническая Эпштейна-Барр вирусная инфекция. Полученные данные позволили нам считать этот вариант аутоиммунного гастрита смешанным гастритом — гастрит типа А+В (аутоиммунный гастрит — тип А, Эпштейна-Барр ассоциированный, сопровождающийся Н. pylori и гастритом типа В). У 6 (10,3%) пациентов этой группы выявлены множественные дуоденогастральные рефлюксы и ассоциированный с ними гастрит типа С. Полученные данные позволили считать этот вариант аутоиммунного гастрита смешанным аутоиммунным гастритом — гастрит типа А+В+С (аутоиммунный гастрит — тип А, Эпштейна-Барр ассоциированный, сопровождающийся Н. pylori и гастритом типа В и множественными дуоденогастральными рефлюксами с гастритом типа С). 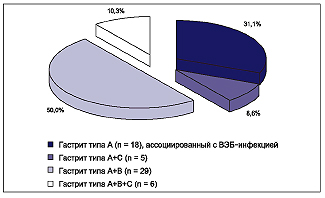 Рис. 2. Этиологическая характеристика аутоиммунного гастрита у детей и частота встречаемости различных его вариантов Таким образом, аутоиммунный гастрит у детей в 55 (94,8%) случаях из 58 диагностировался на фоне активной фазы хронической Эпштейна-Барр инфекции. 35 (60,3%) случаев аутоиммунного гастрита из 58 сопровождались наличием Н. pylori. При этом аутоиммунный гастрит в присутствии Н. pylori на фоне активной фазы хронической Эпштейна-Барр инфекции развивался в 31 (88,6%) случае из 35, а на фоне латентной фазы вирусной Эпштейна-Барр инфекции или при её отсутствии в 4 (11,4%) случаях из 35; χ2 = 42,299; р < 0,001. Аутоиммунный гастрит у детей на фоне активной фазы хронической Эпштейна-Барр инфекции при отсутствии Н. pylori встречался в 19 (32,8%) случаях из 58, а на фоне латентной фазы хронической вирусной Эпштейна-Барр инфекции или при её отсутствии и отрицательном Н. pylori — в 4 (6,9%) случаях из 58; χ2 = 10,629; р < 0,001. У 70 наблюдаемых детей диагностирован неаутоиммунный гастрит. Анализ этиологической характеристики неаутоиммунного гастрита показал, что из 70 детей у 40 (57,1%) диагностированы множественные дуоденогастральные рефлюксы и хронический гастрит (гастрит типа С). У 30 (42,9%) пациентов выявлен Н. pylori и диагностирован хронический гастрит типа В. Из них у 15 пациентов наблюдались множественные дуоденогастральные рефлюксы и признаки ассоциированного с ними гастрита. Это позволило нам считать данный вариант неаутоиммунного гастрита смешанным гастритом типа В+С (хеликобактерассоциированный гастрит — гастрит типа В, сопровождающийся множественными дуоденогастральными рефлюксами и гастритом типа С) (рис. 3). 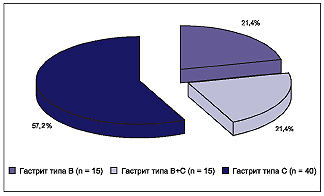 Рис. 3. Этиологическая характеристика неаутоиммунного гастрита и частота встречаемости различных его вариантов у наблюдаемых детей Хроническая Эпштейна-Барр вирусная инфекция при неаутоиммунном гастрите диагностировалась у 56 (80,0%) детей из 70. При этом достоверно чаще (х2 = 23,411; p < 0,001) диагностировалась её латентная фаза (30 случаев из 56 — 53,6%), чем при аутоиммунном гастрите (5 случаев из 55 — 9,1%). ДНК вируса Эпштейна-Барр в биоптатах слизистой оболочки желудка обнаруживалась статистически значимо реже (4 случая из 56 — 7,1%) у детей с неаутоиммунным гастритом по сравнению с детьми, имеющими аутоиммунный гастрит (40 случаев из 55 — 72,7%); х2 = 47,179; p < 0,001. Таким образом, неаутоиммунный гастрит у детей на фоне активной фазы хронической Эпштейна-Барр инфекции развивался в 26 (37,1%) случаях из 70, на фоне латентной фазы или отсутствии Эпштейна-Барр инфекции — в 44 (62,9%) случаях из 70. В 30 (42,9%) случаях из 70 неаутоиммунный гастрит сопровождался наличием H. pylori. При этом H. pylori на фоне активной фазы хронической Эпштейна-Барр инфекции провоцировала развитие неаутоиммунного гастрита в 10 (14,3%) случаях из 70, а на фоне латентной фазы инфекции или при её отстутствии — в 20 (28,6%) случаях из 70. Неаутоиммунный гастрит типа С у детей сопровождался активной фазой хронической вирусной Эпштейна-Барр инфекции в 16 (40,0%) случаях из 40, а латентной фазой или отсутствием инфекции — в 24 (60,0%) случаях из 40. Среди основных патогенетических типов хронического гастрита (аутоиммунного и неаутоиммунного) имелись различные варианты, ассоциировавшиеся с H. pylori, хронической Эпштейна-Барр вирусной инфекцией и множественными дуоденогастральными рефлюксами с ассоциированным с ними гастритом. Так, аутоиммунный гастрит может быть ассоциированным с вирусом Эпштейна-Барр (гастрит типа А), и с хронической активной Эпштейна-Барр инфекцией в сочетании с H. pylori (гастрит типа А+В). Кроме того, в каждом из вариантов аутоиммунного гастрита встречались множественные дуоденогастральные рефлюксы, ассоциированный с ними гастрит (гастрит типа С) (рис. 4). 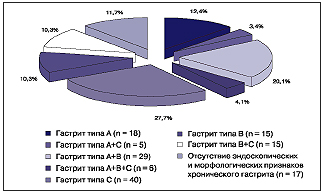 Рис. 4. Частота встречаемости основных патогенетических типов хронического гастрита и их вариантов у наблюдаемых детей (n = 145) Неаутоиммунный гастрит также может быть ассоциированным со множественными дуоденогастральными рефлюксами (гастрит типа С), а также с H. pylori (гастрит типа В). Кроме того, имели место варианты смешанного типа неаутоиммунного гастрита, когда гастрит типа В сопровождался множественными дуоденогастральными рефлюксами и ассоциированным с ними гастритом (гастрит типа В+С). Гастрит типа С может быть как самостоятельным вариантом неаутоиммунного гастрита, так и встречаться при других патогенетических типах хронического гастрита у детей (рис. 4). Достаточно высокая частота встречаемости гастрита типа С может провоцироваться снижением адаптационных способностей детского организма к резко изменившимся предлагаемым условиям среды обитания [12, 13]. Этот вариант гастрита наряду с развитием воспалительной реакции со стороны слизистой оболочки верхних отделов желудочно-кишечного тракта и снижения иммунологической реактивности, возникающей, как правило на фоне хронических инфекций, сопровождается возникновением различной степени выраженности минимальных мозговых дисфункций с дуоденогастральным и гастроэзофагеальным рефлюксами. Таким образом, результаты проведённого исследования позволили сделать следующие выводы: 1. В структуре заболеваний верхних отделов органов пищеварения у детей в 40% случаев диагностировался хронический аутоиммунный гастрит, характеризовавшийся наличием аутоантител к париетальным клеткам желудка. Хронический аутоиммунный гастрит у детей в 86,2% случаев протекал на фоне активной фазы хронической Эпштейна-Барр вирусной инфекции, а у 60,3% больных сопровождался наличием H. pylori. Аутоиммунный гастрит у детей с латентной хронической Эпштейна-Барр вирусной инфекции или её отсутствии регистрировался лишь в 6,9% случаев. 2. Неаутоиммунный гастрит в структуре поражений верхних отделов органов пищеварения у детей составлял 48,3% и в 42,9% случаев был обусловлен H. pylori-инфекции, а в 57,1% случаев — нарушениями моторно-эвакуаторной функции желудка и двенадцатиперстной кишки со множественными дуоденогастральными рефлюксами и гастритом типа С. Гастрит типа С может встречаться при других типах хронического гастрита у детей. СПИСОК ЛИТЕРАТУРЫ 1. Аруин Л.И. Новая классификация гастрита // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 1997. — Т. YIII. — № 3. — С. 82-85. 2. Stolte M., Meining A. The updated Sydney system: classification and grading of gastritis as the basis of diagnosis and treatment // Can. J. Gastroenterol. — 2001. — V. 15, № 9. — Р. 591-598. 3. Баранов А.А. и др. Детская гастроэнтерология / Баранов А.А., Е.В.Климанская, Г.В.Римарчук. — М., 2002. — 592 с. 4. Диагностика и лечение инфекции Helicobacter pylori, современные представления (Доклад второй конференции по принятию консенсуса в Маастрихте 21-22 сентября 2000 г.) // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2000. — № 6. — С. 7-9. 5. Malfertheiner P., Megraud F., O'Morain C. Guidelines for the management of Helicobacter pylori infection. Summary of the Maastricht-3 2005 Consensus Report. 6. Исаков В.А., Щербаков П.Л. Комментарии к Маастрихтскому соглашению — 2-2000 // Педиатрия. — 2002. — № 2 (приложение). — С. 5-8. 7. Щербаков П.Л. Вопросы педиатрической гастроэнтерологии // Русский медицинский журнал. — 2003. — Т. 11, № 3. — С. 107-112. 8. Волынец Г.В., Хавкин А.И., Филатов Ф.П. К вопросу об этиологии аутоиммунного гастрита у детей // Медлайн-Экспресс. — 2004. — № 8-9. — С. 6-8. 9. Рябчук Ф.Н. Роль персистирующих и латентных инфекций в эволюции патологического процесса у детей // Сб. научных работ кафедры педиатрии №2 с курсом гастроэнтерологии, посвященный 50-летию кафедры. Актуальные проблемы педиатрии. — СПб., 2004. — С. 126-135. 10. Сидорова И.С, Черниченко И.Н. Внутриутробные инфекции: хламидии, микоплазмоз, герпес, цитомегалия // Рос. вестн. пе-ринатологии и педиатрии. — 1998. — № 3. — С. 7-13. 11. Kangro H.O., Chong S.K.F., Hardiman A. et al. A prospective study of viral and mycoplasma infection in chronic inflammatory bowel discase // Gastroenterol. — 1990. — V. 98. — P. 549-553. 12. Yarilin D.A., Valiando J., Posnett D.N. A mouse herpesvirus induces relapse of experimental autoimmune arthritis by infection of the inflammatory target tissue // Jurnal of Immunologi. — 2004. — V. 173. — P. 5238-5246. 13. Grinstein S., Preciado M.V., Gattuso P., Chabay P.A., Warren W.H., De Matteo E., Gould V.E. Demonstration of Epstein-Barr virus in carcinomas of various sites // Cancer Res. — 2002. — V. 62, № 17. — Р. 4876-4878. 14. Tajima M., Komuro M., Okinaga K. Establishment of Epstein-Barr virus-positive human gastric epithelial cell lines // Jpn. J. Cancer Res. — 1998. — Mar. № 89 (3). — Р. 262-268. 15. Takasaka N., Tajima M., Okinaga K., Satoh Y, Hoshikawa Y, Katsumoto T., Kurata T., Sairenji T. Productive infection of Epstein-Barr virus (EBV) in EBV-genome-positive epithelial cell lines (GT38 and GT39) derived from gastric tissues // Virology. — 1998. — Aug. № 247 (2). — Р. 152-159. 16. Zhang Y, Molot R. Severe gastritis secondary to Epstein-Barr viral infection. Unusual presentation of infectious mononucleosis and associated diffuse lymphoid hyperplasia in gastric mucosa // Arch. Pathol. Lab. Med. — 2003. — Apr. № 127 (4). — Р. 478-480. 17. McIntyre O.R., Sullivan L.W., Jefries G.H., Silver R.H. Pernicious anemia in childhood // New. Eng. J. Med. — 1965 — № 272. — Р. 981. 18. Вагапова Л.Б. О возможной роли вирусной инфекции в развитии хронического гастрита у детей // Сб. науч. раб. им. Я.Д. Витебского Детская гастроэнтерология Сибири (проблемы и поиски решений / Отв. ред. М.Ю. Денисов. Новосибирск-Курган, 1998. — Вып. II. 19. Шабалов Н.П. Заболевания органов пищеварения // Детские болезни / Н.П. Шабалов. — 5-е издание. — Том 1. — СПб.: Издательский дом «ПИТЕР». — 2002. — 829 с. 20. Abdul-Ghani MA., Feldman R., Shai M., Varkel J. Atrophic gastritis presenting with pulmonary embolism // Harefuah. — 2000, Dec. — № 139 (11-12). — Р. 414-416, 496. 21. Bergman M.P., Amedei A., D'Elios M.M., Azzurri A., Benagiano M., Tamburini C, van der Zee R. Characterization of H+,K+-ATPase T cell epitopes in human autoimmune gastritis. Vandenbroucke-Grauls CM. Appelmelk BJ. Del Prete G // Eur. J. Immunol. — 2003. — Feb. № 33 (2). — Р. 539-545. 22. Dickey W. Low serum vitamin B12 is common in coeliac disease and is not due to autoimmune gastritis // Eur. J. Gastroenterol. Hepatol. — 2002. — Apr. № 14 (4). — Р. 425-427. 23. Faller G., Kirchner T. Helicobacter pylori and antigastric autoim-munity // Pathologe. — 2001. — Jan. № 22 (1). — Р. 25-30. 24. Faller G., Kirchner T. Role of antigastric autoantibodies in chronic Helicobacter pylori infection // Microsc. Res. Tech. — 2000. Mar. № 48 (6). — Р. 321-326. 25. Ming-Shiang W.U., Chia-Tung Shun, Chung-Chun W.U. et al. Epstein-Barr virus-associated gastric careinomas: relation to H. pylori infection and genetic alterations // Gastroenterol. — 2000. — V. 118. — P. 1031-1038. 26. van Driel I.R., Baxter A.G., Laurie K.L., Zwar T.D., La Gruta N.L., Judd L.M., Scarff K.L., Silveira P.A., Gleeson P.A. Immunopathogenesis, loss of T cell tolerance and genetics of autoimmune gastritis // The Russell Grimwade School of Biochemistry and Molecular Biology, The University of Melbourne, Parkville, Victoria 3010, Australia. 27. Wright R. Role of autoimmunity in disease of gastrointestinal tract and liver // Immunology of gastrointestinal tract and liver / Ed. by M.F Heyworth, A.L. Jones.- Raven Press.- New-York, 1988. — Р. 193-199. 28. De Aizpurua H.J., Ungar B., Toh B.H. Autoantibody to the gastrin receptor in pernicious anemia // N. Engl. J. Med. — 1985. — V. 313. — Р. 479-483. 29. Karlson F.A., Burman P., Loof L., Mardh S. The major parietal cell antigen in autoimmune gastritis with pernicious anemia is the acid-producing H,K-ATPase of the stomach // J. Clin. Invest. — 1988. — V. 81. — Р. 465-479. 30. Burman P., Mardh S., Korberg L., Karlson FA. Parietal cell antibodies in pernicious anemia inhibit H, K-adenosine triphosphatase the proton pump of stomach // Gastroenterology. — 1989. — V. 96. — Р. 1434-1438. 31. Jones C.M., Toh B.H., Pettitt J.M., Martinell T.M., Humphris D.C., Callaghan J.M. et al. Monoclonal antibodies specific for the beta subunit of the gastric proton pump (H+/K+-ATPase). An autoantigen targeted in per-nicionus anaemia // Eur. J. Biochem. 1991. — V. 197. — № 1. — P .49. 32. Jhala N.C., Montemor M., Jhala D., Lu L, Talley L, Haber M.M., Lechago J. Pancreatic acinar cell metaplasia in autoimmune gastritis // Arch. Pathol. Lab. Med. — 2003. — Jul. № 127 (7). — Р. 854-857. 33. Kapadia CR. Gastric atrophy, metaplasia, and dysplasia: a clinical perspective // J. Clin. Gastroenterol. — 2003. — May-Jun. № 36 (5 Suppl). — Р. 29-36; discussion Р. 61-62. 34. Krasinskas A.M., Abraham S.C., Metz D.C., Furth E.E. Oxyntic mucosa pseudopolyps: a presentation of atrophic autoimmune gastritis // Am. J. Surg. Pathol. — 2003. — Feb. № 27 (2). — Р. 236-241. 35. Petersson F, Borch K., Franzen L.E. Prevalence of subtypes of intestinal metaplasia in the general population and in patients with autoimmune chronic atrophic gastritis // Scand. J. Gastroenterol. — 2002. — Mar. № 37 (3). — Р. 262-266. 36. Day D.W. Biopsy pathology of the esophagus, stomach and duodenum. — London., 1986. 37. Flejou J-F, Bahame P., Smith A.C. et al. Pernicious anemia and Campylobacter-like organisms: is the gastric antrum resistant to colonization? // Gut. — 1989. — V. 30. — Р. 60-64. 38. De Block C.E., De Leeuw I.H., Bogers J.J., Pelckmans P.A., Ieven M.M., Van Marck E.A., Van Acker K.L., Van Gaal L.F. Autoimmune gastropathy in type 1 diabetic patients with parietal cell antibodies: histological and clinical findings // Diabetes Care. — 2003. — Jan. № 26 (1). — P. 82-88. 39. Meunier S., Villard F, Bouvier R., Lachaux A., Bertrand Y Collagen gastritis, an unusual cause of anemia in children. Report of 2 cases // Arch. Pediatr. — 2001. — Jan. № 8 (1). — Р. 47-50. 40. Новикова В.П. Этиологические и морфофункциональные особенности хронического гастрита у детей с сопутствующими заболеваниями щитовидной железы: Автореф. … канд. мед. наук. — СПб., 2003. — 24 с. 41. Aoyama H., Sakugawa H., Nakasone H., Nakayoshi T., Kinjo A., Tamayose M., Higa H., Uema E., Chinen T., Tomiyama R., Uchima N., Kugai Y, Kinjo F, Saito A., Kinjo M. A rare association of primary biliary cirrhosis and pernicious anemia // J. Gastroenterol. — 2002. — № 37 (7). — Р. 560-563. 42. Faller G., Ruff S., Reiche N. et al. Mucosal production of antigastric autoantibodies in Helicobacter pylori gastritis // Helicobacter. — 2000. — Sep. № 5 (3). — Р. 129-134. 43. Moran A.P., Prendergast M.M. Molecular mimicry in Campylobacter jejuni and Helicobacter pylori lipopolysaccharides: contribution of gastrointestinal infections to autoimmunity // J. Autoimmun. — 2001. — May. № 16 (3). — Р. 241-256. 44. Claeys D., Faller G., Appelmelk B.J., Negrini R., Kirchner T. The gastric H+,K+-ATPase is a major autoantigen in chronic Helicobacter pylori gastritis with body mucosa atrophy // Gastroenterology. — 1998. — Aug. № 115 (2). — P. 340-347. 45. Faller G., Steininger H., Appelmelk B., Kirchner T. Evidence of novel pathogenic pathways for the formation of antigastric autoantibodies in Helicobacter pylori gastritis // J. Clin. Pathol. — 1998. — Mar. № 51 (3). Р. 244-245. 46. Kirchner T., Faller G. Helicobacter pylori infections and autoimmunity: the interplay in the pathogenesis of gastritis // Verh. Dtsch. Ges. Pathol. — 1999. — № 83. — Р. 56-61. 47. Kolho KL., Jusufovic J., Miettinen A. et al. Parietal cell antibodies and Helicobacter pylori in children // J. Pediatr. Gastroenterol. Nutr. — 2000. — Mar. № 30 (3). — Р. 265-268. 48. Новикова В.П., Юрьев В.В., Ткаченко Е.И., Струков Е.Л., Любимов Ю.А., Антонов П.В. Хронический гастрит у детей с сопутствующими заболеваниями щитовидной железы // Экспериментальная и клиническая гастроэнтерология. — 2003. — № 4. — С. 40-43. 49. Ткаченко Е.И., Новикова В.П., Антонов П.В., Любимов Ю.А. Антитела к Н+-К+-АТФазе париетальных клеток желудка у детей с НР-ассоциированным хроническим гастритом // Экспериментальная и клиническая гастроэнтерология. — 2003. — № 3. — С. 5-6. 50. D'Elios M.M., Bergman M.P., Azzurri A., Amedei A., Benagiano M., De Pont J.J., Cianchi F, Vandenbroucke-Grauls C.M., Romagnani S., Appelmelk B.J., Del Prete G. H(+), K(+)-atpase (proton pump) is the target autoantigen of Th1-type cytotoxic T cells in autoimmune gastritis // Gastroenterology. — 2001. — Feb. № 120 (2). — Р. 377-386. 51. Eight S., Oberhuber G., Stolte M. Autoimmune gastritis in its various stages // Verh. Dtsch. Ges. Pathol. — 1996. — V. 80. — P. 196-198. 52. Rappel S., Muller H., Stolte M. Active pre-atrophic autoimmune gastritis. A practice-oriented concept for diagnosis and treatment // Pathologe. — 2001. — Jan. № 22 (1). — Р. 19-24. 53. Stolte M., Meier E., Meining A. Cure of autoimmune gastritis by Helicobacter pylori eradication in a 21-year-old male // Z. Gastroenterol. — 1998. — V. 36. — № 8. — P. 641-643. 54. Larkin C.J., Watson P., Sloan J.M. et al. Gastric corpus atrophy following eradication of Helicobacter pylori // Eur. J. Gastroenterol. Hepatol. — 2001. — V. 13. — P. 377-382. 55. Muller H., Rappel S., Wundisch T, Bayerdorffer E., Stolte M. Healing of active, non-atrophic autoimmune gastritis by H. pylori eradication // Digestion. — 2001. — № 64 (1). — Р. 30-39. 56. Малашенкова И.К., Дидковский Н.А.,Сарсания Ж.Ш. Жарова М.А., Литвиненко Е.Н., Щепеткова И.Н., Чистова Л.И., Пичужкина О.В., Гусева ТС, Паршина О.В. Клинические формы хронической Эпштейн — Барр вирусной инфекции: вопросы диагностики и лечения // Лечащий врач. — 2003. — № 9. — С. 32-38. 57. Kelly M.A., Rayner M.L., Mijovic C.H., Barnett A.H. Long-term expression of an HLA-DQ molecule in the EBV-transformed bare lymphocyte cell line, BLS-1, using a plasmid vector // Scand. J. Immunol. — 2002. — Jun. № 55 (6). — Р. 599-605. |
