Ответы на вопросы по фармакологии. Фармакология. Фармакология Литературный обзор
 Скачать 0.7 Mb. Скачать 0.7 Mb.
|
Таблица 3 Изменение показателей заболеваемости основными ревматическими болезнями в Российской Федерации за 5-летний период
Одной из очевидных причин роста числа больных с дегенеративно-метаболическими поражениями суставов и позвоночника является глобальное постарение населения, затрагивающее практически все развитые страны мира, ибо и ОА, и ОП являются патологией преимущественно старших возрастных групп населения. Согласно международным критериям, население считается старым, если в нем доля людей 65 лет и старше превышает 7%. В России каждый пятый житель достиг пенсионного возраста, а контингент лиц 65 лет и старше составил 13,7% от всех жителей страны. Таким образом, группа риска развития ОА и ОП, обусловленного возрастным фактором, весьма велика. Однако, несмотря на то что количество зарегистрированных в стране больных ОА уже превысило 2 657 тыс. человек и каждый год впервые ставится более 600 тыс. «новых» диагнозов, заболеваемость ОА, основанная на учете по обращаемости к врачу, не может отражать истинную распространенность данной патологии. В реальности больных с различными формами ОА в популяции гораздо больше, чем обращающихся за медицинской помощью в государственные ЛПУ. Об этом свидетельствуют, например, данные проведенного более 25 лет назад поголовного эпидемиологического обследования жителей бывшего СССР старше 15 лет, среди которых распространенность ОА составила 6,5%, что почти в 3 раза выше показателя регистрируемой в настоящее время (среди значительно постаревшего за этот период населения!) распространенности данной патологии. Если ОА — «старая» и хорошо известная болезнь, тяжесть и значение которой, к сожалению, часто недооцениваются, то ОП относится к относительно «новым» для отечественной медицины проблемам. Для постановки диагноза ОП необходимо количественное измерение минеральной плотности костной ткани с помощью денситометра. Во многом благодаря активной деятельности Центра остеопороза Минздравсоцразвития РФ, функционирующего на базе Института ревматологии РАМН, эта проблема вышла за рамки научного анализа. На практике это отразилось не только в том, что диагноз ОП стал ставиться и с 1999 г. регистрироваться отдельной строкой в отчетных формах по заболеваемости населения России, но и в том, что интенсивность увеличения показателя заболеваемости, в т.ч. первичной, за последние годы оказалась максимальной по сравнению со всеми другими РЗ, что видно из вышеприведенных статистических данных. Однако абсолютное количество зарегистрированных к 2005 г. больных ОП (70,1 тыс. человек или 0,062 на 100 взрослых жителей) далеко не отражает действительную распространенность данной патологии в российской популяции. Свидетельство тому — данные Л.И. Беневоленской и Е.Е. Михайлова о частоте подтвержденного денситометрически ОП среди жителей г. Москвы старше 50 лет, равной 26,9% — у мужчин и 33,8% — у женщин /6/. Поэтому ясно, что средний показатель заболеваемости ОП среди взрослого населения должен быть существенно выше, чем регистрируемый в настоящее время, чтобы отразить истинный масштаб проблемы. Далее, останавливаясь кратко на известных клинико-патогенетических особенностях РЗ, определяющих их социальную значимость, укажем лишь на основные свойства: - поражаются все возрастные группы населения; - отличаются широким нозологическим разнообразием и патогенетической сложностью, включающей процессы аутоиммунного воспаления и связываемого с ним раннего атеросклероза, нарушения микроциркуляции и метаболизма, дегенеративные поражения костей и суставов и др.; - носят преимущественно системный характер с вовлечением в патологический процесс, помимо суставов, позвоночника и околосуставных тканей, жизненно важных органов с развитием их недостаточности; - имеют, как правило, хроническое прогрессирующее течение; - сопровождаются постоянными болями, нарастающим ограничением двигательной функции и свободы передвижения больного человека; - требуют проведения длительного (вплоть до пожизненного) сложного лечения с систематическим мониторированием эффективности и безопасности терапии. Широко распространенные в популяции хронические, прогрессирующие, склонные к частым обострениям РЗ являются одной из основных причин временных и стойких потерь трудоспособности. Многочисленные РЗ, формирующие, как указывалось выше, практически весь класс БКМС, постоянно находятся в числе ведущих причин временной нетрудоспособности трудящегося населения России. Как видно из данных за 2004 г., приведенных в таблице 4, БКМС находятся на 2 месте — в случаях и на 3 месте — в днях нетрудоспособности на 100 работающих среди всех других регистрируемых классов болезней. Причем такая позиция XIII класса болезней по МКБ-10 остается стабильной на протяжении нескольких последних десятилетий, вызывая колоссальные трудопотери в российском обществе. Таблица 4 Временная нетрудоспособность в РФ (на 100 работающих)
Не менее значима стойкая потеря способности трудиться, столь часто и рано возникающая у больных РЗ и определяемая показателями инвалидизации населения. По показателю первичного выхода на инвалидность жителей РФ, рассчитываемого на 10 тыс. населения страны 16 лет и старше, класс БКМС занимает 3 место среди других причин инвалидности. Впереди него находятся лишь болезни системы кровообращения и злокачественные новообразования. Ежегодно более 80 тыс. взрослых жителей России становятся инвалидами в связи с РЗ. При этом половина из них относится к наиболее активному и дееспособному возрасту: женщины — до 44 лет и мужчины — до 49 лет, а у 2/3 впервые освидетельствованных органами медико-социальной экспертизы (МСЭ) сразу определяется II или даже I группа инвалидности, что свидетельствует о тяжести, быстром прогрессировании и значительных нарушениях жизненных функций, свойственных многим больным РЗ. Инвалидность при РЗ, как и сами ревматические болезни, носит характер многолетней, «хронической» (часто длящейся до конца жизни) и склонной к утяжелению. Ревматологический больной, став инвалидом, имеет очень мало шансов восстановить свою трудоспособность и возвратиться к работе. Поэтому число инвалидов с РЗ, проходящих ежегодное переосвидетельствование в МСЭ, в 2,5–3 раза превышает количество больных, впервые признаваемых инвалидами. «Бессрочные» же инвалиды (со «стажем» инвалидности более 5 лет) не включаются в статистические сводки МСЭ и как бы исчезают. Таким образом среди населения России происходит процесс накопления инвалидов с РЗ, приводящими к нарастающей двигательной недостаточности и часто сопровождающимися серьезными поражениями внутренних органов /7/. Естественно, что РЗ не могут не влиять на качество жизни (КЖ) больного человека, связанное с состоянием его здоровья и показывающее, каким образом и в какой степени (по его субъективной оценке) физическое, психологическое, эмоциональное и социальное благополучие изменяется под воздействием болезни или ее лечения. Определение КЖ стало в последние годы одним из важнейших объективных способов оценки статуса конкретного больного, основанных на измерении субъективно определяемого благополучия. Для хронических, длительно текущих болезней, каковыми являются большинство РЗ, именно улучшение КЖ, изучаемого в процессе наблюдения и лечения пациента, является важнейшим критерием благоприятного течения заболевания и/или эффективности проводимой терапии /8/. Снижение КЖ у ревматологических больных регистрируется с помощью как общих опросников (например EuroQOL, SF-36 и др.), так и специфических, созданных именно для больных с РЗ (например AIMS, HAQ и др.). Понятно, что больные РА, ОА и другими РЗ, испытывающие постоянную боль, тугоподвижность суставов и позвоночника, нарастающие двигательные ограничения, рано теряющие трудоспособность и нормальные внутрисемейные и социальные связи, несущие значительные экономические потери и т.д., весьма низко оценивают качество своей жизни по всем его составляющим. Следующей характеристикой социальной значимости РЗ, является их отрицательное влияние на продолжительность жизни больного человека, определяемую показателями летальности (т.е.отношением числа умерших от данного заболевания к числу больных с данной патологией). До сих пор бытующее представление о РЗ как о не представляющих угрозы для жизни, безусловно, является ошибочным. Во-первых, такие болезни из класса ревматических, как СКВ, ССД, Дм/ПМ, системные васкулиты и др., сохраняют весьма серьезный прогноз в отношении жизни пациентов, несмотря на достигнутые успехи в их ранней диагностике и интенсивном лечении. Например, 5-летняя выживаемость больных СКВ к концу ХХ в. в развитых странах составляла 82–90%, 10-летняя — 71–80%, 20-летняя — 63–70%, т.е., весьма значительный процент молодых людей, какими, как правило, являются больные СКВ, погибают либо от не поддающейся терапии общей активности процесса, либо от тяжелой почечной или церебральной патологии, либо от присоединившейся инфекции /9/. Многие исследования ревматологов, выполненные в течение последнего десятилетия, вскрыли еще одну особенность РЗ — близость многих патогенетических механизмов развития ревматического воспаления, в частности через влияние провоспалительных цитокинов на сосудистую стенку, к процессам атеросклероза и атеротромбоза. Поэтому воспалительные РЗ обоснованно рассматриваются как факторы риска развития ранних атеросклеротических изменений стенки артерий, следствием которых нередко являются смертельные кардиоваскулярные катастрофы (инфаркт миокарда, инсульт, тромбозы других крупных сосудов) /10/. Клинические наблюдения подтверждают, что коронарный атеросклероз и атеротромбоз оказываются причиной смерти от 3,5 до 36,4% больных СКВ, а инфаркт миокарда регистрируется у них в 10 раз чаще, чем в популяции /11/. Не составляет исключения в этом плане и наиболее распространенное во всем мире воспалительное РЗ — РА. С одной стороны, смертность (отношение числа умерших от данной болезни к среднему числу населения, среди которого оно наблюдается) кажется относительно небольшой — в пределах 0,17–0,22% от общей смертности населения /12/. В то же время, продолжительность жизни больных РА — на 10–15 лет короче ожидаемой (популяционной), а 5-летняя выживаемость при тяжелых формах болезни сопоставима с выживаемостью больных ИБС с поражением 3 коронарных артерий или пациентов с III–IV стадиями болезни Ходжкина /13/. Частота «инфекционной» смерти при РА в 9 раз, «почечной» смерти — в 7 раз, «желудочно-кишечной» (обусловленной, в основном, побочными эффектами НПВС, необходимых больным) — в 2 раза выше популяционной. Среди всех причин летальности больных РА более 40% составляет смерть от сердечно-сосудистой патологии, в т.ч. связанной с развитием раннего и тяжелого атеросклероза /14/. Еще один пример: летальность больных россиян через 6 мес после остеопоротического перелома шейки бедра достигает 21,5%, через 12 мес — 33,6%, а через год — 45,1% (!), что значительно превышает показатели популяционной смертности населения /15/. Таким образом, РЗ неверно относить к разряду «доброкачественных» и «жизненеугрожаемых». И наконец, стоимостная характеристика РЗ: во всем мире они относятся к разряду наиболее дорогостоящих. При этом РЗ отличаются высокими значениями всех 3 составляющих общих затрат на заболевание. Прямые затраты (медицинские и немедицинские) складываются из расходов на диагностику, подчас требующую применения сложных лабораторных и инструментальных методов исследования, лечение (длительное, комплексное, с использованием весьма дорогих методов, например плазмафереза, пульс-терапии и др., и препаратов, например биологических агентов), операции, реабилитацию больных, а также на транспортные расходы, плату ухаживающему персоналу и т.д. Еще более значимыми оказываются косвенные расходы, связанные с РЗ, которые измеряются экономическим ущербом общества от снижения/потери трудоспособности ревматологическим больным или от его преждевременной смерти. В стоимостном выражении косвенные расходы обычно в несколько раз превышают прямые затраты на РЗ. Последняя составляющая расходов на болезнь обозначается как нематериальные, «неосязаемые» затраты, связываемые с потерями, которые несет больной РЗ человек, как личность, член семьи и общества. Они во многом определяются снижением КЖ больного, инструментами оценки которого являются, как указывалось выше, общие (генерические) и специальные опросники. Стоимостного выражения нематериальные затраты, естественно, не имеют /16/. Для иллюстрации приведем некоторые данные о величине затрат на РЗ в некоторых развитых странах мира. Так, например, в Великобритании прямые расходы только на больных артритами достигают 1,3 млрд фунтов стерлингов в год /17/. В Канаде общие затраты на больных РЗ в 1994 г. превысили 61,4 млрд канадских долларов, что было сопоставимо с расходами на онкологических больных. При этом только прямые затраты составили 3,4% ВВП Канады, а отношение прямые/непрямые расходы — 1:2,4 /18/. Стоимость болезней суставов («артритов») в США в 1995 г. составила 82,4 млрд долларов или 38% затрат на весь класс БКМС /19/. Подсчитано, что средняя стоимость одного больного РА в развитых странах Европы равнялась в 2002 г. 15 тыс. евро/год (из них: прямые затраты — 5 тыс., непрямые — 10 тыс. евро) /20/. В 2005 г. впервые была осуществлена попытка оценить среднюю стоимость больного-москвича, страдающего РА, прошедшего амбулаторный и стационарный этапы лечения. Оказалось, что его «цена» составила 1960 долларов в год /21/. Значит, можно допустить, что затраты на всех зарегистрированных в РФ больных РА (около 290 тыс. чел.) будут превышать 550 млн долларов/год (!). Таким образом, высокая социальная значимость РЗ в России обусловлена: - широкой и постоянно увеличивающейся распространенностью среди всех возрастных категорий населения; - хроническим прогрессирующим течением большинства РЗ, имеющих системный характер поражения; - существенным негативным влиянием на трудовой потенциал страны; - резким ухудшением КЖ больного человека; - заметным сокращением продолжительности жизни ревматологических больных (как вследствие тяжелого течения самих РЗ, так и из-за вызываемых ими осложнений, в т.ч — кардиоваскулярных); - высокой «ценой» ревматической болезни для индивидуума, его семьи и общества в целом. Обеспокоенность неуклонно растущим бременем РЗ, испытываемым всеми цивилизованными государствами, отразилась в документах всемирной «Декады костей и суставов 2000–2010», провозглашенной под эгидой ВОЗ в первый год нового тысячелетия и поддержанной десятками правительств и сотнями общественных организаций во всем мире /22/. Задачами Декады являются: - повышение осведомленности заинтересованных органов (местных и федеральных) и населения о возрастающих медико-социальных потерях общества, вызванных БКМС; - привлечение самих больных к участию в собственном оздоровлении; - разработка экономически эффективных схем и методов предупреждения развития БКМС (первичная профилактика), их обострений и прогрессирования (вторичная профилактика). Среди заболеваний, оказывающих выраженное негативное влияние на медико-социальный статус общества, названы такие РЗ, как РА и ЮА, ОА, ОП, междисциплинарная проблема боли в нижней части спины; а также тяжелые травмы конечностей. Вышеуказанные РЗ, наряду с другими многочисленными заболеваниями этого класса болезней, по праву находятся в центре внимания отечественных ревматологов. Представленный выше 5-летний анализ заболеваемости жителей России РЗ и доказательства их социально-экономического бремени демонстрируют возрастающую значимость данной проблемы и для государства в целом, и для отдельных его членов, в частности. Для ее решения необходима дальнейшая консолидация усилий научной и практической ревматологии при соответствующей организационной и финансовой государственной поддержке. Литература 1. Насонова В.А., Кузьмина Н.Н. Ревматизм/ В кн.: Ревматические болезни Под ред. В.А. Насоновой и Н.Н. Бунчука.- М.: Медицина, 1997.- С. 144–159. 2. Международная статистическая классификация болезней и проблем, связанных со здоровьем. Десятый пересмотр ВОЗ.- Женева, 1995.- т. 1.- С. 643. 3. Беневоленская Л.И., Бржезовский М.М. Эпидемиология ревматических болезней.- М.: Медицина, 1988.- 238 с. 4. Эрдес Ш.Ф., Галушко Е.А., Бахтина Л.А. и др. Распространенность артралгий и припухания суставов у жителей разных регионов РФ// Научно-практическая ревматология.- 2004.- 4.- С. 42–47. 5. Заболеваемость населения России (в 2001, 2002, 2003, 2004, 2005 годах).- Статистические материалы Министерства здравоохранения и социального развития Российской Федерации (за 2002, 2003, 2004, 2005, 2006 гг.) 6. Руководство по остеопорозу/ Под ред. Л.И. Беневоленской.- М.: Бином, Лаборатория знаний.- 2003.- С. 10–20. 7. Фоломеева О.М., Амирджанова В.Н., Якушева Е.О. и др. Инвалидность населения России, обусловленная ревматическими заболеваниями// Рос. ревматология.- 1999.- 3.- С. 70–79. 8. Амирджанова В.Н., Койлубаева Г.М. Методология оценки качества жизни в практике ревматолога// Научно-практическая ревматология.- 2003.- 2.- С. 72–81. 9. Nived O., Sturfelt G. Symposium: mortality in rheumatic diseases. Mortality in SLE// Rheumatol. in Europe.- 1999.- 25.- P. 17–19. 10. Насонов Е.Л., Попкова Т.В. Кардиоваскулярные проблемы ревматологии// Научно-практическая ревматология.- 2004.- 4.- С. 4–9. 11. Manzi S., Meilahn E.N., Rairie J.E. et al. Age-specific incidens rates of myocardial infarction and angina in women with SLE : comparison with Framingham Study// Am. J. Epidemiol.- 1997.- 145.- P. 408–415. 12. Coste J., Jougla E. Mortality from rheumatoid arthritis in France// Int. J. Epidem.- 1994.- 23.- P. 545–552. 13. Pincus T., Callahan F. Mortality in rheumatoid arthritis// Bull. Rheumat. Dis.- 1992.- № 4.- 41.- P. 1–7. 14. Goodson N., Marks J., Lunt, Symmons D. Cardiovascular admission and mortality in an inception cohort of patients with RA with onset in the 1980s and 1990s// Ann. Rheumat. Dis.- 2005.- 64.- 11.- P. 1595–1601. 15. Меньшикова Л.В., Храмцова Н.Л., Ершова О.Б. и др. Исходы переломов проксимальных отделов бедра у лиц пожилого возраста и их медико-социальные последствия// Научно-практическая ревматология.- 2002.- 4.- С. 11–13. 16. Эрдес Ш.Ф., Фоломеева О.М., Амирджанова В.Н. Проблема ревматических заболеваний в России с позиции общества и пациента// Вестн РАМН.- 2003.- 7: С. 11–14. 17. Gabriel S.E., Crowson C.S., Campion M.E., O’Fallon W.M. Direct medical costs are unique to people with arthritis// J. Rheumatol.- 1997.- 24.- P. 719–725. 18. Вadley M.E. The economic burden musculoskeletal disorders in Canada is similar to that for cancer, and may be higher// J. Rheumatol.- 1995.- 22.- P. 204–206. 19. Praemer A., Furner S., Rice D. Musculoskeletal conditions in United States// Amer. Academ. Orthoped. Surgeons.- 1999.- P. 139–162. 20.Mittendorf T., Mau W., Zeider H. Health economics research in the area of chronic polyarthritis// Z. Rheumatol.- 2002.- 61.- P. 21–29. 21. Койлубаева Г.М. Качество жизни больных ревматоидным артритом и фармакоэкономические аспекты заболевания: Дисс....канд. мед. наук. М., 2005. 22. Насонова В.А., Эрдес Ш.Ф. О всемирной Декаде костно-суставных заболеваний// Научно-практическая ревматология.- 2000.- 4.- С. 14–16. обзор основных доклинических исследований, подтверждающих эффективность препарата (если применимо); В исследованиях in vitro с тканями человеческого организма была подтверждена высокая аффинность мелоксикама к ЦОГ-2, тогда как ЦОГ-1 in vitro ингибируется только высокими дозами мелоксикама. Мелоксикам отличается как от новых ЦОГ-2-специфических лекарственных молекул (коксибов – целекоксиб, этерококсиб), так и от традиционных НПВС, ингибирующих обе формы фермента ЦОГ (диклофенак, индометацин, ибупрофен, напроксен и пироксикам). Таким образом, мелоксикам занимает промежуточное положение между традиционными НПВС и коксибами. Биодоступность мелоксикама составляет 89% после приема per os. Около 99,4% мелоксикама связывается с белками плазмы. Препарат отличается линейной фармакокинетикой, и период его полужизни составляет 20–24 часа. Фармакокинетика мелоксикама существенно не меняется у пожилых пациентов и у пациентов с мягкой почечной/печеночной недостаточностью. Фармакокинетические особенности мелоксикама позволяют использовать его с частотой один (15 мг) или два раза в день (по 7,5 мг), что является важным фактором улучшения приверженности терапии, особенно при применении его для лечения хронических болевых синдромов. Достоинством препарата Мовалис (мелоксикам) является наличие различных лекарственных форм, что позволяет клиницисту более гибко выстраивать программу обезболивания. Инъекционная форма мелоксикама (Мовалис) отличается быстрой абсорбцией (время достижения максимальной концентрации составляет 60–96 минут после инъекции) и абсолютной биодоступностью (100%). Средний период полувыведения препарата составляет от 13 до 25 часов. Это данные фармакокинетические характеристики делает инъекционную форму мелоксикама особенно привлекательной для лечения острой ноцицептивной боли. Недавно линейка препарата пополнилась новой быстрой пероральной формой – суспензией Мовалис, которая является альтернативой другим таблетированным формам НПВС с быстрым эффектом. Суспензия демонстрирует полную биоэквивалентность таблетированной форме Мовалиса для приема внутрь, что позволяет применять ее для курсового лечения у пациентов при остеоартрозе, ревматоидном артрите и анкилозирующем спондилите [6]. Проведенные исследования демонстрируют эквивалентную клиническую эффективность суспензии и таблетированной формы Мовалис на модели остеоартрита. Новая форма также дает возможность более гибко дозировать препарат в зависимости от веса и диагноза пациента. Мовалис в форме суспензии удобен для приема пациентами, которые не могут использовать парентеральные формы или у которых нарушена функция глотания. Есть также предположение, что именно благодаря более быстрой абсорбции суспензия может приводить к более быстрому развитию эффекта по сравнению с твердыми формами [7]. После однократного приема время достижения максимальной концентрации суспензии в плазме составляет 2 часа. Согласно инструкции, суспензию можно применять уже с 2 лет, что говорит о благоприятном профиле безопасности новой формы. Эффективность мелоксикама в терапии ноцицептивной боли Эффективность мелоксикама в редукции боли, ассоциированной с ревматоидными и мышечно-скелетными болезнями, оценена в многочисленных сравнительных исследованиях, подразумевавших короткие (2 недели) и длинные (до 12 месяцев) курсы приема препарата 7,5–15 мг/сут в сравнении с плацебо и другими НПВС. В целом эффективность мелоксикама значительно превосходила плацебо и была сравнима с другими НПВС. В то же время по спектру переносимости (частота побочных эффектов, особенно гастроинтестинальных) мелоксикам обладал более благоприятным профилем безопасности по сравнению с другими НПВС. Инъекционные формы мелоксикама обеспечивают более быстрый обезболивающий эффект у пациентов с суставной и мышечно-скелетной болью. Анальгезия в среднем наступает через 40–45 минут после введения мелоксикама [8]. При острой боли лечение обычно начинают с внутримышечных инъекций (1–3 дня), а затем продолжают приемом таблетированной формой Мовалиса 15 мг. Длительность терапии составляет от 7 до 20 дней. Приблизительно у 80% больных острая боль полностью исчезает или остаются незначительные боли, не лимитирующие обычную физическую активность. При острой радикулярной боли мелоксикам в дозе 15 мг/сут демонстрирует достоверно более высокий эффект по сравнению с плацебо уже после третьего дня лечения [9]. Однако к 7-му и 14-му дню лечения эффективность мелоксикама в дозе 15 мг/сут уже не отличается от 7 мг/сут и диклофенака в дозе 150 мг/сут. В среднем радикулярная боль уменьшается на 50% к 7-му дню лечения и на 75% к 14-му дню лечения. Кроме редукции боли мелоксикам может использоваться в качестве превентивной терапии постоперационной боли. Назначение мелоксикама 7,5 мг до оперативного вмешательства приводит к редукции боли на 20–40% в постоперационный период (2–24 часа после операции) по сравнению с плацебо [10]. Практически не обнаружено фармакокинетического взаимодействия между мелоксикамом и другими лекарственными препаратами. Таким образом, фармакокинетический профиль позволяет комбинировать мелоксикам с большинством препаратов, используемых для лечения хронической боли. Безопасность применения мелоксикама Гастроинтестинальная безопасность Основным достоинством селективных ингибиторов ЦОГ-2 является низкий уровень гастроинтестинальных побочных эффектов, характерных для НПВС, при сохранении их терапевтической эффективности. Гастроинтестинальный профиль безопасности мелоксикама, преимущественно ингибирующего ЦОГ-2, оценен в целой серии исследований. В частности, два больших проспективных контролируемых исследования – MELISSA (Meloxicam Large-Scale International Study Safety Assessment) и SELECT (Safety and Efficacy Large scale Evaluation of COХ inhibiting Therapies) – доказали, что мелоксикам обладает меньшей токсичностью в отношении желудочно-кишечного тракта по сравнению с диклофенаком или пироксикамом [11, 12]. Так, в исследовании MELISSA 4635 пациентов получали мелоксикам 7,5 мг/сут и 4688 пациентов получали диклофенак 100 мг/сут. Сравнительный период (период лечения) составил 28 дней. Пациенты, получавшие мелоксикам, имели достоверно меньше гастроинтестинальных побочных эффектов (13% по сравнению с 19% в группе диклофенака, p < 0,001). В частности, у пациентов, получавших мелоксикам, реже наблюдались диспепсия, тошнота и рвота, абдоминалгии и диарея. Одним из важных выводов этих двух широкомасштабных исследований было доказательство безопасности применения мелоксикама у лиц, использующих аспирин. Эти клинические находки были подтверждены в экспериментальном исследовании на здоровых добровольцах, принимавших в течение четырех недель мелоксикам 15 мг/сут, пироксикам 20 мг/сут или плацебо [13]. Макроскопическое повреждение слизистой было обнаружено только у добровольцев, получавших традиционное НПВС (пироксикам). Несколько метаанализов, включающих от 20 до 100 тысяч пролеченных больных, убедительно подтвердили, что мелоксикам обладает низкой гастротоксичностью и достоверно реже, чем традиционные НПВС, вызывает диспепсию, перфорации, эрозии и кровотечения. Гепатотоксичность Назначая НПВС, клиницист должен задумываться не только о возможности развития гастропатии, но и о гепатотоксических реакциях. Атрибутивный для НПВС риск поражения печени составляет приблизительно 5 на 100 000 пациенто-лет [14]. Селективные ингибиторы ЦОГ-2 имеют потенциал повреждения печени ниже, чем обычные НПВС. Практически не описано развития острых лекарственных гепатитов при использовании мелоксикама. Побочные эффекты со стороны почек Ренальные побочные эффекты НПВС достаточно разнообразны и включают водно-электролитные нарушения, тубулоинтестинальный нефрит, гломерулярное повреждение и другие. Больше чем у 5% пациентов, получающих НПВС, развиваются ренальные побочные эффекты. В большинстве своем эти побочные эффекты обусловлены НПВС-индуцированной редукцией синтеза простагландинов. Исследования на животных моделях показали, что обе формы фермента ЦОГ экспрессируются в почках и участвуют в регуляции водного обмена. До сих пор остается не до конца разработанным теоретическое обоснование участия селективных ингибиторов ЦОГ-2 в реализации почечных побочных эффектов. Однако клинические наблюдения свидетельствуют, что селективные ингибиторы ЦОГ-2 как минимум не отличаются по своей потенциальной ренальной токсичности от традиционных НПВС. Однако на практике до настоящего времени не существует убедительных доказательств ухудшения ренальной функции у пациентов, принимающих мелоксикам. По-видимому, фармакокинетический профиль мелоксикама, особенно его низкая аккумуляционная способность, препятствуют развитию почечных осложнений. В этой связи допускается использование препарата у пациентов с незначительными почечными нарушениями. Кардиоваскулярная безопасность Ингибиция агрегации тромбоцитов неселективных НПВС – это одна из предрасполагающих причин к желудочно-кишечному кровотечению. Селективные ингибиторы ЦОГ-2 не нарушают агрегации тромбоцитов и потому более безопасны. Исследование функции тромбоцитов у здоровых испытуемых, принимавших в течение 7 дней мелоксикам в дозе 15 мг/сут, показало, что препарат не влиял на агрегацию тромбоцитов, несмотря на снижение уровня тромбоксанов в плазме [15]. Дальнейшие исследования у пациентов с болевыми синдромами подтвердили, что мелоксикам не влияет ни на агрегацию тромбоцитов, ни на время свертываемости крови. Биосинтез тромбоксанов в большей мере зависит от активности ЦОГ-1 в тромбоцитах, напротив, ЦОГ-2 преимущественно вовлечена в продукцию эндотелиальных простациклинов. Этот факт послужил отправной точкой гипотезы, что селективные ингибиторы ЦОГ-2 обладают протромботическим потенциалом. Однако отчетливых клинических доказательств, что протромбогенный эффект жестко связан со степенью блокирования ЦОГ-2, нет. Например, метаанализ, включавший свыше 27 000 пациентов, показал, что кардиоваскулярных событий у пациентов, получавших мелоксикам, было не больше, чем у пациентов, принимавших традиционные НПВС [16]. Заключение Таким образом, клиническая эффективность, благоприятный профиль переносимости и наличие различных лекарственных форм мелоксикама позволили препарату занять лидирующее положение среди лекарственных препаратов для лечения ноцицептивной боли. 3. доказательная база, полученная в ходе клинических исследований (далее - КИ) (обзор основных КИ с общим выводом); Реклама Селективный ингибитор циклооксигеназы-2 (ЦОГ-2) мелоксикам широко используется в медицинской практике. Мелоксикам является производным оксикамовой кислоты и имеет большой период полувыведения: максимальная концентрация (Cmax) в плазме после приема 15 мг препарата достигается через 7 часов, время полувыведения составляет 20–24 часа, поэтому он назначается 1 раз в день в дозе 7,5 или 15 мг, что удобно для пациента. Мелоксикам структурно отличается от других ЦОГ-2 ингибиторов, например «коксибов», и связывается с верхней частью канала ЦОГ-2, а не с боковой частью этого фермента, как целекоксиб. Мелоксикам хорошо связывается с белками плазмы (99,5%) и легко проникает в синовиальную жидкость, где его концентрация составляет 45–57% от концентрации в плазме [10]. Эффективность мелоксикама оценена в ряде крупных рандомизированных клинических исследований (РКИ) при ОА (исследования MELISSA, n = 9323; SELECT, n = 8656; в США, n = 774), при РА (n = 894), анкилозирующем спондилоартрите (АС) (n = 473) (рис. 2, 3). 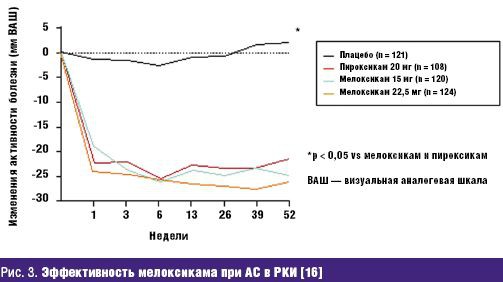 Было показано, что эффективность мелоксикама при лечении больных ОА равна эффективности неселективных НПВП (диклофенака, пироксикама) [14], а переносимость намного лучше [17, 18] (рис. 4). Препарат продемонстрировал равнозначную эффективность с неселективными НПВП и при РА, и при анкилозирующем спондилоартрите [15, 16]. 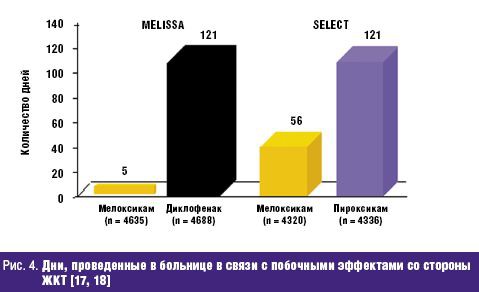 В последнее время во врачебную практику внедрена новая парентеральная форма мелоксикама для внутримышечного введения. Необходимость создания этой формы связана с тем, что, в связи со значительным временем полувыведения мелоксикама, его концентрация при приеме таблетированной формы стабилизируется в крови пациента только на 3–4 день. Поэтому для быстрого купирования выраженной или острой боли и была разработана парентеральная форма. Фармакокинетические исследования показали, что внутримышечное применение мелоксикама приводит к более быстрой абсорбции препарата, чем при его пероральном применении; максимальная плазменная концентрация достигается уже через 1,5 часа после в/м введения по сравнению с 5–7 часами после перорального применения [19]. При этом 90% Cmax достигается уже через 30–50 минут после инъекции. Такое увеличение абсорбции определяет более быстрое начало действия мелоксикама, вводимого в/м, по сравнению с пероральным применением (рис. 5). 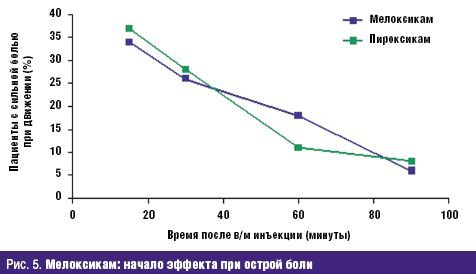 Чтобы в/м введение могло рассматриваться как альтернатива пероральному способу введения, необходима очень хорошая локальная переносимость. Однако многие НПВП плохо переносятся при в/м введении, вызывая локальное раздражение тканей и некроз, часто в сочетании с системными неблагоприятными явлениями [20]. При работе на кроликах было показано, что локальная переносимость мелоксикама лучше, чем у других НПВП. После его в/м введения не было обнаружено гистопатологических изменений, в то время как при использовании пироксикама или диклофенака развивалась обширная зона некроза. afisha.yandex.ru Реклама Подробнее Преимущество использования в/м формы мелоксикама по сравнению с таблетированной было продемонстрировано при РА [20, 21], при ОА [21], при люмбоишалгическом синдроме [22]. Российское многоцентровое исследование по изучению эффективности в/м формы мелоксикама в лечении 670 больных с патологией суставов (ОА — 384 больных и РА — 286 больных) показало, что эффект при введении мелоксикама в мышцу развивается у большинства больных уже в течение первого часа после 1-й инъекции, нарастает в течение первых трех дней и далее продолжает нарастать при переходе на пероральную форму, так что к концу курса лечения было получено достоверное уменьшение боли (в покое и при движении) и улучшение функции (рис. 6). 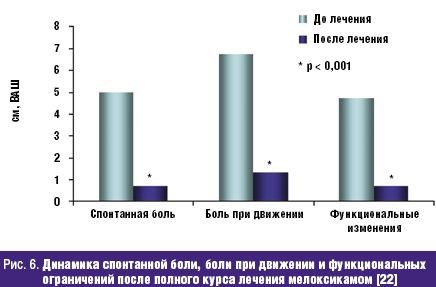 Такой ступенчатый способ назначения мелоксикама — в/м инъекции препарата в течение трех дней и последующий переход на таблетированную форму может быть особенно полезен при лечении артроза межпозвонковых суставов и при других причинах болей в спине (остеохондроз), где выраженность и острота боли может быть гораздо большей, чем при ОА периферических суставов. При сравнении эффективности и переносимости парентеральных форм мелоксикама и пироксикама при лечении острых болей в области плечевого сустава у 599 больных через 7 дней степень уменьшения боли была равной в обеих группах больных. Однако мелоксикам обладал более быстрым началом действия: в первые 3 дня терапии боль уменьшалась при инъекциях 7,5–15 мг мелоксикама у большего числа больных, чем среди получавших инъекции 20 мг пироксикама [23]. Это объясняется различиями в фармакокинетике этих двух препаратов (мелоксикам достигает стабильной концентрации в плазме через 3–4 дня, а пироксикам — через 7–10 дней). Следует учитывать, что пироксикам является одним из наиболее плохо переносимых НПВП, применение которого в пожилом возрасте у больных ОА крайне не желательно, поэтому пироксикам обычно используют при лечении молодых людей, не имеющих сопутствующей патологии. Быстрое уменьшение спонтанной боли и боли при движении происходит при использовании парентеральной формы мелоксикама в лечении обострения люмбоишалгического синдрома (радикулопатия, миофасциальные и мышечнотонические расстройства) [22], когда быстрота развития эффекта необходима не только из-за выраженности боли, но и для предупреждения развития эффекта «вторичной гипералгезии» и хронизации патологического процесса. Назначение мелоксикама в/м позволило добиться уменьшения через 1 час после 1-й инъекции спонтанной боли примерно в 2 раза, а боли при движении — более чем в 2 раза, а после 3-й инъекции — соответственно на 77% и 78%. Реклама Безопасность мелоксикама при лечении основных заболеваний суставов и позвоночника ревматологического профиля была оценена в метаанализе 1999 года [24], который включил данные 10 исследований (рис. 7). 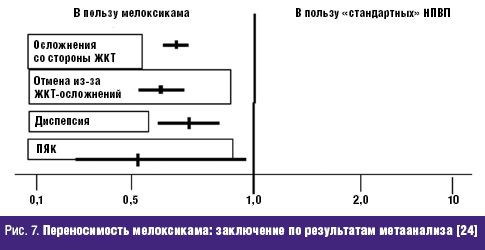 По данным метаанализа результатов 10 опубликованных исследований мелоксикам имел преимущества перед диклофенаком, пироксикамом и напроксеном: по числу осложнений со стороны ЖКТ: снижение риска на 36%; по частоте отмены из-за осложнений со стороны ЖКТ: снижение риска на 41%; по частоте перфораций, язв, кровотечения из верхних отделов ЖКТ: снижение риска на 48%; по частоте развития диспепсии: снижение риска на 27%. В рандомизированных клинических исследованиях была показана высокая безопасность мелоксикама. За последнее десятилетие накоплен большой опыт использования мелоксикама в реальной клинической практике, когда лечение проводится пациентам самого различного возраста, имеющим сопутствующие и подчас тяжелые заболевания, получающим различные медикаменты, что усложняет проведение анальгетической и противовоспалительной терапии. Реклама Представленные Zeidler H. и соавт. [25] данные о результатах лечения 13 307 больных с патологией суставов в обычной врачебной практике в Германии позволяют оценить место мелоксикама по мнению 2155 врачей. Большая часть пациентов (60%) до назначения мелоксикама получала другие НПВП: в 43,2% случаев их назначение не было эффективным, а у каждого 5-го больного — не переносимым. В этой группе больных частота нежелательных реакций, приведших к отмене препарата при приеме 7,5 мг/сутки мелоксикама, составила 0,7% и 15 мг/сутки — 0,6%; развитие осложненных язв ЖКТ отмечено у 2 из 8652 больных, получавших 7,5 мг/сутки мелоксикама, и еще у 2 из 4448 больных при суточной дозе мелоксикама 15 мг. Напомним, что применение неселективных НПВП приводит к развитию язв верхних отделов ЖКТ в 12–19% случаев, а осложненных язв примерно в 0,4% случаев [26]. При этом у многих больных (до 80%) возникновение язвенного повреждения слизистой ЖКТ происходит безболезненно [26], что препятствует своевременному назначению гастропротективной терапии. В проведенном фармакоэкономическом исследовании безопасности мелоксикама у больных, имеющих факторы риска развития НПВП-гастропатии, по сравнению с другими НПВП [27] были получены очевидные подтверждения достоверно лучшей переносимости мелоксикама (табл. 1), 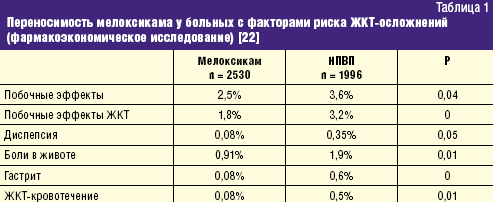 в том числе по частоте развития кровотечения из верхних отделов ЖКТ (рис. 8). 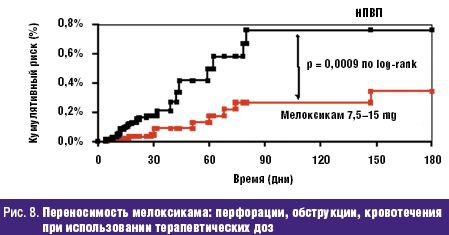 Проблемы НПВП-гастропатии довольно часто обсуждаются в литературе. Реже приводятся данные об осложнениях со стороны почек. Неселективные НПВП вызывают снижение уровня простагландинов почек, что приводит к нарушению экскреции Na, задержки жидкости, развитию артериальной гипертензии или ухудшению ее течения. При этом уменьшается эффективность антигипертензивных препаратов, что диктует необходимость тщательного мониторинга АД и коррекции дозы бета-блокаторов, ингибиторов ангиотензинпревращающего фермента (АПФ), диуретиков. По результатам патолого-анатомических исследований у больных РА, которые вынуждены годами принимать полноценные терапевтические дозы неселективных НПВП, в 60–100% отмечается интерстициальный нефрит. Возможно развитие острой почечной недостаточности (ОПН). Тщательный анализ риска развития ОПН у больных пожилого возраста проведен в США [28]. По программе оценки эффективности и безопасности лекарственных средств, назначенных между 1999 и 2004 гг. лицам старше 65 лет, были оценены побочные эффекты НПВП при условии их приема 6 и более месяцев. Больные, получавшие два НПВП одновременно, из исследования были исключены. Из 183 446 пациентов, средний возраст которых составил 78 лет, ОПН, приведшая к госпитализации, отмечена была у 870 пациентов. Наиболее частым НПВП, назначенным этой группе больных, был целекоксиб, его принимал каждый третий пациент. В табл. 2 приведены относительный риск и 95% доверительный интервал развития ОПН при приеме различных НПВП в сравнении с целекоксибом.  Достоверное увеличение риска развития ОПН на 50% и 100% получены для ибупрофена и индометацина соответственно. Из таблицы видно, что мелоксикам имеет наименьший риск развития ОПН среди проанализированных селективных и неселективных НПВП. Обе эти сводки представляют несомненный интерес для клиницистов, так как основаны не на результатах научных исследований, а на основании сообщений практикующих врачей. В последние годы обсуждается еще один аспект безопасности НПВП — возможность усугубить течение кардиоваскулярных заболеваний. Теоретически нарастание тромбогенного риска селективных ингибиторов циклооксигеназы 2-го типа может быть обусловлено их ингибицией простагландин-I2 («антитромбогенный» простагландин), относительным увеличением синтеза тромбоксана А2 («тромбогенный» простагландин) при применении у больных с РА или системной красной волчанкой, то есть при заболеваниях, при которых риск тромбозов увеличен. После того как были получены данные о некотором увеличении риска сердечно-сосудистых заболеваний на фоне применения рофекоксиба [29], был проведен ряд дополнительных исследований влияния НПВП на функции сердечно-сосудистой системы. В 2001 году были доложены результаты метаанализа результатов лечения мелоксикамом 27 000 больных [30]. По этим данным частота сердечно-сосудистых нежелательных реакций при лечении мелоксикамом не была выше, чем при использовании неселективных НПВП. Имеется сообщение о пробном исследовании применения мелоксикама в дозе 15 мг внутривенно при остром коронарном синдроме у 60 пациентов, получавших стандартное лечение Аспирином и Гепарином, в сравнении с 60 больными, получавшими такие же дозы Аспирина и Гепарина без назначения мелоксикама. Оказалось, что добавление мелоксикама к стандартной терапии при оценке исходов острого коронарного синдрома (рецидив стенокардии, инфаркт миокарда (ИМ) или смертельный исход) привело к уменьшению частоты отрицательных исходов с 38,3% до 15% во время пребывания в стационаре и с 48,3% до 26,7% через 90 дней после лечения [31]. Риск развития острого ИМ при использовании селективных и неселективных НПВП был оценен в трех популяциях в трех странах (Великобритания, Канада и США) [32]. Целью исследования было оценить риск развития ИМ у пациентов, принимающих ингибиторы ЦОГ-2, мелоксикам и другие НПВП, по сравнению с диклофенаком; проверить сопоставимость данных по трем популяциям; всего проанализировано 60 473 случая лечения НПВП и 248 768 случаев контроля. Были получены следующие результаты: В одной когорте мелоксикам был связан со сниженным риском развития ИМ, в двух — не было установлено какого-либо эффекта (хотя относительный риск в обоих исследованиях был снижен). В одной когорте напроксен был связан со сниженным риском развития ИМ, а в двух — риск был несколько повышен. В двух когортах риск развития ИМ при приеме рофекоксиба был несколько повышен по сравнению с диклофенаком. В одной когорте было обнаружено небольшое увеличение риска для ибупрофена по сравнению с диклофенаком. Не было обнаружено различий между целекоксибом и диклофенаком. В GPRD (Великобритания) не было обнаружено значительных различий, хотя относительный риск для мелоксикама был ниже 1,0, а для напроксена был несколько повышен. В RAMQ (Канада) было обнаружено небольшое статистически значимое увеличение риска при приеме рофекоксиба и снижение риска при приеме мелоксикама и напроксена. В VA (США) было обнаружено небольшое, но статистически значимое увеличение риска для рофекоксиба, напроксена и ибупрофена и снижение риска для мелоксикама. Риск развития ИМ у пациентов с текущим приемом рецептурных НПВП (мелоксикам, целекоксиб и рофекоксиб) по сравнению с текущим приемом диклофенака представлен в табл. 3. Таким образом, по результатам РКИ и пострегистрационных исследований мелоксикама: Выявлена его отчетливая анальгетическая и противовоспалительная активность при хронических заболеваниях суставов и позвоночника, а также при острых болевых синдромах (люмбоишалгии). Подтверждена по результатам реальной клинической практики при лечении многотысячных когорт больных высокая желудочно-кишечная переносимость, ранее выявленная в двойных слепых контролируемых исследованиях. Широкомасштабные фармакоэпидемиологические исследования подтверждают низкий риск тяжелых побочных эффектов со стороны ЖКТ, ранее установленных в контролируемых клинических испытаниях и в процессе метаанализа. Не отмечено увеличения частоты кардиоваскулярной токсичности. Эти данные подтверждает и исследование IMPROVE [33], в котором оценивался «терапевтический успех» мелоксикама при ОА. Для оценки «терапевтического успеха» были приняты следующие параметры (конечная точка): завершение исследования без перехода на прием другого НПВП или завершение исследования и отсутствие необходимости принимать НПВП. Мелоксикам был назначен 662 больным и другие НПВП — 647 больным. Конечной точки достигли 67% из группы больных, принимавших мелоксикам, и 45% больных из группы сравнения (p < 0,0005) (рис. 9). 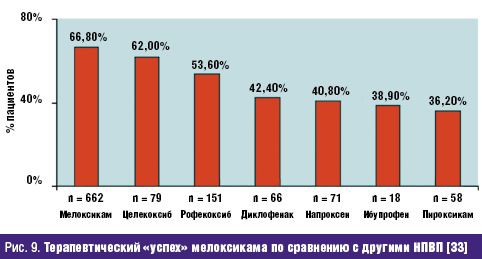 Отмена лечения из-за побочных реакций была соответственно у 12% и 20% больных, из-за отсутствия эффекта — у 16% и 28% больных. Приверженность больных приему мелоксикама свидетельствует о высокой эффективности этого препарата. Позиция мелоксикама (мовалис) среди других НПВП представляется наиболее удачной. Конечно, этот препарат не может считаться совершенно безопасным, как и любой другой представитель этой лекарственной группы. Однако он обладает хорошей переносимостью и относительно низким риском развития серьезных осложнений, в виде нарушения функции как ЖКТ, так и ССС; он достаточно эффективен и удобен в применении. В целом мелоксикам сегодня - препарат первого ряда для многих пациентов, страдающих острыми и хроническими заболеваниями суставов и позвоночника. 4. список использованной литературы. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
