Фазовый переход жидкость твердое тело
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
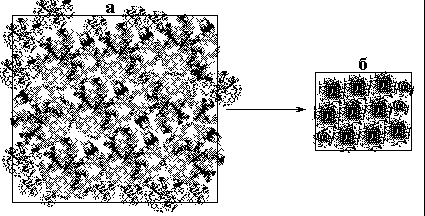
Диссипация этой энергии и проявляется в качестве эффекта посткристаллизации. Начало процесса посткристаллизации характеризуется достижением критического градиента температуры между внутренней частью фрактальных кластеров, составляющих твердое тело, и температурой окружающей среды, охлаждающей систему. При этом внутренняя часть элементов, составляющих фрактальную структуру твердого сплава на каждом масштабном уровне претерпевает акт рекристаллизационного упорядочения-уплотнения структуры с образованием трехмерно-упорядоченной объемной части для каждого составляющего звена и масштаба конденсированной иерархической системы. Одновременно происходит «вытеснение» зоны с фрактальной пористой разреженной структурой из внутренней части структурных элементов на их периферийную область (рис. 3.7). Это объясняет обнаруженный многими исследователями пористый фрактальный характер внутренних межзеренных границ в сплавах при комнатной температуре. В дальнейшем мы узнаем, какими функциональными особенностями обладают граничные зоны структурных элементов во взаимосвязи с их структурой. Неотъемлемым свойством фрактальных структур является наличие флуктуаций плотности - например, в направлении прямой, проведенной через какую-либо область объекта с фрактальной структурой плотность вещества кластера будет сильно различаться. В связи с этим процесс посткристаллизации характеризуется значительными флуктуациями многих параметров во времени. В процессе посткристаллизационной трансформации фрактальной структуры сплава в кристаллическую происходит пространственная перестройка и увеличение количества связей между частицами (уплотнение твердой фазы), а также упорядочение связей по длинам и энергиям. Несомненно, что такие процессы, происходящие с фрактальной структурой, должны быть связаны с флуктуациями выделяющейся в процессе образования дополнительных связей энергии. Поэтому данный тепловой процесс может рассматриваться как фрактальный шум. Фрактальным шумом называется последовательность случайных значений какой-либо величины, лежащей в определенных пределах.
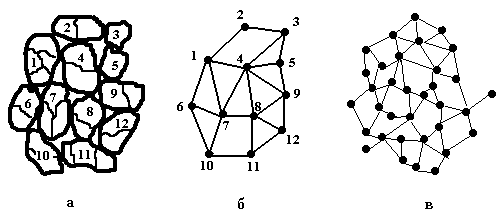
Поликристалл можно рассматривать как перколяционный кластер. Совокупность границ зерен можно представить как арочную конструкцию, состоящую из межкристаллитных химических связей (мостиков) и пустот. Соединив центры тяжести отдельных зерен между собой, поликристалл можно представить как арочную конструкцию, состоящую из узлов-зерен и межкристаллитных связей между ними, или как каркас границ зерен (рис. 3.8). Шероховатость пустотной структуры межзеренных границ дает основание рассматривать их с точки зрения теории фракталов. Признаком протекания процесса образования уплотненной трехмерно-упорядоченной объемной части структурных элементов кристаллической системы, происходящего за счет рекристаллизации вещества во фрактально расположенных порах, может служить начало резкой усадки твердых тел при некотором их охлаждении ниже температуры кристаллизации (около 2/3 от температуры плавления сплава).
Итак, процессы посткристаллизации приводят к образованию уплотненной объемной трехмерно-упорядоченной кристаллической части и обособлению ее от разреженной фрактальной пористой граничной зоны для структурных элементов каждого масштабного уровня в твердых сплавах. Если охватить целиком весь процесс кристаллизации, то в целом его можно охарактеризовать как уплотнение вещества под воздействием сжимающих напряжений термической природы. Вследствие этого на конечном этапе формирования кристаллически-упорядоченных областей в сплаве остается своего рода память о процессе, который привел к их возникновению. Иначе говоря, в кристаллически-упорядоченных областях структуры всегда имеются «носители памяти» - элементы, которые поддерживают остаточные сжимающие напряжения в кристаллической структуре. Они называются дислокациями, и с классической точки зрения считаются дефектами кристаллической структуры. В дальнейшем мы выясним, к чему приводит коллективное взаимодействие этих дефектов с пористой разреженной фрактальной структурой граничных слоев структурных элементов поликристалла. Мы также выясним, каким же образом структура материала под воздействием нагрузок на начальном этапе сопротивляется разрушению, а затем «готовится» к нему, и как в конечном итоге это разрушение происходит. Таким образом, природа процесса образования поликристаллических сплавов при кристаллизации из расплава такова, что в структуре сплавов изначально закладываются элементы, являющиеся «зародышами разрушения»твердого тела, то есть области скопления различных дефектов кристаллической структуры.
В зависимости от фазы, из которой выращивают кристалл, различают четыре метода приготовления кристаллов: 1) Из пара 2) Из жидкой фазы 3) Из гидротермального раствора 4) С помощью реакций в твёрдой фазе Выращивание кристаллов из газовой фазы Известны три способа получения кристаллов из газовой фазы: путём сублимации данного вещества, методом химических реакций в газе и химических транспортных реакций. Рассмотрим все эти способы. 3.6.1. Сублимация Если вещество обладает высоким давлением пара и испаряется без разложения, его кристаллы можно получить методом сублимации. Аппаратурное оформление метода разнообразно: проточные системы с использованием инертного газа – носителя; замкнутые системы (часто это отпаянные кварцевые трубки), как вакуумированные, так и заполненные газом. Вещество испаряется в зоне a и конденсируется в зоне b, где пар вследствие понижения температуры становится перенасыщенным. Если температурный градиент велик и поток вещества неограничен, то обычно образуется много центров кристаллизации. Ведение затравочного кристалла в таких случаях не эффективно. Все же из многих зародышей, образовавшихся вначале, в процессе роста одни обгоняют другие, так что в результате получается несколько крупных кристаллов на поликристаллическом основании. В таком весьма простом варианте сублимацию использовали для выращивания кристаллов сульфида кадмия, окиси цинка (в проточных и замкнутых системах) и карбида кремния (проточные системы). Недостаток метода заключается в том, что самые большие кристаллы в процессе роста попадают в горячую зону и дальнейшее их увеличение прекращается. Чтобы избежать этого, контейнер с растущим кристаллом перемещают относительно печи со скоростью, приблизительно равной скорости роста кристалла. Такой метод называют «вытягивание из паровой фазы». Он имеет то дополнительное преимущество, что кристалл растёт при постоянной температуре. 3.6.2. Химические реакции в газовой фазе В горячей зоне реакционного сосуда может происходить химическая реакция, если вводить туда по отдельности или вместе компоненты кристалла и их летучие соединения. При достаточно высокой температуре этой зоны, когда пар оказывается ненасыщенным относительно образующейся твёрдой фазы, кристаллизация происходит на сравнительно холодных частях системы. Условия роста напоминают те, о которых уже говорилось выше. Применение рассматриваемого метода можно проследить на примере выращивания кристаллов сульфида кадмия из смеси водорода, кадмия и сероводорода. Легирование достигается добавлением к газу – носителю пара примесного компонента. Таким путём были получены кристаллы сульфида кадмия, легированные следующими компонентами: галлием, индием, серебром, сурьмой, хлором. Как указывалось, рост кристалла при постоянной температуре и выдвижении растущего кристалла из горячей зоны, по-видимому, обеспечивает возможность получения более однородных и крупных кристаллов. Однако для получения монокристаллов этот метод ещё не применялся. 3.6.3. Химические транспортные реакции Если давление пара компонентов кристалла мало, то в паровую фазу их часто удаётся перевести в виде летучих соединений. Из пара, содержащего эти соединения, нужные кристаллы выращивают двумя способами, основанными на смещение равновесия кристалл – пар в зависимости от изменения температуры. Если соединения при высоких температурах проявляют тенденцию к разложению, то нагревание пара до такой температуры приводит к выделению компонентов кристалла и тем самым делает возможным выращивание кристалла. Например, кристаллы циркония получают при термическом разложении тетраиодида циркония ZrI4 (г) → Zr (тв) + 2I2 (г) Термодинамическим условием того, что эта реакция может быть использована для кристаллизации, являются неравенства ∆ Н>0, ∆ S<0, где ∆ Н и ∆ S – соответственно изменение энтальпии и энтропии при реакции. До высокой температуры система нагревается горячей металлической проволокой, на которой и происходит рост кристаллов. 3.6.4. Выращивание кристаллов из жидкой фазы Различают четыре метода выращивание кристаллов из жидкой фазы: получение твёрдой фазы из собственного расплава, из растворов в расплаве, из растворов в расплавленной соли или жидком растворителе. Хотя эти методы по существу одинаковы, они обсуждаются раздельно, поскольку имеются различия в способах их практического осуществления. 3.6.5. Методы выращивания кристаллов из расплава Для получения кристаллических веществ со строго определенной точкой плавления (например, очень чистых простых веществ или соединений с максимальной точкой плавления) поликристаллы изучаемого вещества расплавляют, а затем медленно понижают температуру расплава ниже точки плавления. Н 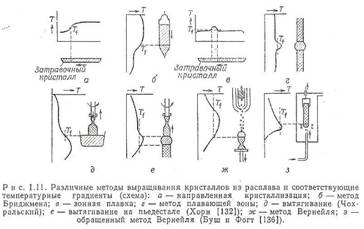 аиболее простыми являются методы, в которых кристаллизация осуществляется в результате постепенного затвердевания расплава с одного конца контейнера (направленная кристаллизация). Для этого используют горизонтальные кристаллизационные аппараты (методы Капица) или вертикальные (методы Штёбера, Бриджмена, Стокбаргера, Киропулоса). Недостаток этих методов – контакт расплава со стенками контейнера, затрудняющий выращивание монокристалла из – за образования большого количества центров кристаллизации. Это сказывается особенно сильно в том случае, когда расплав хорошо смачивает стенки контейнера. Иногда и хорошо пристающего к стенкам порошка. Например, монокристаллы германия были выращены в кварцевом сосуде, покрытом сажей. аиболее простыми являются методы, в которых кристаллизация осуществляется в результате постепенного затвердевания расплава с одного конца контейнера (направленная кристаллизация). Для этого используют горизонтальные кристаллизационные аппараты (методы Капица) или вертикальные (методы Штёбера, Бриджмена, Стокбаргера, Киропулоса). Недостаток этих методов – контакт расплава со стенками контейнера, затрудняющий выращивание монокристалла из – за образования большого количества центров кристаллизации. Это сказывается особенно сильно в том случае, когда расплав хорошо смачивает стенки контейнера. Иногда и хорошо пристающего к стенкам порошка. Например, монокристаллы германия были выращены в кварцевом сосуде, покрытом сажей.Другой недостаток этого метода (особенно при вертикальном расположении контейнера) – это то, что в кристаллах, охлаждающихся в контейнере, возникают значительные напряжения, которые приводят к появлению дислокаций. Разработан также метод получения кристаллов, основанный на предварительном плавлении исходного вещества в пламени (метод Вернейля). По этому методу небольшое количество материала расплавляются на вершине керамической подставки водородно-кислородным пламенем. Кристаллизация происходит при непрерывном опускании подставки из горячей зоны и добавлении в расплав через центральный конус горелки новых порций тонко измельченного порошка. Таким образом, выращивают кристаллы огнеупоров, например окиси алюминия, а с применением вместо горелки индукционного нагрева – кристаллы кремния. В последнем случае составом среды удаётся управлять, что практически невозможно при использовании пламени. Это преимущество сохраняется и в том случае, когда для нагрева используется излучение от угольной дуги. В такой форме метод применяли для выращивания кристаллов двуокиси титана. Вариант метода Вернейля, в котором горелка расположена снизу, а керамическая подставка сверху, использован Бушем и Фогтом для выращивания сплавов германия с кремнием. В этом случае порошок подаётся снизу на висящую кристаллическую затравку, подплавленную снизу с помощью индукционного нагрева. В тех случаях, когда без контейнера обойтись нельзя, а материала с подходящими свойствами нет, плавку выполняют в контейнере, состоящем из того же вещества. Это требует усиленного охлаждения снаружи, чтобы плавилась только центральная часть. Таким способом кристаллы кремния выращивали из расплава, помещённого в серебряный тигель, изнутри покрытый кремнием, а снаружи охлаждаемый водой. Ферриты выращивались из расплава в контейнере, изготовленном из того же материала и прочно связанном с охлаждаемым водой индукционным кольцом. Кристаллы окиси магния были выращены из расплава, помещённого в форму окиси магния. 3.6.6. Выращивание кристаллов из растворов Под кристаллизацией из растворов подразумевается рост кристалла соединения, химический состав которого заметно отличается от химического состава исходной жидкой фазы. Растворителями могут быть вода, многокомпонентные водные и неводные растворы, расплавы каких-либо химических соединений. В зависимости от температуры процесса и химической природы растворителя различают процессы выращивания из низкотемпературных водных растворов (при температурах не выше 80-90оС), перегретых водных растворов (гидротермальный метод, температуры до 800оС), солевых расплавов (методы кристаллизации из раствора в расплаве, температуры кристаллизации до 1500оС). Кристаллизацию из растворов применяют при выращивании веществ, разлагающихся при температурах ниже температуры плавления или имеющих несколько полиморфных модификаций. Рост кристаллов осуществляется при температурах ниже температуры плавления, поэтому в выращенных такими методами кристаллах отсутствуют дефекты, характерные для кристаллов, выращенных из расплава. При выращивании кристаллов из растворов движущей силой процесса является пересыщение, уровень которого характеризует величина переохлаждения DТ. Кристаллизацию из растворов можно осуществлять за счет изменения температуры раствора, за счет изменения состава раствора, а также использовать кристаллизацию при химической реакции. При выращивании кристаллов из низкотемпературных водных растворов проводят кристаллизацию путем изменения температуры раствора, пересыщение создается за счет снижения температуры в зоне растущего кристалла. Достигнуть этого можно либо постепенно понижая температуру во всем объеме кристаллизатора, либо создав в кристаллизаторе две зоны с различными температурами. Методом снижения температуры раствора было выращено большое число кристаллов, в том числе сегнетова соль, триглицинсульфат, квасцы и т. д. При использовании методов температурного перепада в кристаллизаторе создают две области с разными температурами. В одной из них происходит растворение вещества, которое всегда находится в избытке в виде твердой фазы, в другой — рост кристалла. Простейшим вариантом является высокий сосуд, в нижней части которого помещается исходное вещество, а в верхней подвешивается затравка. В результате возникает конвекция раствора, обеспечивающая постоянный перенос вещества снизу вверх, в зону роста. В таком оформлении метод температурного перепада применяется при гидротермальном выращивании кристаллов. Методом температурного перепада выращивают, например, кристаллы дигидрофосфата калия и дигидрофосфата аммония (KDP и ADP)Скорость роста кристаллов в таких условиях составляет около 1 мм/сут. Кристаллы весом 400 г растут в течение 1,5-2 месяцев. При кристаллизации за счет концентрационной конвекции обмен между зонами растворения и роста обеспечивается за счет разности плотностей насыщенного и ненасыщенного раствора. Питающее вещество помещается в верхнюю часть кристаллизатора, а затравка подвешивается внизу. Температура в верхней зоне более высокая, чем в нижней, поэтому тепловая конвекция подавляется. Насыщенный более плотный раствор опускается из верхней камеры в нижнюю, становится пересыщенным и происходит рост кристаллов. В методе кристаллизации при испарении растворителя пересыщение создается за счет увеличения концентрации растворенного вещества при испарении растворителя до значений, превышающих равновесное. Процесс осуществляется при постоянной температуре в строго изотермических условиях. В присутствии затравочных кристаллов процесс нарастания пересыщения регулируется растущим кристаллом. Скорости кристаллизации очень малы. Процесс выращивания кристаллов таким способом может достигать несколько недель. Кристаллизация при химической реакции основана на выделении твердых продуктов в процессе взаимодействия растворенных компонентов. Такой способ кристаллизации возможен лишь в том случае, если растворимость получаемого кристалла будет ниже растворимости исходных компонентов. Обычно химические реакции в растворе протекают с достаточно большой скоростью, создаются высокие пересыщения и происходит массовое выделение мелких кристаллов. Ограничение скорости достигается либо использованием слабо растворенных исходных продуктов, либо регулированием скорости поступления веществ в зону реакции. Кристаллизация при электрохимической реакции может рассматриваться как частный случай кристаллизации путем химической реакции, в которой участвуют электроны. Типичным примером являются выделения металлов в электролитической ванне. Электрокристаллизация в основном используется для осаждения металлов. Этот метод получил развитие при совмещении способа вытягивания кристалла из расплава при одновременном его электролизе (электрохимический способ Чохральского). В этом случае растущий кристалл является одним из электродов, и должен обладать достаточно высокой электропроводностью при температуре выращивания. Этим способом можно выращивать кубические кристаллы натрий-вольфрамовых бронз из расплава. Разнообразные способы кристаллизации веществ из высокотемпературных водных растворов при высоких давлениях пара раствора объединяют общим термином «гидротермальный способ» выращивания кристаллов. Его отличают: наличие водной среды, температуры выше 100оС и давления выше атмосферного. При гидротермальном методе за счет высоких температур, давлений, введения минерализатора (хорошо растворимое соединение) достигаются условия, позволяющие перевести в растворимое состояние кристаллизуемое вещество и обеспечить необходимо пересыщение раствора и кристаллизацию соединения. Гидротермальный метод позволяет выращивать кристаллы соединений, обладающих высокими температурами плавления при температурах более низких. Например, кристаллы сфалерита ZnS невозможно получить из расплава, так как при 1080оС в них происходит полиморфное превращение в гексагональную модификацию — вюрцит. В гидротермальных условиях рост сфалерита происходит при более низкой (300-500оС) температуре, т. е. в области устойчивой кубической модификации. Методом температурного перепада из гидротермальных растворов можно выращивать кристаллы кварца, рубина, кальцита и т. д. В гидротермальных условиях кристаллы можно растить либо путем синтеза, либо путем перекристаллизации. При этом процесс кристаллы вырастают в результате спонтанной кристаллизации, рекристаллизации, кристаллизации на затравку. Гидротермальная кристаллизация осуществляется при относительно низких температурах, поэтому в выращенных этим методом кристаллах отсутствуют сильные термические напряжения, пластические деформации, такие микродефекты, как блочность и т. д. Метод выращивания кристаллов из растворов в высокотемпературных расплавах (раствор в расплаве) получил развитие в связи с выращиванием монокристаллов сложных многокомпонентных систем. Используется высокая растворимость тугоплавких соединений в жидких неорганических солях и оксидах. Процесс осуществляется на воздухе при температуре плавления кристаллизуемого вещества. Этот метод был в числе первых, примененных в конце 19 в. для выращивания технически важных кристаллов (для выращивания кристаллов корунда). Его используют для выращивания монокристаллов иттрий-железистого граната, титаната бария и др. Зонная раствор-расплавная кристаллизация (зонная перекристаллизация градиентом температуры (ЗПГТ) или зонная плавка с растворителем) аналогична зонной плавке и заключается в том, что благодаря температурному градиенту происходит перемещение узкой зоны раствора вдоль образца. На границе между затравочным кристаллом и поликристаллическим слитком вещества предварительно помещают тонкий слой (толщиной порядка 1 мм) твердого вещества, которое будет служить растворителем. |