Фазовый переход жидкость твердое тело
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
| |||||||||||||||||||||||||||||||
| |
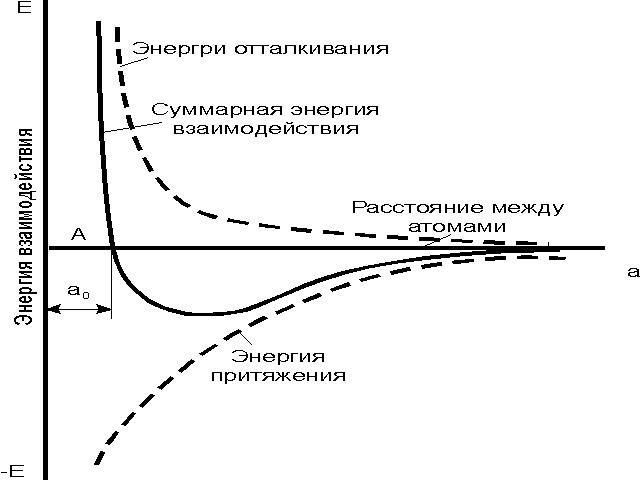
| Рис. 2.1. Силы взаимодействия двух атомов в кристаллической решетке. |
Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна. Этому состоянию соответствует равновесное состояние а0. Сближение атомов (ионов) на расстояние, меньшее а0, или удаление их на расстояние, большее а0, осуществимо лишь при совершении определенной работы против сил отталкивания и притяжения. Поэтому в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов. Ее следует представлять как мысленно проведенные в пространстве в направлении трех осей координат прямые линии, соединяющие ближайшие атомы и проходящие через их центры, около которых они совершают колебательные движения. Проведенные линии образуют объемные фигуры правильной геометрической формы. Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, называетсяэлементарной кристаллической ячейкой.
Математик Браве выделил 14 типов кристаллических решеток, но для металлов характерны три (рис. 2.2):
кубическая объемноцентрированная (ОЦК);
кубическая гранецентрированная (ГЦК);
гексагональная плотноупакованная (ГПУ).
Основными характеристиками кристаллических решеток являются:
1) период решетки аи с - расстояния между центрами ближайших атомов. Измеряется ангстремами (1A = 10-10 м), килоиксами (1кХ = 1,00202 A ) и нанометрами (1нм = 10-9 м). Для большинства металлов период решетки составляет 0,1 - 0,7 нм;
 |  |  |
| а) | б) | с) |
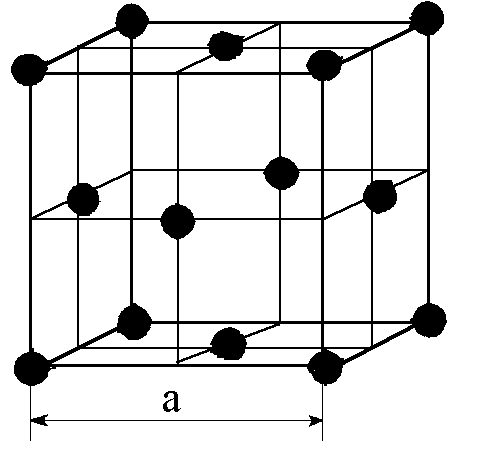
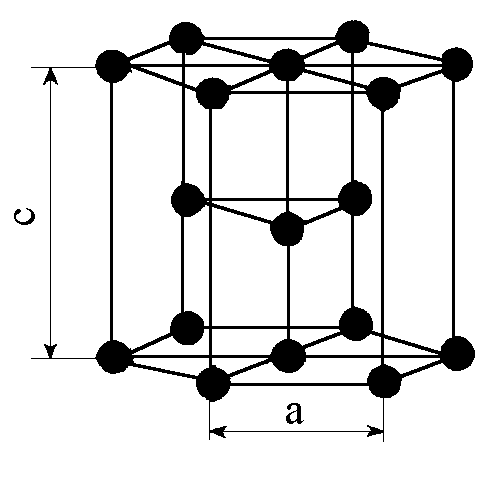
| Рис. 2.2 элементарные кристаллические ячейки а - ОЦК; б - ГЦК; в – ГПУ. | ||
2) координационное число– число атомов, находящихся на ближайшем и равном расстоянии от данного атома. Чем оно выше, тем больше плотность упаковки атомов. Для кубической ячейки координационное число обозначается буквой К, а гексагональной - Г.
Для ОЦК решетки минимальное расстояние между атомами равно a*. На таком расстоянии находится 8 атомов, т.е. координационное число кубической решетки равно 8. Оно обозначается К8. Для ГПУ это расстояние равно a*, координационное число - К12. Для ГЦК отношение с/а= 1,633 и координационное число Г12;
3) базис - это количество атомов, приходящееся на одну элементарную ячейку, обозначается буквой n. На одну элементарную ячейку ОЦК приходятся 2 атома (n=2): один в центре куба, а другой вносят атомы, располагающиеся в вершинах куба. Каждый атом в вершине куба одновременно принадлежит восьми элементарным ячейкам, примыкающим к нему, и на одну ячейку приходится лишь 1/8 часть атома. В целом на каждую ячейку приходится n = (1/8)*8 =1 атом. Координационное число считается для центрального атома и соответствует К8. На одну элементарную ячейку ГЦК приходится 4 атома (n=4), из них один вносят атомы в вершинах куба, а три суммарно вносят атомы, находящиеся на середине грани, так как каждый их таких атомов принадлежит двум ячейкам (1/2)*6 =3. Координационное число считается для атома, расположенного в центре грани, и соответствует К12. На одну элементарную ячейку ГПУ приходится шесть атомов (n=6), из них три находятся внутри ячейки. Два атома в центре граней дают один атом ((1/2)*2 =1), а двенадцать вершинных атомов - два атома ((1/6)*12 =2). Координационное число считается для атома, расположенного внутри ячейки, и соответствует Г12.
2.2. Энергетические условия и механизм процесса кристаллизации
Кристаллизация - это процесс образования кристаллической решетки при переходе из жидкого в твердое состояние.
| |
| а) б) |
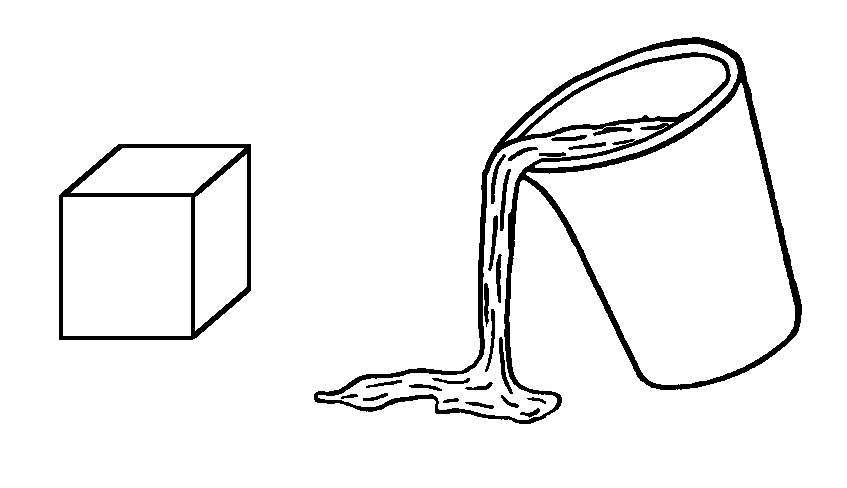
| Рис. 2.3. Твердое (а) и жидкое (б) состояния. |
Для того чтобы понять этот процесс, необходимо знать различие между твердым и жидким состоянием. Как показано на рис. 2.3, твердое тело имеет определенную форму и объем, обладает прочностью и пластичностью. Жидкости тоже имеют определенный объем, но обладая малой сдвиговой прочностью могут приобретать форму сосуда и могут течь. Таким образом, главное различие твердого и жидкого состояний заключается в изменении текучести. Текучесть определяется скоростью деформации тела под воздействием приложенной к нему статической силы сдвига.
Кроме того, разница в свойствах твердого тела и жидкости проявляется в коэффициенте диффузии - скорости, с которой атомы могут перемещаться в веществе с места на место при их хаотическом движении. Диффузия в жидкостях намного больше, чем в твердых телах. Например, для меди коэффициент диффузии в твердом состоянии равен 10-5 см2/с.
 |  |  |
| а) | б) | в) |
| Рис. 2.4. Ближний порядок (а) жидкости и дальний (б) твердого тела. Нарушение дальнего порядка в твердых телах вследствие теплового движения (в). | ||
Размещение атомов в жидкостях является неупорядоченным и характеризуется отсутствием дальнего порядка (рис. 2.4а), то есть упорядоченное расположение атомов распространяется на очень небольшое расстояние. Твердое тело можно представить себе как совокупность атомов, расположенных на определенном (межатомном) расстоянии (рис. 2.4б).
Вследствие интенсивного теплового движения атомов ближний порядок динамически неустойчив. Микрообъемы с правильным расположением атомов, возникнув, могут существовать некоторое время, затем распасться и возникнуть вновь в другом месте (рис. 2.4в). С понижением температуры степень ближнего порядка и размер таких микрообъемов возрастают.
Энергетические условия кристаллизации
Система, состоящая из большого числа атомов стремится к такому состоянию, которому в данных условиях соответствует минимальное значение величины свободной энергии. Если вещество может существовать в жидком и твердом кристаллических видах, то устойчивой в данных условиях будет та фаза, которая обладает меньшей величиной свободной энергии.
С изменением внешних условий, например, температура, свободная энергия системы изменяется по сложному закону, который различен для твердого и жидкого состояния (рис. 2.5). При температурах выше равновесной температуры плавления Тп меньшей свободной энергией обладает жидкая фаза, а ниже этой температуры - твердая фаза. При температуре Тп обе фазы могут существовать одновременно и процесс кристаллизации еще не начинается. Для его начала необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Из кривых на рис. 2.5 видно, что это возможно при охлаждении жидкости ниже равновесной температуры Тп.
Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации (Тк).
Разность между температурами Тп и Тк называется степенью переохлаждения: DТ=Тп-Тк. Чем больше степень переохлаждения DТ, тем больше разность свободных энергий DG и больше скорость кристаллизации.
 |
| Рис. 2.5. Изменение свободной энергии металла в жидком Gж и твердом состоянии Gт в зависимости от температуры. |
Механизм кристаллизации
Еще в 1878 году Д. К. Чернов, изучая структуру литой стали, указал, что процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые Чернов назвал «зачатками», а теперь их называют зародышами, или центрами кристаллов. В них атомы упакованы также, как в твердом металле. Схема кристаллизации приведена на рис. 2.6. Она начинается с образования кристаллических зародышей и продолжается в процессе роста их числа и размеров. Пока образовавшиеся кристаллы растут свободно, они имеют более или менее правильную геометрическую форму. Однако при столкновении их правильная форма нарушается, так как в этих участках рост граней прекращается. Рост продолжается только в тех направлениях, где есть свободный доступ «питающей» жидкости. В результате образуется структура с кристаллами неправильной формы - зернами или кристаллитами.
 |
| Рис. 2.6. Схема кристаллизации. |
Переход из одного состояния в другое, например, из жидкого в твердое, возможен тогда, когда твердое состояние более устойчиво, имеет более низкое значение свободной энергии. И так как переход из одного состояния в другое требует затраты энергии на образование поверхности раздела жидкость-кристалл, то превращение произойдет тогда, когда она будет меньше энергии перехода в более устойчивое состояние.
Свободная энергия системы DG определяется как алгебраическая сумма двух членов, характеризующих поверхностную Eп = S*sи объемную Ео = VDF энергии:
DG=Ss-VDGv, (2.1)
где S - поверхность;
s - поверхностное натяжение;
V - объем;
DGv - разность свободных энергий жидкого и кристаллического состояний, приходящаяся на единицу объема.
В процессе кристаллизации она, с одной стороны, уменьшается на VDGv вследствие перехода некоторого объема жидкого металла в твердый, а с другой стороны, возрастает в результате образования поверхности раздела с избыточной поверхностной энергией Ss.
По мере увеличения зародыша (например, сферической формы) поверхностный член увеличивается пропорционально квадрату радиуса, а объемный - кубу, т.е. если поверхность и объем частицы выразить через ее радиус, то получим:
DG= 4p r2ns- (4/3)pr3nDGv, (2.2)
где r - радиус частицы новой фазы;
n - число частиц.
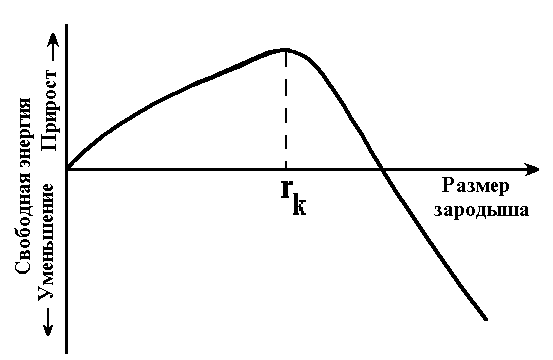
Увеличение размера зародыша вначале приводит к росту DG (т.к. объем V мал, а поверхность S относительно велика). Но при критическом значении rk увеличение размера зародыша приведет к уменьшению DG:
rk=2s/DGv. (2.3)
Если образуется зародыш размером меньше rk (рис. 2.7), то он расти не сможет, т.к. это приведет к увеличению энергии системы. Минимальный размер зародыша, который способен к росту, называется критическим размером зародыша, а сам зародыш называется устойчивым.
| |
| Рис. 2.7. Изменение свободной энергии в зависимости от размера зародыша. |
Каждой температуре кристаллизации (степени переохлаждения) отвечает определенный размер rk. Чем ниже температура (больше степень переохлаждения), тем меньший размер имеет устойчивый зародыш.
При прочих равных условиях скорость процесса кристаллизации и строение металла после затвердевания зависят от числа центров кристаллизации, возникающих в единице времени и в единице объема (1/(мм3с)), и скорости их линейного роста (мм/с).
Г. Тамман установил зависимость числа центров кристаллизации и скорости роста кристаллов от степени переохлаждения (рис. 2.8).
При DТ=0 процесс кристаллизации не идет, скорости образования зародышей и их роста равны нулю. При DТ=a число центров кристаллизации небольшое, а скорость их роста максимальна. В этом случае структура металла будет крупнозернистой. При DТ=b число центров - максимально, а скорость их роста мала. Структура металла мелкозернистая.
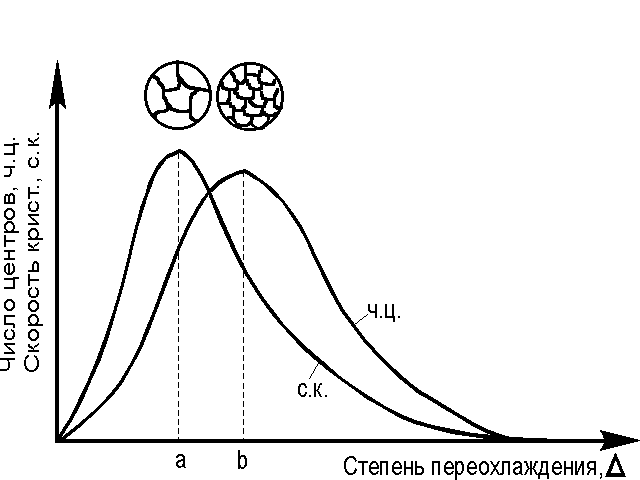 |
| Рис. 2.8. Скорость роста кристалла и скорость зарождения центров кристаллизации в зависимости от степени переохлаждения. |
При очень больших степенях переохлаждения DТ скорость кристаллизации и число центров равны нулю. Подвижность атомов уже недостаточна для того, чтобы осуществлялась перестройка их из хаотического расположения в жидкости в правильное в кристалле. Структура металла - аморфная.
Для получения аморфных металлов (металлические стекла) нужны скорости охлаждения порядка миллионов градусов в секунду. Такие скорости охлаждения достигаются при разбрызгивании мелких капель жидкого металла на хорошо отполированную поверхность быстро вращающегося холодного медного диска. Толщина пленки аморфного металла достигает нескольких микрометров (до 60 мкм) и ширины 200 мм, или проволоки диаметром 0,5-20 мкм. Другой вариант - прокатка тонкой струи расплава между двумя массивными медными валиками, расплющивающими капли жидкого металла. При нагреве аморфный металл может реализовать свое стремление к кристаллизации и при достаточной подвижности атомов образуется кристаллическое строение.
Аморфный металл обладает рядом уникальных свойств из-за отсутствия границ зерен и дефектов кристаллического строения (например, дислокаций). Прочность их превосходит самые лучшие легированные стали ( 3000 МПа). Высокая твердость определяет их великолепную износостойкость. Правда пластичность аморфных металлов низка, но выше, чем у обычного стекла. Их можно, например, прокатывать при комнатной температуре. Другое важнейшее преимущество - их исключительно высокая коррозионная стойкость. Во многих весьма агрессивных средах (морской воде, кислотах) они не корродируют вообще. Аморфные сплавы на основе ферромагнитных металлов (железа, никеля) также ферромагнитны, электросопротивление их гораздо выше, чем кристаллических (обычно в 2-3 раза). Получение аморфной структуры в принципе возможно для всех металлов. Наиболее легко аморфное состояние достигается в сплавах Al, Pb, Sn, Cn и др. Для получения металлических стекол на базе Ni, Co, Fe, Mn, Cr к ним добавляют неметаллы или полуметаллические элементы C, P, Si, B, As, S и др.
Аморфные сплавы, например, на основе железа Fe80B20, Fe80P13C, Fe60Cr6Mo6B28; на основе никеля Ni82P18, Ni80S20.