ПосФХпроцЧ1.АтмосфХОС05. Физикохимические процессы в атмосфере
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
6.4. Соединения азота в тропосфереСоединения азота в тропосфере представлены в основном оксидами азота, аммиаком и солями аммония, а также азотной кислотой и нитратами. Среди оксидов азота следует выделить гемиоксид (N2O), оксид (NO) и диоксид азота (NO2). Другие соединения азота с кислородом (NO3, N2O3, N2О4, N2O5) в условиях тропосферы являются неустойчивыми. Так, например, триоксид диазота и тетраоксид диазота легко разлагаются с образованием NO и NO2: N2O3 + h NO + NO2 (112) N2O4 + h 2NO2 (113) Триоксид азота сравнительно быстро подвергается фотодиссоциации или вступает во взаимодействие с другими примесями: NO3 + h NO + O2 (114) NO3 + NO2NO2 (115) Пентаоксид диазота также является неустойчивым в тропосфере соединением и разлагается с образованием триоксида диазота и кислорода или под действием влаги превращается в азотную кислоту: N2O5 N2О3 + О2 (116) N2O5 + Н2О 2НNO3 (117) Поэтому под общей формулой оксидов азота NOx обычно подразумевают NO, NO2 и N2O. Среднее значение концентрации гемиоксида азота в тропосфере незначительно меняется с высотой над уровнем моря и географической широтой местности и составляет в среднем, по данным различных авторов, 0,26 или 0,33 млн–1 . Общее количество гемиоксида азота, поступающего в атмосферу в основном в результате протекания процессов денитрификации, составляет примерно 100 млн т в год. Общее количество N2O в атмосфере оценивается величиной 2000 млн т, таким образом, среднее время пребывания молекул гемиоксида азота в атмосфере составляет 20 лет. Основные процессы вывода N2O из атмосферы связывают с протеканием процессов фотодиссоциации: N2O + h N2 + О, 250 нм (118) или с взаимодействием с синглетно возбужденным атомом кислорода: N2O + О(1D) N2 + O2 (119) или N2O + O(1D) 2NO (120) Реакции (119) и (120) протекают с примерно одинаковой скоростью (константы скорости при 298 К равны 7,4 10-11 и 8,6 10-11 см3 с–1). Поскольку в тропосфере концентрация синглетно возбужденных атомов кислорода является низкой и практически нет излучения с длиной волны 250 нм, молекулы N2O обладают большим временем жизни и могут переместиться в стратосферу. В стратосфере в связи с ростом концентрации O(1D) атомов и изменением спектра проходящего солнечного излучения скорость процессов разрушения молекул N2О резко возрастает. Поэтому концентрация N2O на высоте 35 км примерно в 10 раз меньше, чем в тропосфере. Оксид и диоксид азота в тропосфере подвергаются взаимным превращениям. Как известно, NO в присутствии кислорода окисляется до NO2. Расчеты показывают, что в равновесных условиях концентрация диоксида азота примерно в 100 раз должна превышать содержание NO. Поэтому долгое время при анализе атмосферы на содержание оксидов азота определяли только концентрацию NO2 в воздухе. Однако исследования, проведенные в последние 15-20 лет, показали, что содержание оксида азота NO в приземном слое воздуха сопоставимо с концентрацией NO2. Это является следствием интенсивного поступления NO в атмосферу с поверхности планеты, что делает практически невозможным достижение равновесия. Поэтому при анализе атмосферного воздуха на общее содержание оксидов азота предварительно необходимо окислить NO до NO2 и затем проводить определение содержания NO2 в пробе. Основные природные источники оксидов азота (процессы денитрификации, окисление NН3 и азота при разрядах молний) ежегодно поставляют в тропосферу от 21 до 89 млн т NOx; в пересчете на элементный азот. Помимо этого в результате антропогенных выбросов еще около 20 млн т азота в виде оксидов выбрасывается в атмосферу. Как природные, так и антропогенные выбросы преимущественно содержат оксид азота NO. Одним из основных источников образования оксида азота является окисление азота воздуха, сопровождающее все процессы горения, в которых в качестве окисления используется воздух. С повышением температуры увеличивается равновесное количество оксида азота в воздухе. Процессы сжигания ископаемого топлива на тепловых электростанциях и сжигания топлива в двигателях автомобилей являются основными источниками загрязнения атмосферы оксидами азота. 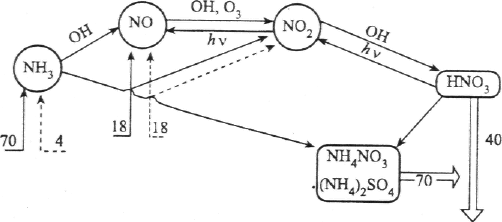 Рис. 6. Атмосферный цикл соединений азота  (числа – млн т элементной азота в год): (числа – млн т элементной азота в год):– природные поступления соединений азота; – антропогенные поступления соединений азота; – вывод из атмосферы В тропосфере NO, взаимодействуя с гидропероксидным радикалом, переходит в диоксид азота: NO + НO2 NO2 + ОН (121) Другой возможный путь окисления оксида азота - взаимодействие с озоном: NO + O3 NO2 + О2 (122) Константы скоростей реакций (121) и (122) при 298 К равны, соответственно, 8,4 10–12 и 1,8 10–14см3 с–1. Диоксид азота в тропосфере в присутствии излучения длиной волны < 398 нм разлагается с образованием оксида азота и атома кислорода: NO2 + h NO + O(3P) (123) Образующийся оксид азота вновь подвергается процессу окисления, а атомарный кислород приводит к появлению в тропосфере озона. Важной частью атмосферного цикла соединений азота (рис. 6) является образование азотной кислоты. Примерно 44% азотной кислоты в тропосфере образуется в результате взаимодействия диоксида азота с гидроксидным радикалом: NO2 + ОН НNО3 (124) Около 24% HNО3 появляется в атмосфере в результате взаимодействия пентаоксида диазота с молекулами H2Oпо уравнению (117). До 28% всей выделяющейся в атмосфере азотной кислоты образуется при взаимодействии триоксида азота с органическими кислородсодержащими радикалами. Часть азотной кислоты разлагается с образованием диоксида или триоксида азота, которые вновь включаются в атмосферный цикл соединений азота (рис. 6): HNO3 OH + NO2 (125) HNO3 + OH NO3 + H2O (126) Основное количество азотной кислоты выводится из тропосферы с атмосферными осадками в виде растворов НNO3 и ее солей. Среди нитратов, присутствующих в атмосфере, основное количество составляет азотнокислый аммоний, который, как и в случае сульфата аммония, образуется при взаимодействии аэрозолей азотной кислоты с NН3. Среднее содержание газообразного аммиака в приземном слое воздуха составляет 0,3-9,1 мкг м–3 и резко падает с увеличением высоты. На высоте около 2 км содержание аммиака в воздухе снижается более чем в три раза и далее в тропосфере практически не меняется. Характер изменения профиля концентраций аммиака по высоте и увеличение его концентрации в приземном слое с ростом температуры (в летнее время) свидетельствует о биологическом происхождении основного количества NН3. Ежегодно из природных источников в атмосферу поступает около 70 млн т NH3 в пересчете на азот. Антропогенный вклад в загрязнение атмосферы аммиаком составляет всего около 4 млн т. В тропосфере аммиачный азот представлен в основном содержащимися в аэрозолях ионами аммония. Общее содержание NH4 - ионов в пересчете на элементный азот составляет примерно 2 млн т, что примерно в два раза превышает общее содержание газообразного аммиака. С атмосферными осадками и в результате процессов сухого осаждения ежегодно около 70 млн т соединений аммония выводится из атмосферы. Часть аммиака (от 3 до 8 млн т в год) вступает во взаимодействие со свободными радикалами, в основном с гидроксидным радикалом: NН3 + ОН NН2 + Н2O (127) В дальнейшем NН2 легко окисляется до оксида азота. |
