|
|
ПосФХпроцЧ1.АтмосфХОС05. Физикохимические процессы в атмосфере
Наиболее важные физико-химические процессы, протекающие в стратосфере, связаны с наличием в этой зоне атмосферы области с повышенным содержанием озона, часто называемой озоновым слоем. Поэтому представляется необходимым более подробно рассмотреть фотохимические превращения этого соединения.
5.1. Озон в атмосфере
Озон – О3 – аллотропная модификация кислорода. Общая масса озона в атмосфере оценивается примерно в 3,3 млрд т. Это высокотоксичный газ, его токсичность примерно на порядок превышает токсичность диоксида серы. Озон – сильнейший окислитель, реагирующий практически с любыми веществами – от автомобильных покрышек до тканей легких человека. Поэтому дышать озоном нельзя, и его присутствие в воздухе тропосферы даже в сравнительно небольших количествах представляет опасность для всего живого.
Важной особенностью озона является его способность поглощать излучение:
О3 + hv O2 + O (34)
Озон разрушается, поглощая излучение с длиной волны меньше 1130 нм (инфракрасное излучение), но максимум поглощения наблюдается при длине волны короче 320 нм (ультрафиолетовое излучение). Озон поглощает ультрафиолетовое излучение в тысячи раз лучше, чем кислород, и количества озона в стратосфере, где концентрация его достигает максимальных значений, в десятки и сотни раз превышающих среднее его содержание в тропосфере, достаточно для практически полного поглощения жесткого ультрафиолетового излучения Солнца. Поэтому озон стратосферы выполняет защитную функцию, и уменьшение его количества в этой области атмосферы может представлять опасность для биоты и, прежде всего для человека.
Зона с максимальными значениями концентрации озона находится на высотах от 15 до 35 км. На больших высотах концентрация озона резко снижается, и на высоте более 85 км озон практически отсутствует. Поэтому озон мезосферы хотя и поглощает ультрафиолетовое излучение, однако вносит лишь небольшой вклад в защиту биосферы от солнечного излучения в этой области спектра. Озон мезосферы играет важную роль в поддержании теплового баланса планеты и формировании нижнего слоя ионосферы.
Для характеристики содержания озона в атмосфере часто используются два принципиально разных подхода. В начальные периоды изучения озонового слоя планеты (в 20-х годах прошлого столетия) основным прибором для измерения содержания озона в атмосфере был спектрометр Добсона. Этот прибор позволял достаточно надежно определять общее количество озона, находящегося в столбе воздуха над наблюдателем. Полученные значения суммарного объема озона в столбе атмосферы единичной площади сечения приводили к нормальным условиям и определяли высоту, которая приходится в этом столбе атмосферы на весь озон. Слой озона высотой 10–5 м принимается равным одной единице Добсона (е.Д.). Общее количества озона в атмосфере меняется от 120 до 760 е.Д. (наиболее часто – 200-400 е.Д.) при среднем для всего земного шара значении 290 е.Д. Таким образом, весь озон, собранный из атмосферы к поверхности Земли, мог бы покрыть ее слоем, толщина которого в среднем составила бы 2,9 мм. Ошибочная трактовка данного способа выражения общего содержания озона в атмосфере привела к формированию в массовом сознании понятия озонового слоя, или тонкого озонового экрана, якобы существующего в атмосфере. В реальных условиях весь озон неравномерно распределен в слое воздуха от поверхности Земли практически до верхней границы мезосферы. Характер этого распределения связан с процессами образования и гибели озона. В общем виде высотный профиль концентраций озона приведен на рисунке 3.
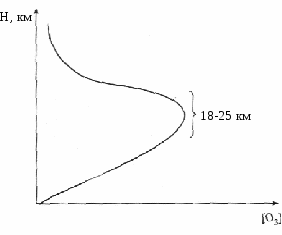
Рис. 3. Изменение концентрации озона в атмосфере по высоте
Общее содержание озона в атмосфере над конкретной территорией изменяется в достаточно широких пределах. Помимо фотохимических процессов значительный вклад в изменение содержания озона и его концентрации на различных высотах вносят процессы движения воздушных масс. В настоящее время выявлены общие закономерности ряда таких изменений, связанные со временем года и географической широтой местности. Так, в северном полушарии на широтах более 30° с.ш. общее содержание озона в атмосфере максимально в конце зимы – начале весны, а минимально осенью (сентябрь – октябрь). Наибольшие изменения характерны для высоких широт (70-80° с.ш.), где среднее содержание озона может меняться от 450 е.Д. – в марте до 280 е.Д. в сентябре. На широте 40-43° с.ш. изменения менее контрастны (от 370 е.Д. весной до 280 е.Д. осенью). На низких широтах (менее 30° с.ш.) сезонные изменения практически отсутствуют (не превышают 20 е.Д.). В южном полушарии общая картина сезонных изменений такая же, хотя и менее выраженная.
В целом в атмосфере по характеру сезонных колебаний и высотному профилю концентраций озона принято выделять три зоны:
полярная зона – характеризуется наибольшими значениями среднегодового общего содержания (около 400 е.Д.) и концентраций озона, наибольшими сезонными колебаниями (около 50%); зона максимальной концентрации озона расположена наиболее близко к поверхности – на высотах 13-15км, концентрация озона в этой зоне (содержание молекул озона в 1 см3) составляет (4 5) . 1012см –3;
тропическая зона – среднегодовые значения общего содержания озона невелики и составляют примерно 265 е.Д., сезонные колебания не превышают 10-15%; зона максимальной концентрации озона находится на высотах 24-27км, концентрация озона в этой зоне составляет (1 2) . 1012см –3;
средние широты – занимают промежуточное положение, сезонные изменения составляют 30-40% от средних значений, зона максимальной концентрации озона находится на высотах 19-21км, концентрация озона в этой зоне достигает 3 . 1012 см –3.
5.2. Образование и разрушение озона в атмосфере
При взаимодействии с изучением длиной волны менее 240 нм молекула кислорода, как уже отмечалось выше, диссоциирует с образованием двух атомов кислорода. В зависимости от величины энергии поглощенного кванта один или оба образующихся атома кислорода могут находиться в возбужденном состоянии:
O2 + hv O(1D) + O(3P), (35)
где O(1D) –атом в возбужденном состоянии;
О(3Р) – атом в основном состоянии.
Лишь атом, находящийся в основном состоянии, способен вступить в реакцию синтеза озона. Этот процесс может быть представлен следующим уравнением реакции:
O2 + O(3P) + M O3 + M*, (36)
где М – так называемое «третье тело», присутствие которого необходимо для отвода части энергии, выделяющейся в процессе. В результате реакции третье тело, в качестве которого в атмосфере выступают молекулы азота или кислорода, которых значительно больше, чем других газов, переходит в возбужденное состояние (M*).
Участие возбужденных атомов кислорода, в реакции (36) не приводит к синтезу озона, поскольку в этом случае даже перераспределением энергии при участии третьего тела не удается стабилизировать молекулу озона.
Молекула озона может взаимодействовать с атомом кислорода с образованием двух молекул кислорода:
O3 + O 2O2 (37)
Эта реакция, часто называемая реакцией с участием «нечетного кислорода», приводит к стоку озона из стратосферы. Однако скорость этой реакции значительно ниже скорости реакции образования озона, поэтому вклад реакций с участием «нечетного кислорода» в процессы вывода озона из атмосферы незначителен. Основное количество озона в атмосфере разлагается в результате поглощения излучения по реакции (34). В зависимости от энергии поглощенного кванта образующийся атом кислорода может находиться в возбужденном или в основном состоянии:
O3 + hv O2 + O(1D) (38)
O3 + hv O2 + O(3P) (39)
Атом кислорода в основном состоянии может вновь принять участие в синтезе озона. Реакции образования (36) и разложения (39) озона часто называют нулевым цикломозона.
Значительный вклад в процесс разрушения озона вносят цепные процессы, протекающие с участием гидроксидных радикалов (водородный цикл), оксидов азота (азотный цикл), соединений хлора и брома (хлорный и бромный циклы). Рассмотрим более подробно каждый из этих циклов.
Водородный цикл. При поглощении кванта света с длиной волны менее 240 нм молекулы воды могут распадаться с образованием гидроксидного радикала и атомарного водорода:
H2O + hv + H (40)
Гидроксидные радикалы образуются и при взаимодействии молекул воды или метана с возбужденным атомом кислорода:
O(1D) + H2O 2OH (41)
O(1D) + CH4 CH3 + OH (42)
Образовавшийся в этих процессах гидроксидный радикал может вступить в реакцию с озоном. Продуктами этого взаимодействия являются гидропероксидный радикал и молекула кислорода. Гидропероксидный радикал при взаимодействии с атомарным кислородом в основном состоянии образует молекулу кислорода и гидроксидный радикал. Водородный цикл, брутто-уравнение которого идентично реакции (37), входящей в нулевой цикл, замыкается, но при этом полностью нарушается нулевой цикл озона:
OH + O3 HO2 + O2 (43)
HO2 + O OH + O2 (44)
O 3 + O 2O2 (37) 3 + O 2O2 (37)
Азотный цикл. Оксид азота при взаимодействии с озоном окисляется до диоксида азота, но при взаимодействии NО2 с атомарным кислородом в невозбужденном состоянии вновь образуется оксид азота. Азотный цикл замыкается, но при этом нарушается нулевой цикл озона:
NO + O3 NO2 + O2 (45)
NO2 + O NO + O2 (46)
О 3 + О = 2О2 (37) 3 + О = 2О2 (37)
Необходимо отметить, что опасность для озонового слоя представляют только образующиеся непосредственно в стратосфере оксиды и диоксиды азота. NO и NО2, образующиеся в воздухе тропосферы, имеют малое время жизни и не успевают достигнуть стратосферы. Среди оксидов азота, образующихся на поверхности Земли, опасность для озонового слоя представляет лишь имеющий достаточно большое время жизни и поэтому способный преодолеть глобальный инверсионный барьер и достичь зоны максимальной концентрации озона гемиоксид азота (N2О). Этот газ, образующийся в процессах денитрификации в почве, при взаимодействии с возбужденным атомом кислорода превращается в оксид азота, инициирующий азотный цикл гибели озона:
N2O + O(1D) 2NO (47)
Хлорный цикл. Атом хлора при взаимодействии с молекулой озона образует оксид хлора и молекулу кислорода. Оксид хлора способен взаимодействовать с атомарным кислородом, находящимся в невозбужденном состоянии, с образованием атомарного хлора и молекулы кислорода. Хлорный цикл замыкается, а нулевой цикл озона нарушается:
Cl + O3 ClO + O2 (48)
ClO + O Cl + O2 (49)
O 3 + О = 2О2 (37) 3 + О = 2О2 (37)
Атомарный хлор появляется в стратосфере при фотохимическом разложении ряда хлорфторуглеводородов, которые благодаря малой химической активности и большому времени жизни успевают достигнуть зоны максимального содержания озона в стратосфере. Наибольшую опасность среди хлорфторуглеводородов представляют некоторые из производившихся до последнего времени в больших количествах фреонов (техническое название группы насыщенных алифатических галогенсодержащих углеводородов). Эти соединения, обладающие низкой реакционной способностью, широко использовались в холодильной технике, при производстве пенопластов и каучука, в изготовлении различных бытовых товаров в аэрозольных упаковках. Попадая в стратосферу, эти соединения могут взаимодействовать с излучением с длиной волны менее 240 нм, при этом происходит образование атомарного хлора, как, например, в случае фреона Ф-11 (СFСl3)
CFCl3 + hv CFCl2 + Cl (50)
и может начаться разрушение озонового слоя.
В настоящее время в соответствии с Монреальским протоколом и рядом дополнительных международных протоколов, подписанных в последние годы, производство озоноопасных фреонов практически прекращено. Вместо них в соответствующих отраслях промышленности используются зачастую менее эффективные, но более безопасные органические соединения. Так, например, введение в молекулу хлорфторуглеводорода атомов водорода делает соединение более реакционноспособным, его время жизни в тропосфере значительно уменьшается, и такие соединения уже не способны достичь стратосферы и повлиять на содержание в ней озона. Другой путь связан с полной или частичной заменой атомов хлора в молекуле фреона. В этом случае молекула либо может стать более реакционноспособной (с уменьшением времени жизни), либо она не будет представлять опасности для озонового слоя, поскольку хлорный цикл в отсутствие хлора невозможен.
Бромный цикл. Атом брома подобно атому хлора способен при взаимодействии с озоном образовывать оксид брома и молекулу кислорода. Однако в отличие от оксида хлора ВrО может вступить в реакцию с другой молекулой оксида брома или с оксидом хлора, при этом образуются два атома соответствующего галогена и молекула кислорода:
Br + O3 BrO + O2 (51)
BrO + BrO 2Br + O2 (52)
BrO + ClO Br + Cl + O2 (53)
Во всех рассмотренных до этого циклах нарушения озонового слоя реакция с участием атомарного кислорода является наиболее медленной, и ее скорость лимитирует соответствующие циклы. В случае бромного цикла процесс значительно ускоряется, и бром потенциально наиболее опасен для озонового слоя. Однако влияние этого цикла на озоновый слой в настоящее время меньше, чем влияние других рассмотренных циклов. Это связано с меньшими концентрациями брома в стратосфере. Основными источниками брома в стратосфере являются бромсодержащие органические соединения, используемые для тушения пожаров (галоны). Эти соединения, как и фреоны, устойчивы в тропосфере, имеют большое время жизни и, попадая в стратосферу, разлагаются под действием жесткого ультрафиолетового излучения. Образующийся при этом атом брома может вступить во взаимодействие с молекулой озона.
5.3. Обрыв цепи в процессах, вызывающих разрушение озона
В рассмотренных выше цепных процессах «активные» частицы не расходуются. Каждая из «активных» частиц может многократно (до 107 раз) инициировать цикл разрушения озона, пока не будет выведена из зоны с максимальным содержанием озона, где ее присутствие наиболее опасно. Наличие процессов вывода (стока «активных» частиц), приводящих к обрыву реакционной цепи, имеет большое значение с точки зрения сохранения озонового слоя, поскольку при отсутствии таких процессов весь озон в атмосфере был бы разрушен.
Гидроксидный и гидропероксидный радикалы, являющиеся «активными» частицами водородного цикла, могут вступать во взаимодействие с различными компонентами атмосферного воздуха, но наиболее вероятными для стратосферы являются следующие реакции:
CH4 + OH CH3 + H2O (54)
OH + HO2 H2O + O2 (55)
Возможным представляется и взаимодействие гидроксидного радикала с оксидом азота:
OH + NO HNO2 (56)
Протекание этого процесса приводит к образованию временного резервуара для «активных» частиц водородного и азотного циклов, поскольку азотистая кислота сравнительно легко разлагается с образованием исходных «активных» частиц. Образование временных резервуаров в виде азотной и азотистой кислот является одной из особенностей азотного цикла. Окончательный обрыв цепи превращений азотного цикла наступает в результате вывода этих временных резервуаров из зоны с максимальной концентрацией озона в тропосферу.
Динамические процессы, приводящие к выводу «активных» частиц в тропосферу, играют важную роль и в галогенных (хлорном и бромном) циклах разрушения озона. Помимо этого «активные» частицы этих циклов могут вступать в другие реакции, образуя временные резервуары.
Особое значение для обрыва цепи имеет реакция взаимодействия оксида хлора и диоксида азота, которая приводит к образованию сравнительно устойчивого и инертного по отношению к озону хлористого нитрозила:
ClO + NO2 ClONO2 (57)
Следует обратить внимание на то, что этот процесс интенсифицируется при увеличении концентраций СlO и NO2 в атмосфере и делает практически невозможным одновременное осуществление азотного и хлорного циклов. Однако при определенных условиях этот временный резервуар для сбора «разрушителей» озонового слоя может представлять серьезную опасность для озона, как это происходит, например, при образовании «озоновой дыры» над Антарктидой.
5.4. «Озоновая дыра» над Антарктидой
Понятие «озоновой дыры» связывают с уменьшением общего содержания озона во всех областях атмосферы над определенной территорией. Наиболее часто это явление ассоциируется с уменьшением общего количества озона над Антарктидой, где такой процесс, протекающий с разной интенсивностью, в последние десятилетия наблюдается практически ежегодно и где он был зафиксирован впервые.
Над Антарктидой явление «озоновой дыры» носит ярко выраженный сезонный характер и проявляется лишь в весенний период. Например, весной 1987 г. наблюдалось уменьшение содержания озона с 300 е.Д. до 150-200 е.Д., а в некоторых областях до 100 е.Д., причем зона, в которой содержание озона составляло менее 200 е.Д., в этот период занимала примерно 40 млн км2. В последние годы все чаще появлялись сообщения о периодическом увеличении масштабов этого явления, область «озоновой дыры» уже достигала территории Австралии и Чили. Правительства и население этих стран вынуждены были принять специальные меры по борьбе с возможными последствиями. Так, во избежание дополнительного облучения ультрафиолетовыми лучами, которые при уменьшении содержания озона способны достигать поверхности Земли, в Австралии родители стали одевать детей в закрытые купальники, а в Чили появились специальные рекомендации, связанные с поведением людей на открытом воздухе в дневные часы.
Теоретически процесс был описан в начале 70-х годов 20-го века, экспериментальные доказательства механизма образования «озоновой дыры» над Антарктидой получены в 80-х годах, а в 1995 г. ученые Ш. Роуланд (США), М. Молина (США), П. Крутцен (ФРГ), занимавшиеся этой проблемой, были удостоены Нобелевской премии по химии. В соответствии с современными представлениями, причина образования «озоновой дыры» над Антарктидой является комплексной и связана как с совокупностью природных явлений (полярный вихрь), так и с антропогенным влиянием на состояние атмосферного воздуха. Так, систематическое увеличение поступления хлорфторуглеводородов в атмосферу, наблюдавшееся во второй половине прошлого века, и специфика движения воздушных масс в стратосфере высоких широт привели к тому, что в период возникновения «озоновой дыры» концентрация озоноразрушающих веществ в воздухе над Антарктидой резко возрастала. Например, содержание оксида хлора превышало соответствующие значения, регистритуемые в соседних областях стратосферы, в сотни раз. При таких высоких концентрациях СlO протекает процесс образования димеров (С1O)2.
Устойчивый антициклон, так называемый полярный вихрь, возникающий каждой зимой над Антарктидой, приводит к временному прекращению обмена воздухом с другими областями стратосферы и стоку озона в тропосферу. Поступление озона, образующегося в тропической или среднеширотной зонах стратосферы, в этот период прекращается. Однако возникающий дефицит озона в условиях полярной ночи не представляет опасности для биоты.
Температура воздуха внутри вихря резко снижается до –70 или –80°С. В стратосфере появляются устойчивые аэрозольные образования – «серебристые» облака, состоящие из кристаллов льда и капель переохлажденной жидкости. В состав этих аэрозолей входят димеры оксида хлора (СlО)2, хлористый нитрозил (СlОNО2) и другие соединения азота (HNO3, HNO2). В зимний период эти соединения, связанные с аэрозолями, не взаимодействуют с озоном. Весной циркумполярный вихрь распадается, и при повышении температуры на поверхности кристаллов льда начинают протекать гетерогенные химические процессы:
ClONO2 + H2O HOCl + HNO3 (58)
или ClONO2 + HCl Cl2 + HNO3 (59)
Образующиеся молекулы Cl2 и НОСl неустойчивы и в отличие от НСl и СlONO2 при появлении первых солнечных лучей распадаются даже под воздействием видимого излучения:
Cl2 + hv 2Cl (60)
HOCl + hv OH + Cl (61)
Таким образом, с наступлением весны в стратосфере над Антарктидой появляется ряд озоноразрушающих веществ, и начинаются цепные процессы разрушения озона на фоне природного дефицита озона, содержание которого не успевает восстановиться после окончания полярной ночи.
Особую роль в разрушении озона над Антарктидой играют димеры оксида хлора. Эти соединения неустойчивы и при воздействии излучения разлагаются:
(ClO)2 + hv Cl + ClOO (62)
и далее СlOO Сl + O2 (63)
Суммируя все уравнения реакций «димерного цикла» – (48, 62, 63), получим:
2O3 + hv 3O2 (64)
Эта суммарная реакция «димерного цикла» лишь внешне напоминает процесс защитного действия озона, описываемый уравнениями (38) и (39), поскольку в данном случае разложение озона происходит под действием видимого излучения.
Таким образом, протекание гетерогенных реакций и «димерный цикл» резко интенсифицируют процесс разрушения озона над Антарктидой в весенний период и приводят к образованию «озоновой дыры». В дальнейшем кристаллики льда растают, гетерогенные процессы прекратятся, оксид хлора частично израсходуется, а частично свяжется с диоксидом азота в хлористый нитрозил. В основном благодаря динамическим процессам стратосферной циркуляции в полярную область поступит озон из других областей атмосферы, часть его будет синтезирована над Антарктидой, и «дыра» постепенно, в течение одного-двух месяцев закроется.
«Озоновые дыры», хотя и менее ярко выраженные, наблюдались в весенние месяцы и в северном полушарии.
5.5. Международные соглашения, направленные на сохранение озонового слоя
Продолжавшийся с середины и практически до конца прошлого века рост производства галогенпроизводных органических соединений привел к увеличению их концентрации в атмосфере. Так, только в период с 1970 по 1980 г. относительная концентрация таких озоноопасных соединений, как фреон-11 и фреон-12, возрастала в стратосфере в четыре и в три раза соответственно.
Серьезную озабоченность вызывала и наблюдавшаяся в конце прошлого века тенденция уменьшения количества озона в стратосфере. Например, среднегодовое содержание озона за 18 лет (с 1969 по 1986 г.) снизилось в высоких широтах (53-64° с.ш.) на 2,3 ± 0,7%, в средних широтах (40-50° с.ш.) – на 3,8 ± 0,8% и на широтах 30-38° с.ш. – на 1,7 ± 0,7%. Необходимо отметить, что наибольшее отклонение, составившее 6,2 ± 1,5%, отмечено в высоких широтах в зимний период. Эти значения дают небольшой, но устойчивый тренд уменьшения содержания озона в атмосфере. Ежегодное уменьшение содержания озона в стратосфере в зимний период с 1969 по 1986 г. составляло примерно 0,3% при суммарных 6% за 18 лет.
Серьезное беспокойство в мире вызвали сообщения об уменьшении содержания озона над Антарктидой. Поскольку основной причиной этого явления считались хлорфторуглеводороды, мировое сообщество предприняло объединенные усилия, направленные на уменьшение производства и выброса в атмосферу озоноразрушающих веществ.
Первым международным актом, ограничивающим производство фреонов и других разрушающих озоновый слой соединений, стал Монреальский протокол. Он был подписан тридцатью странами в 1987 г. и вступил в силу с 1 января 1989 г.
Основными положениями Монреальского протокола были определены следующие действия, которые обязались предпринять подписавшие его страны:
1) производство фреонов 11, 12, 11З, 114, 115
заморозить на уровне 1986 г. начиная с 1992 г.;
сократить до 80% от уровня 1986 г. начиная с 1993 г.;
сократить до 50% от уровня 1986 г. начиная с 1998 г.;
2) производство галонов (бронированных галогеналканов для тушения пожаров) ограничить на уровне 1986 г.
В 1989 г. Совет министров Европейского сообщества объявил, что производство фреонов будет полностью прекращено к 2000 г. США сделали аналогичное заявление. Годом позже страны, подписавшие Монреальский протокол (их стало более 60), одобрили эту политику.
В 1990 г. Монреальский протокол был вновь пересмотрен. Страны, его подписавшие, взяли на себя следующие обязательства:
1) производство фреонов
сократить до 50% начиная с 1995 г.,
сократить до 15% начиная с 1997г.,
прекратить полностью к 2000г.;
2) производство тетрахлорметана (четыреххлористого углерода, используемого в качестве растворителя)
сократить до 15% начиная с 1995г.,
прекратить полностью к 2000г.;
3) производство галонов прекратить к 2000 г. (за исключением соединений, для которых не известны альтернативные заменители);
4) производство 1,1,1-трихлорэтана (используемого в качестве растворителя)
сократить до 70% начиная с 1995 г.,
сократить до 30% начиная с 1997 г.,
прекратить полностью к 2005 г.
Необходимо отметить, что Монреальский протокол, являющийся первым примером коллективного мирового сотрудничества в решении глобальных проблем, в настоящее время успешно выполняется.
Примеры решения задач
Пример 19. Оцените, во сколько раз скорость связывания атомарного кислорода в реакции синтеза озона выше, чем в реакции разрушения озона, когда эти процессы протекают при нормальном атмосферном давлении у поверхности Земли. Концентрация озона в приземном воздухе составляет 4 . 1011см-3. Константа скорости реакции образования озона kобр = 6,9 . 10–34см6 . с–1, если третье тело – молекулы кислорода. Константа скорости процесса разрушения озона при взаимодействии с атомарным кислородом kгиб = 8,4 . 10–15 см3 . с–1.
Решение. Процессы образования и гибели озона в реакциях связыва-ния атомарного кислорода можно представить следующими уравнениями:
O(3P) + O2 + M O3 + M* (1)
O(3P) + O3 O3 + 2O2 (2)
где О(3Р) – атомы кислорода в невозбужденном состоянии;
М – третье тело, участвующее в реакции образования озона.
Скорости процессов образования и гибели озона по реакциям (1) и (2) можно выразить уравнениями:
обр = kобр[O(3P)][O2][M]
гиб = kгиб[O(3P)][O3]
Отношение скоростей реакций образования и гибели озона можно определить как
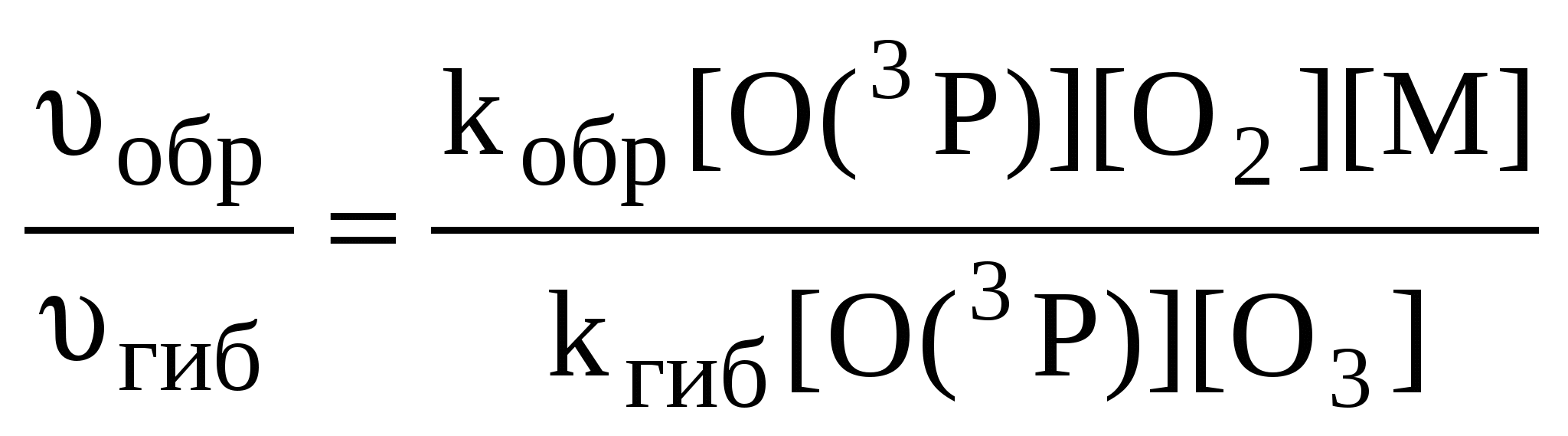
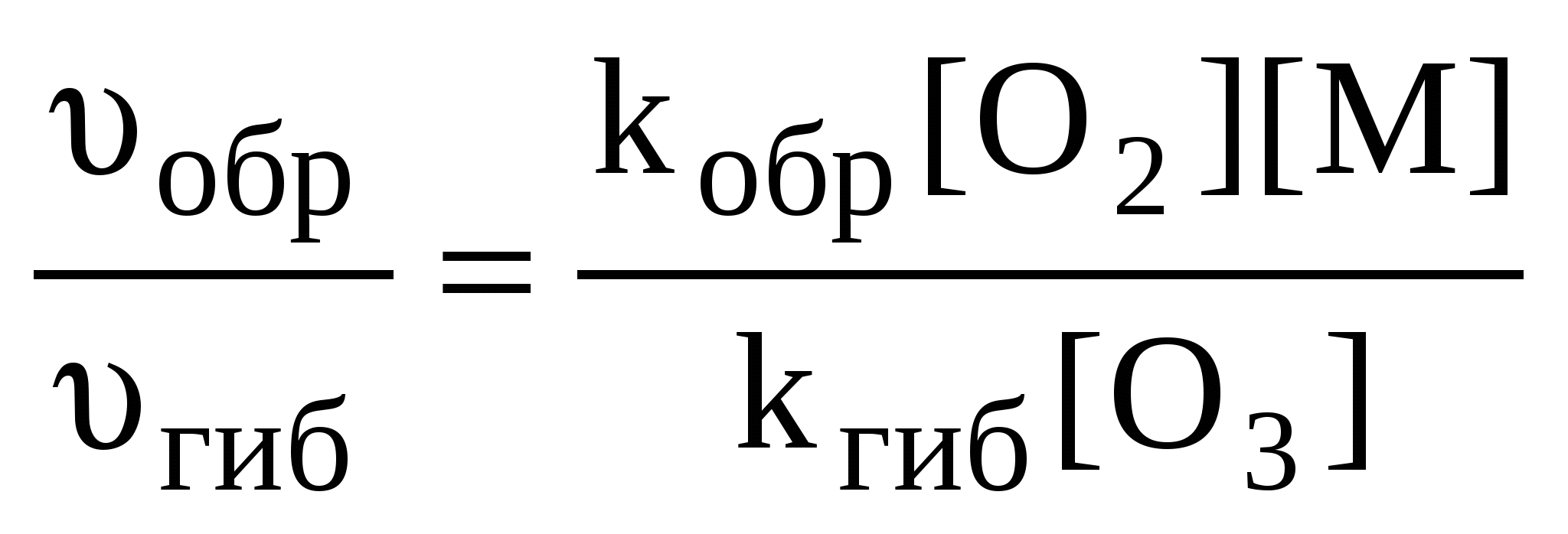
В случае, когда третье тело в процессе образования озона – молекулы кислорода ([О2] = [М]), отношение скоростей реакций (1) и (2) составит:
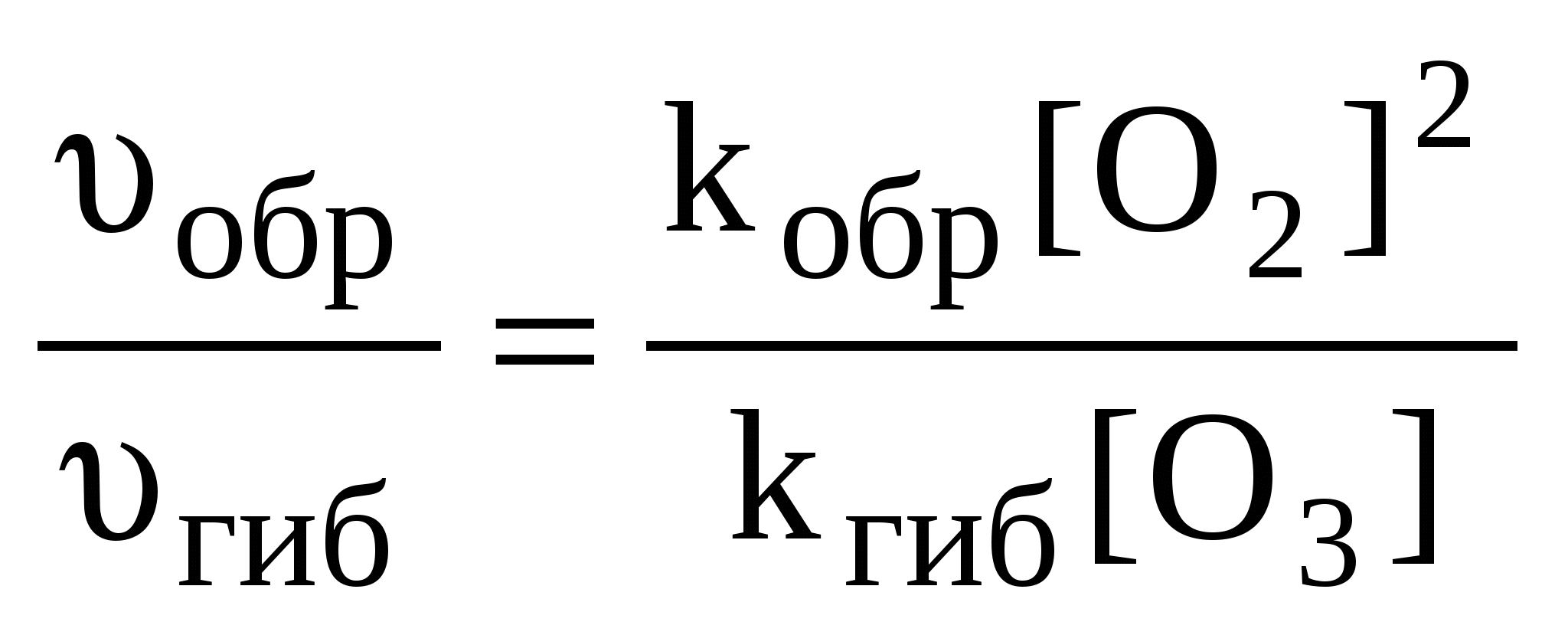
Таким образом, для решения задачи необходимо найти содержание молекул кислорода в кубическом сантиметре воздуха.
Среднее значение температуры приземного воздуха соответствует средней температуре нижней границы тропосферы и равно 15°С (таблица 2). При нормальном атмосферном давлении концентрация молекул кислорода составит (пример 18):
N = 6,02 . 1023 . 273 . 0,2095/(22,4 . 103 . 288) = 5,34 . 1018 (см –3).
Отношение скоростей реакций (1.1) и (1.2) составит:
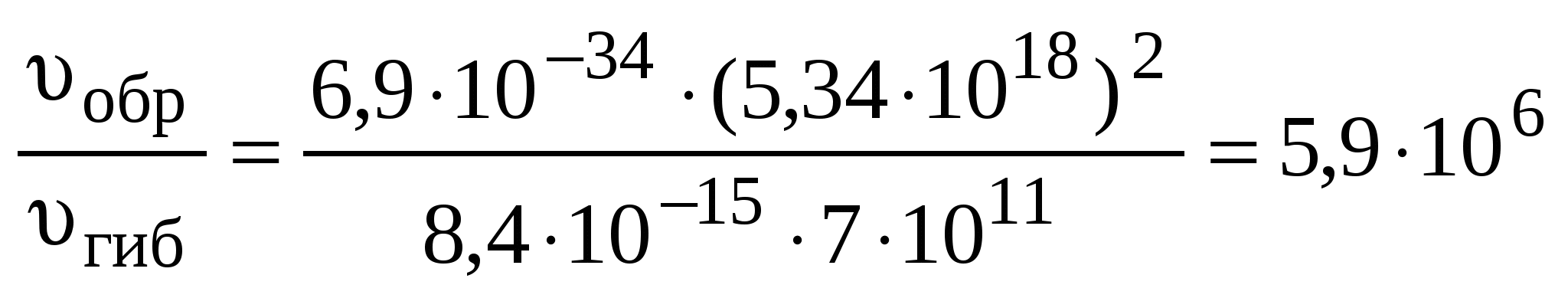
Ответ: скорость связывания атомарного кислорода в реакции образования озона в 5,9 . 106 раз больше, чем в реакции гибели озона.
Пример 20. Определите концентрацию атомарного кислорода в состоянии О(3Р) на высоте 20 км при условии динамического равновесия между процессами его образования (при фотолизе озона и диоксида азота) и стока (при образовании озона). Концентрации озона и диоксида азота составляют: [О3] = 1,5 . 1012см –3, [NО2] = 3 . 104 см –3. Коэффициенты фотодиссоциации озона и диоксида азота на высоте 20 км равны: J(O3) = 2,1 . 10–4 . c–1; J(NO2) = 4,4 . 10–3 . с–1. Константа скорости реакции образования озона в случае, когда третьим телом являются молекулы азота, определяется по уравнению:
k = 6,2 . 10–34(T/300)–2(см6 . с–1),
где Т – температура реакции.
Решение. Представим процесс образования атомарного кислорода в виде уравнений реакций:
O3 + hv O2 + O(3P) (1)
NO2 + hv NO + O(3P) (2)
Скорости процессов фотохимического разложения озона и диоксида азота можно выразить соотношениями:
1 = J(O3) . [O3] (3)
2 = J(NO2) . [NO2] (4)
Скорость образования атомарного кислорода в О(3Р) состоянии будет численно равна сумме скоростей процессов фотолиза О3 и NО2, поскольку по условию задачи другие источники поступления О(3Р) не принимаются во внимание и в процессе фотохимического разложения по реакциям (1) и (2) на каждую молекулу озона и диоксида азота образуется один атом кислорода. Поэтому можно записать:
обр = 1 + 2 (5)
Процесс стока атомарного кислорода по условию задачи связан только с образованием молекул озона:
О2 + О(3Р) + М O3 +M* (6)
Скорость этой реакции можно представить уравнением:
cт = k[O2][O(3Р)][М], (7)
где k – константа скорости реакции образования озона;
[М] – концентрация третьего тела, в рассматриваемом случае – концентрация азота на высоте 20 км.
В условиях динамического равновесия скорости процессов образования и стока атомарного кислорода численно равны:
обр = ст
1 + 2 = cт
J(O3) . [O3]+ J(NO2) . [NO2] = k[O2]O(3P)][M] (8)
Из полученного уравнения можно выразить концентрацию атомарного кислорода:
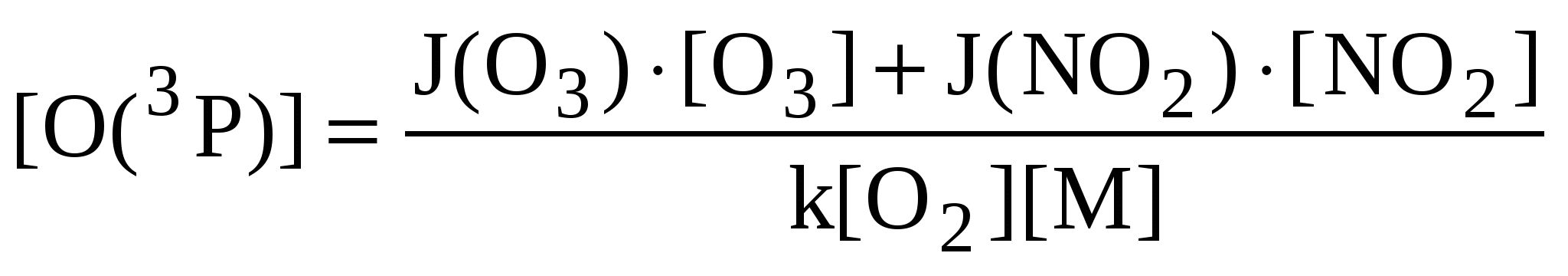 (9) (9)
Таким образом, для решения задачи следует определить значения концентраций всех компонентов и констант и выразить их в одинаковых единицах измерения.
Определим температуру на высоте 20 км. Ее значение необходимо для расчета концентраций азота и определения константы скорости реакции образования озона на данной высоте. Эта область находится в стратосфере (таблица 2), и температуру можно определить по уравнению:
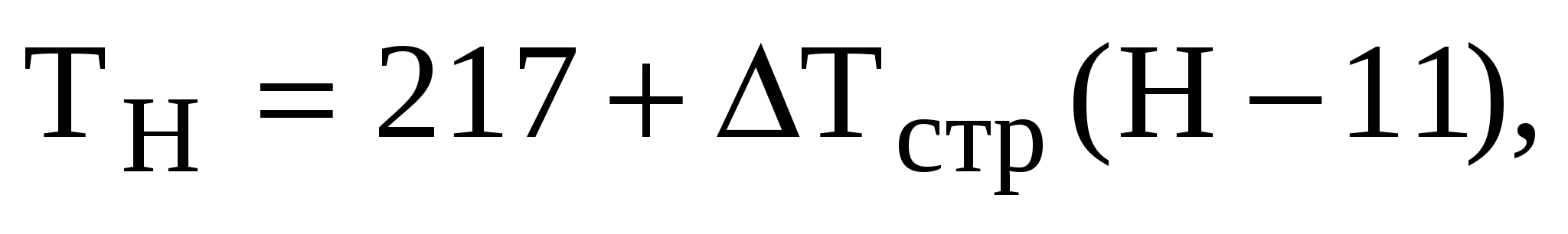
где 217 – температура нижней границы стратосферы, К;
H – высота в стратосфере, для которой определяется температура, км;
11 – высота нижней границы стратосферы, км;
Tстр – температурный градиент, в стратосфере он равен 1,38 К/км;
T20 = 217 + 1,38(20 – 11) = 229 (К)
Для определения количества молекул азота на высоте 20 км необходимо рассчитать количество молекул воздуха на данной высоте (пример 18):
nвозд = 2,55 . 1019 ехр[–29 . 10 –3 . 9,8 . 20000/ (8,31 . 229)] = 5,04 . 1017(см –3)
Поскольку в атмосферном воздухе соотношение основных компонентов до высоты 100км практически не меняется, концентрация молекул азота на высоте 20 км будет равна:
[N2] = 5,04 . 1017 . 78,08 . 10–2 = 3,94 . 1017 (см –3)
Концентрация молекулярного кислорода на высоте 20км составит:
[O2] =5,04 . 1017 . 20,95 . 10–2 = 1,06 . 1017(см –3)
Константа скорости реакции образования озона на высоте 20 км равна:
k = 6,2 . 10–34(T/300)–2 = 6,2 . 10–34229/300)–2 = 1,06 . 10–35 (см6 . с–1)
Концентрация атомарного кислорода составит:
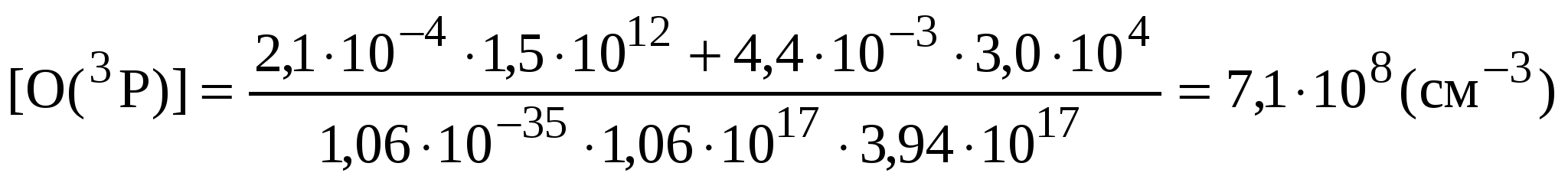
Ответ: концентрация атомарного кислорода составит 7,1 . 108 см –3.
Пример 21. Какой из фреонов – Ф-11 или Ф-152 – представляет большую опасность для озонового слоя планеты?
Решение.Для ответа на поставленный вопрос следует прежде всего представить молекулярные формулы хлорфторуглеводородов, отвечающие фреонам Ф-11 и Ф-152.
В соответствии с системой, разработанной специалистами фирмы «Дюпон» и получившей широкое распространение, при классификации фреонов цифрами обозначается разность между числом, в котором записанные подряд цифры означают количество атомов углерода, водорода и фтора в молекулярной формуле хлорфторуглеводорода. и некоторым «кодовым» числом, которое равно 90. Например, запись Ф-11 будет означать: 11 + 90 = 101, т.е. в состав соединения входят 1 атом углерода, О атомов водорода и 1 атом фтора. Поскольку углерод в органических соединениях всегда имеет валентность, равную 4, в состав молекулы фреона Ф-11 должно входить 3 атома хлора. Поэтому молекулярная формула Ф-11 отвечает соединению СFСl3.
В случае фреона Ф-152 имеем: 152 + 90 242, т.е. в состав фторхлоруглеводорода входят 2 атома углерода, 4 атома водорода и 2 атома фтора. Атомы углерода в хлорфторуглеводородах, если это не оговаривается особо, связаны между собой одинарной связью, поэтому в данном соединении может быть только 6 неуглеродных атомов. Все «вакантные» места заняты атомами водорода и фтора, поэтому в этом фреоне нет атомов хлора. Его молекулярная формула имеет вид С2Н4F2.
Поскольку фреон Ф-152 не содержит хлора, он не представляет опасности для озонового слоя. Однако в результате его трансформации в тропосфере возможно образование соединений, токсичных для биоты.
Ответ: фреон Ф-11, содержащий три атома хлора в каждой молекуле, представляет большую опасность для озонового слоя, чем фреон Ф-152, молекулы которого не содержат хлора.
Пример 22. Какой из фреонов – СF2Сl2 или СНF2Сl – более опасен для озонового слоя? Представьте кодовые формулы соответствующих фреонов.
Решение. Поскольку молекулы дифторхлорметана в отличие от молекул дифтордихлорметана содержат в своем составе атомы водорода, они будут менее устойчивы в тропосфере. Время их жизни в атмосфере значительно меньше, чем у молекул СF2Сl2.
Они будут разлагаться, не достигая озонового слоя. Поэтому большую опасность для озонового слоя представляют молекулы дифтордихлорметана.
Зная условия кодирования (пример 21), для дифтордихлорметана можно записать:
СF2С12 или СН0F2С12 - 102;
102 – 90 = 12, следовательно, это фреон Ф-12.
Для дифторхлорметана имеем:
СНF2С1 - 112;
112 – 90 = 22, следовательно, это фреон Ф-22.
Ответ: хлорфторуглеводороды СF2С12 и СНF2Сl – это фреоны Ф-12 и Ф-22 соответственно. Большую опасность для озонового слоя представляют молекулы дифтордихлорметана (Ф-12).
|
|
|
 Скачать 1.58 Mb.
Скачать 1.58 Mb.

 3 + O 2O2 (37)
3 + O 2O2 (37)