Газовые смеси метод В.Н.Диденко_. Газовые смеси
 Скачать 1.16 Mb. Скачать 1.16 Mb.
|
1.4.8. Плотность смеси газовПлотность однородного газа, заменяющего смесь, называется плотностью смеси: В справочниках обычно приводится без объяснений следующая формула для плотности смеси: В то же время в технической литературе встречаются формулы вида С вычислением плотности смеси через плотности компонентов связано наибольшее число студенческих ошибок. Дело в том, что значение плотности и Т. к. Проясним вопрос с вычислением плотности смеси. По определению Но Т. о. в последней формуле плотность i-го газа Такое толкование плотности компонентов смеси используется, в частности, при расчете объемов продуктов сгорания топлива. Если плотность i-го газа в смеси вычислять через его парциальное давление 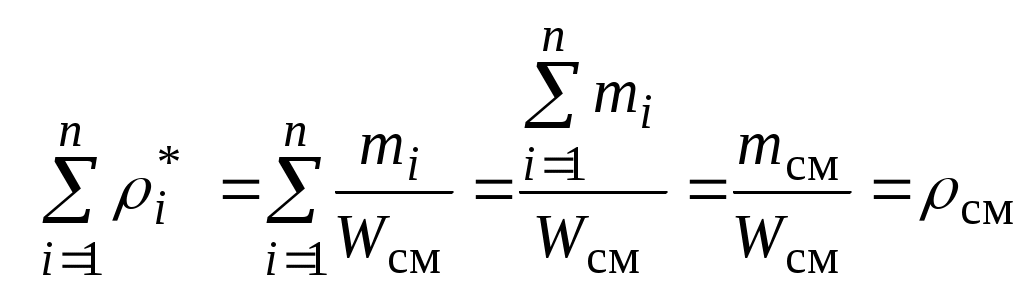 Т. о. в этой формуле плотность i-го газа Такое толкование плотности компонентов смеси, в частности, используется при определении абсолютной и относительной влажности воздуха. 1.4.9. Энтропия смеси идеальных газов Как указано в параграфе 1.4.1., энтропия 1 кг где: Из курса общей термодинамики известно: где: Окончательно удельная энтропия 1.4.10. Теплоемкость газовой смеси По определению, теплоемкость - это количество теплоты, которое необходимо для изменения температуры единицы количества вещества ( Т. к. температура всех газов в смеси одинакова, то теплоемкость смеси, складывается из теплоемкостей всех компонентов, взятых в долях, соответствующих способу задания смеси: где: 1.4.11. Коэффициент теплопроводности, коэффициент динамической вязкости газовой смеси. 1.4.11.1. Бинарные смеси В работе - Коэффициент теплопроводности смеси: λ см , Вт / (м · К): где: компонентов бинарной смеси, взятые при температуре смеси. 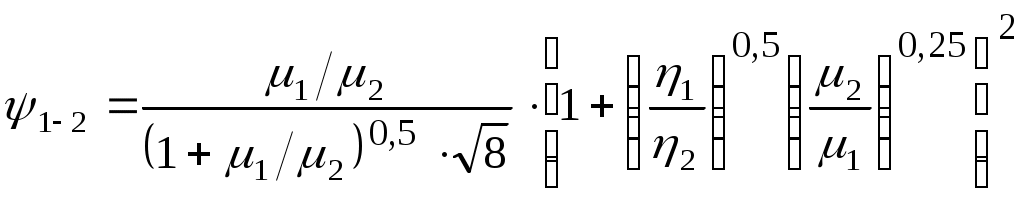 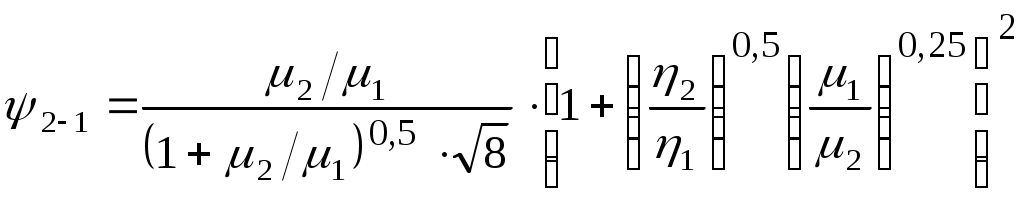 Здесь: Коэффициент динамической вязкости смеси ηсм, Па · С: Средняя погрешность вычисления Бинарные смеси являются наиболее исследованными. Опыт показывает следующее При малых различиях в значениях молекулярной массы компонентов величина коэффициента теплопроводности смеси подчиняется условию аддитивности: При большом различии молекулярных масс компонентов (смеси водорода) лучшее согласование с опытом дает логарифмическая зависимость или Во всех остальных случаях истинное значение 1.4.11.2. Многокомпонентные смеси Коэффициент динамической вязкости многокомпонентной смеси можно определить с использованием методов Гиршфельдера и его школы [3]. Эти методы дают хорошее согласование с опытом, особенно для коэффициента вязкости, но используют громоздкие и неудобные для практики формулы. В связи с этим получили распространение более простые аппроксимационные формулы, например, приближенная формула Уилке [4]: 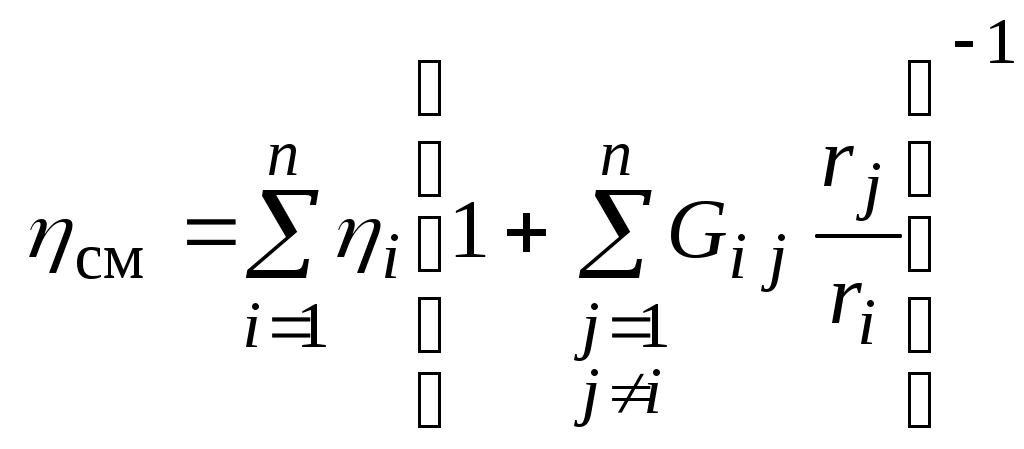 , ,где: 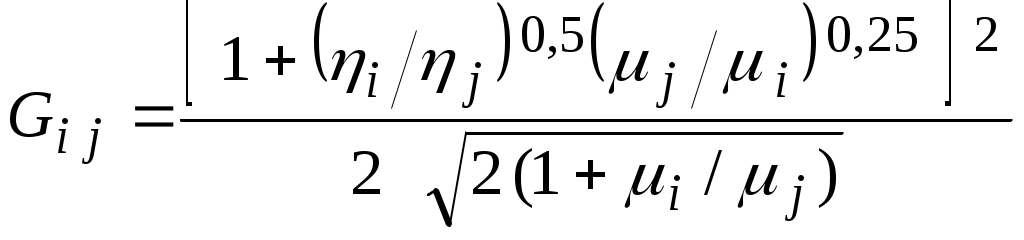 Погрешность результатов расчетов по формуле Уилке по сравнению с опытом находится в пределах 4%. Коэффициент теплопроводности В работе [5] для газовых смесей рекомендуется формула Брокау: где: 2. СМЕШЕНИЕ ГАЗОВ Пусть смешиваются nхимически невзаимодействующих между собой идеальных газов. Предполагается, что известны начальные термодинамические параметры состояния всех компонентов до смешения и условия смешения (условия взаимодействия с окружающей средой). Требуется найти равновесные параметры состояния газов после смешения. Рассмотрим два случая смешения, для простоты полагая, что этот процесс идет без теплообмена с окружающей средой. 2.1. Смешение при W=Const В этом случае условия смешения таковы, что объем образующейся смеси Wсм равен сумме начальных объемов компонентов смеси WHi: (Не следует путать WHi с парциальными объемами Wi, рассмотренными в параграфе 1.4.3.) Обозначим: РHi – начальное давление i-го газа; ТHi,tHi– начальная температура i-го газа соответственно в 0К или 0С. Т.к. вся система из n газов при смешении в условиях W=Constне совершает внешней работы, то в соответствии с первым началом термодинамики для этого случая ( Здесь: Uсм – внутренняя энергия смеси газов массой mсм килограммов с температурой Т0 К; UHi - внутренняя энергия i-го газа массой mi килограммов с начальной температурой ТHi . Введем обозначения: uсм – удельная внутренняя энергия смеси газов при температуре Т0 К; uHi– удельная внутренняя энергия i-го газа с начальной температурой ТHi. Тогда уравнение (2.1.1) принимает следующий вид: Как известно, для идеального газа du=CvdT , откуда при отсчете внутренней энергии от 00 К можно записать: Здесь: После подстановки (2.1.3) в (2.1.2) получим: Но в соответствии с параграфом 1.4.10 истинная массовая теплоемкость смеси газов выражается через массовые доли компонентов gi и их истинные теплоемкости следующим образом: Аналогично средняя в диапазоне 0 Подставляя это выражение в левую часть уравнения (2.1.4) получим: откуда 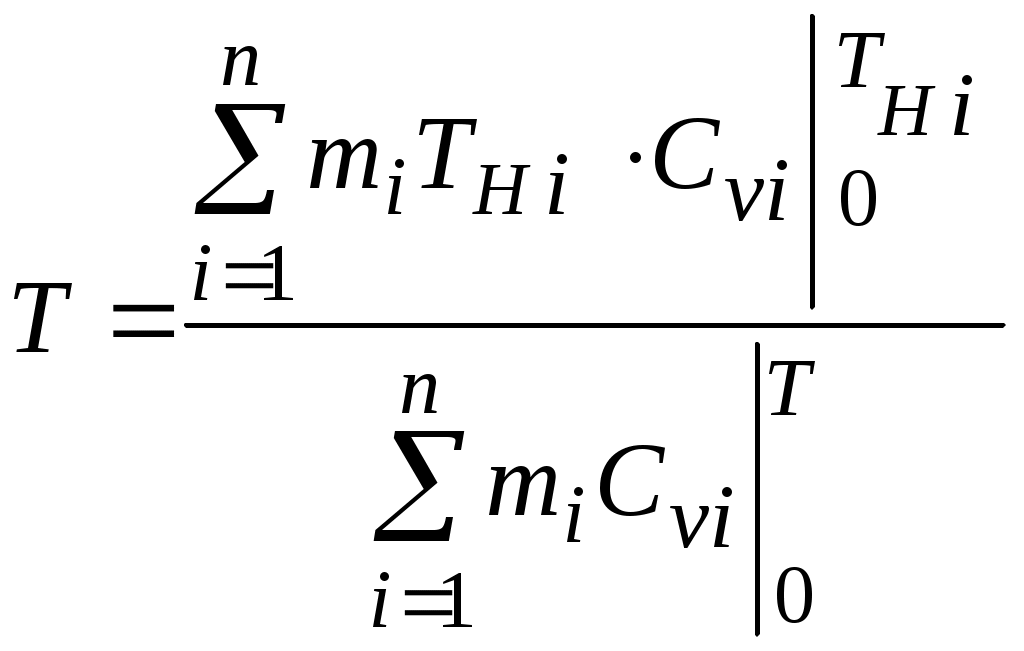 (2.1.5) (2.1.5)Т.к. из уравнения состояния 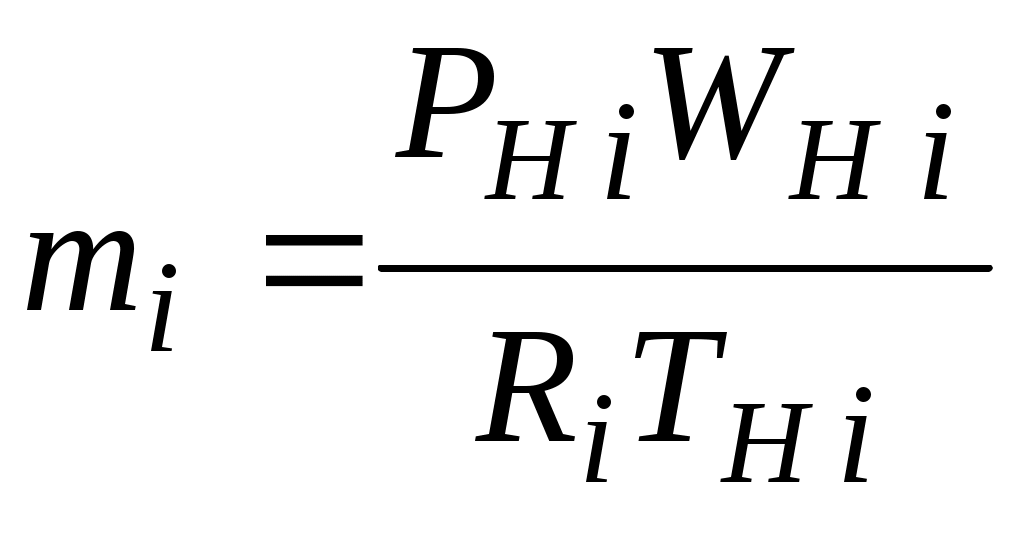 , то после подстановки mi в уравнение (2.1.5) окончательно получим формулу для температуры смеси n газов: , то после подстановки mi в уравнение (2.1.5) окончательно получим формулу для температуры смеси n газов: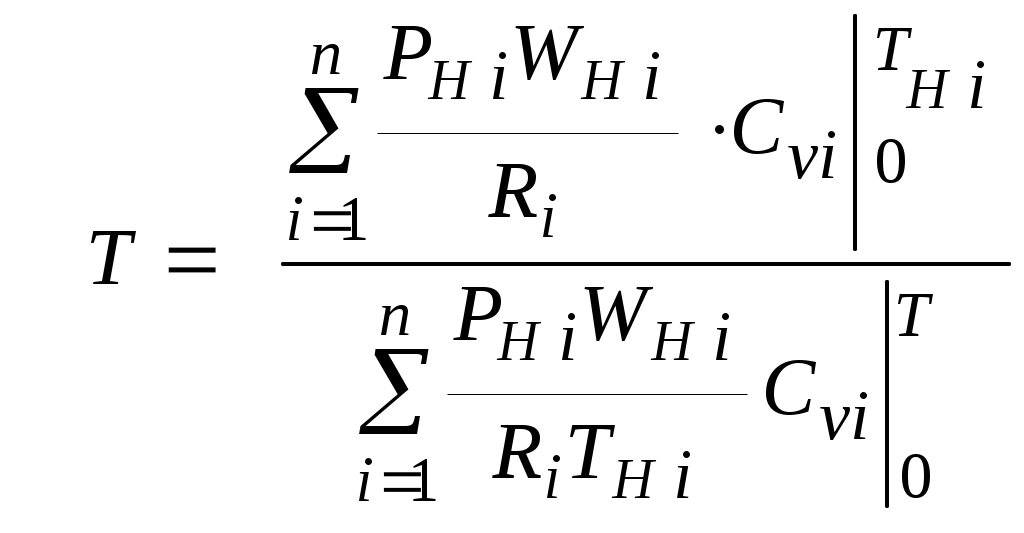 (2.1.6) (2.1.6)Как известно, 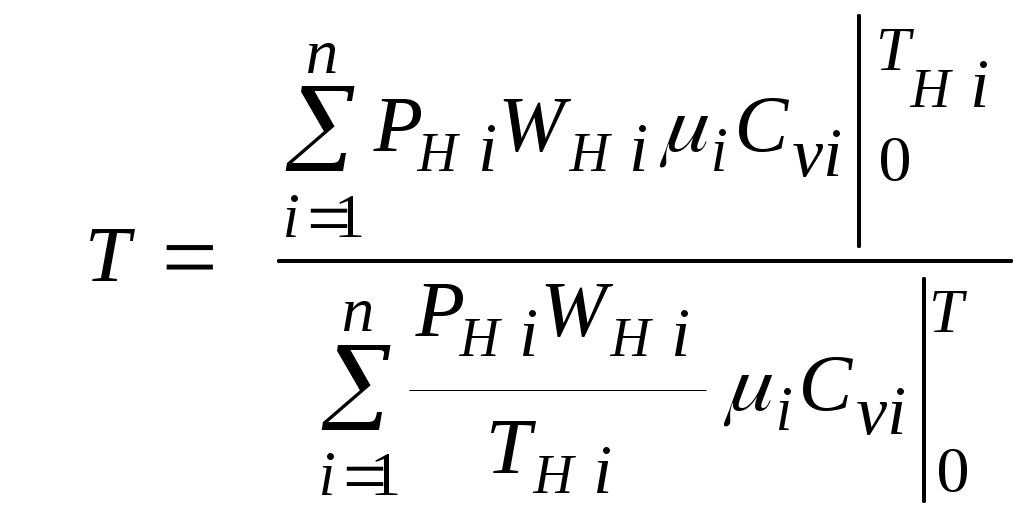 (2.1.7) (2.1.7)(Следует напомнить, что произведение 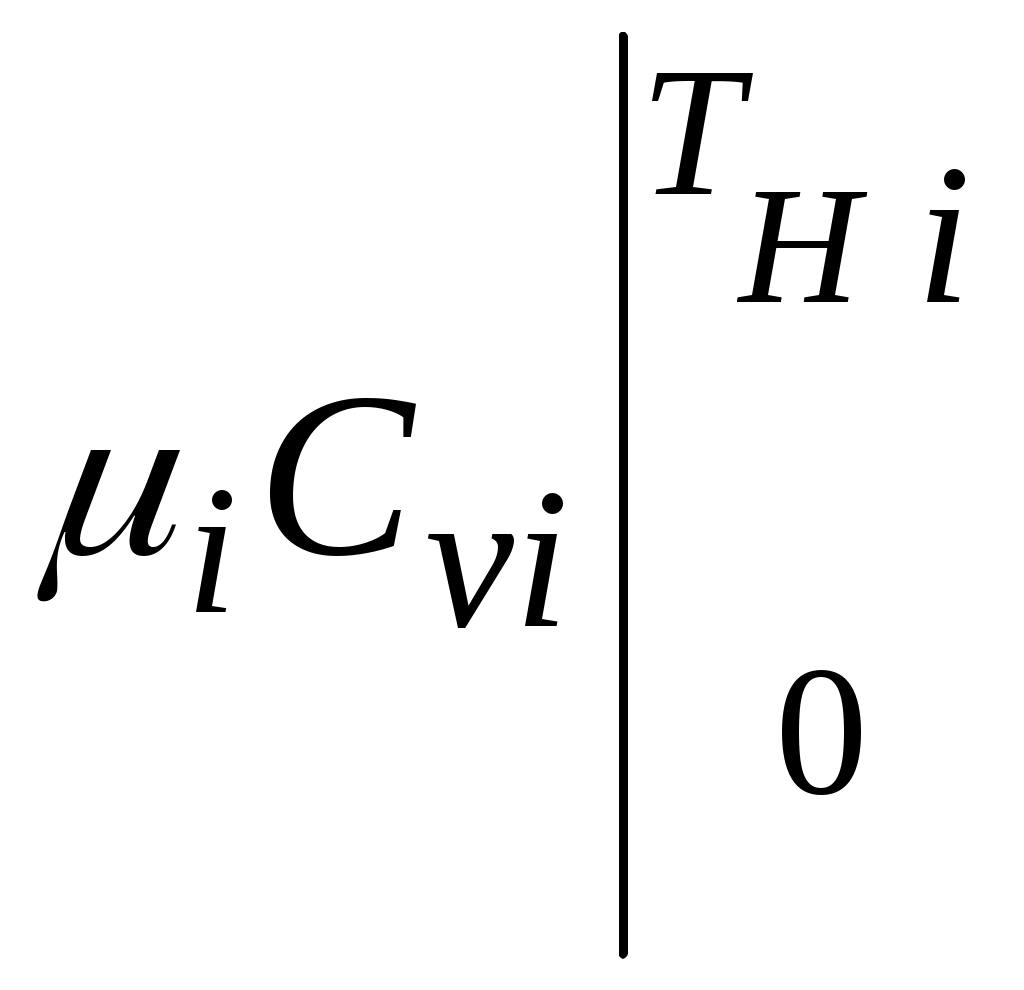 - это средняя в диапазоне 0- ТHi0К молярная изохорная теплоемкость i-го газа.) - это средняя в диапазоне 0- ТHi0К молярная изохорная теплоемкость i-го газа.)В справочной литературе эмпирические зависимости теплоемкости от температуры часто даются для диапазона 0 Тогда: где После подстановки (2.1.8) и (2.1.9) в уравнение (2.1.2) получим: откуда 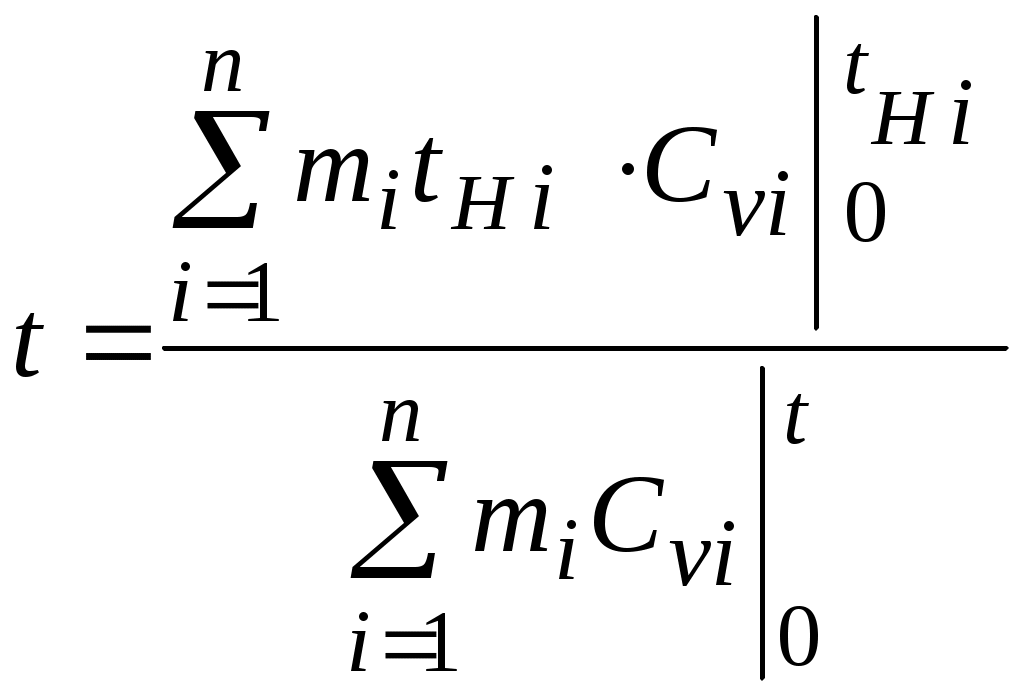 . .Заменяя mi его значением 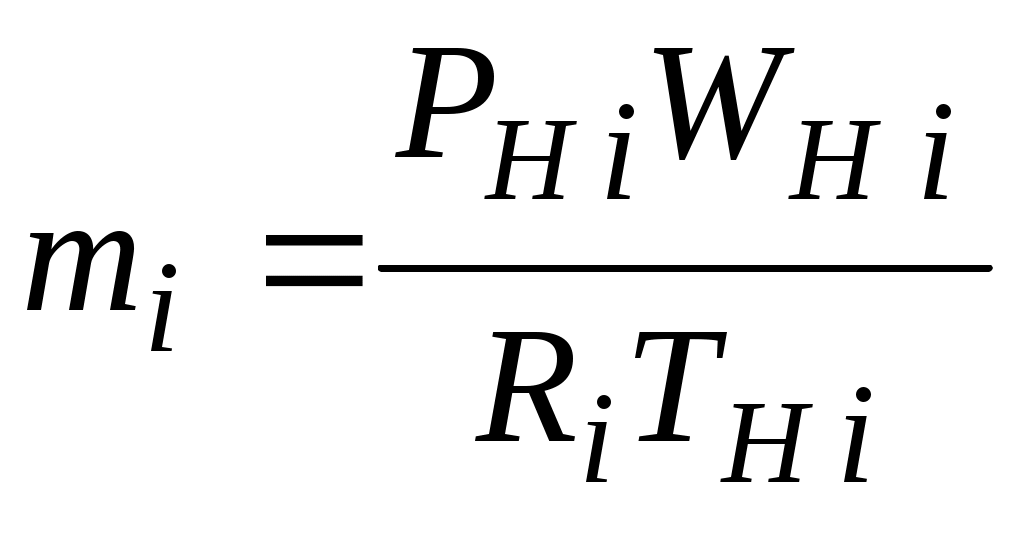 , окончательно получим формулу для температуры смеси газов в градусах Цельсия: , окончательно получим формулу для температуры смеси газов в градусах Цельсия: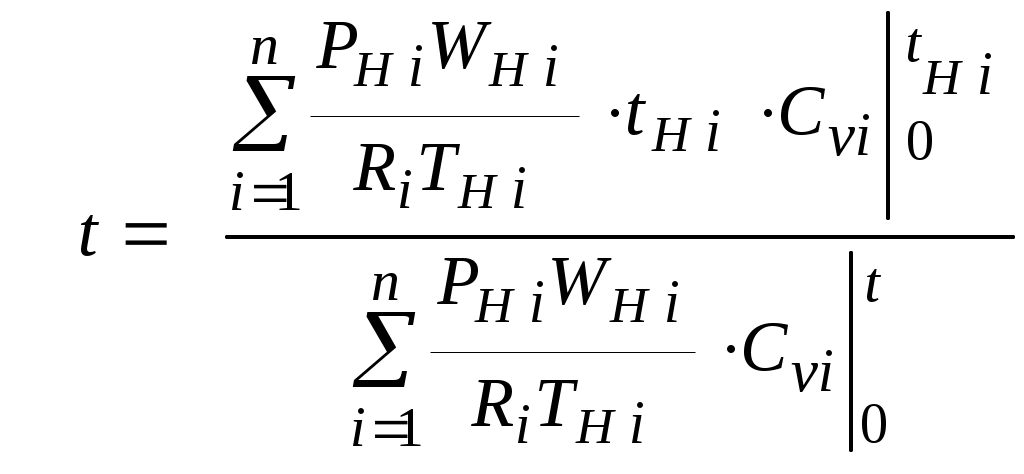 (2.1.10) (2.1.10)Выражая Ri через малекулярную массу 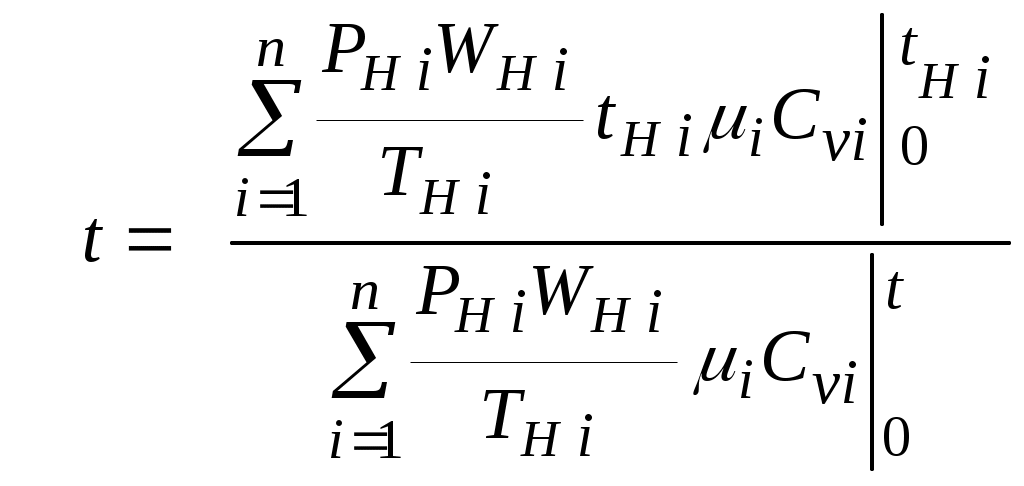 (2.1.11) (2.1.11)В знаменателях формул (2.1.6), (2.1.7), (2.1.10) и (2.1.11) содержатся средние теплоемкости, у которых в качестве верхнего предела осреднения используется температура смеси (t или Т), подлежащая определению. В силу этого, температура смеси по этим формулам определяется методом последовательных приближений. |
