Гибридома реферат. Гібридомна технологія та її використання в молекулярній біології
 Скачать 59.06 Kb. Скачать 59.06 Kb.
|
|
Реферат з курсу «Лабораторний практикум» на тему: Гібридомна технологія та її використання в молекулярній біології ЗМІСТ Антитіла, що застосовуються в тест-системах 3 Отримання моноклональних антитіл 3 Досягнення фармацевтики: моноклональні антитіла 6 Перший крок – імунізація антитілами тварин 6 Другий крок – розшифровка структури моноклональних антитіл 7 Третій крок – розробка першої технології синтезу антитіл 8 Четвертий крок – застосування штучно синтезованих антитіл для лікування захворювань 9 П’ятий крок – створення химерних антитіл 10 Шостий крок – створення гуманізованих та людських моноклональних антитіл 11 Розробка нових моноклональних антитіл сьогодні 14 Антитіла, що застосовуються в імунохімічних тест-системах 1. Моноклональні антитіла - отримані від однієї клітинної лінії (клона), синтезуються клітинами гібридоми. Такі антитіла при взаємодії зі специфічним антигеном мають однакову специфічність і зв'язувальною здатністю. 2. Поліклональні антитіла - суміш антитіл, отриманих від різних клітинних ліній. Отримують з сироватки імунізованих тварин. Антитіла в такій суміші можуть відрізнятися за зв'язувальною здатністю. Отримання моноклональних антитіл Як утворюються антитіла? Імунна відповідь - складний процес міжклітинних взаємодій різних типів лімфоїдних клітин за участю спеціальних гормонів, в результаті чого В-лімфоцити починають активно синтезувати і виділяти в кров специфічні антитіла проти даного антигену. На поверхні В-лімфоцитів існують рецептори, аналогічні антитілам, взаємодія яких з антигеном в складному міжклітинному комплексі служить стимулом для початку біосинтезу антитіл. Отримання антитіл для потреб людини починається з імунізації тварин. Після декількох ін'єкцій антигену, в присутності стимуляторів імунної відповіді, в сироватці крові накопичуються специфічні антитіла. Антитіла виділяють із сироватки у вигляді G-глобулінової фракції, осаджуючи сироватку крові сульфатом амонію, спиртом, ПЕГ і іншими речовинами. Отримані антитіла містять багато домішкових білків. Високоочищені антитіла виділяють за допомогою іонообмінної хроматографії. Стандартні препарати отримати досить складно, так як склад їх залежить від виду тварини, його індивідуальних особливостей, циклу імунізації, інших мало контрольованих факторів. У той же час, для сучасного біохімічного аналізу дуже важлива специфічність, тобто здатність виділити дану речовину в складних багатокомпонентних середовищах, таких як сироватка крові, сік рослин, ферментне середовище. Таке можливо при використанні імунохімічного методу, що використовує антитіла, які взаємодіють вузько специфічно за принципом "антиген - антитіло". Для проведення такого аналізу необхідні абсолютно ідентичні антитіла. Рішення проблеми було запропоновано в 1975 році англійськими вченими Георгом Келером і Цезарем Мільштейном. Вони розробили методику отримання клітинних гібридів - гібридом. Гібридоми утворюються в результаті злиття лімфоцитів, узятих від імунізованих тварин, з клітинами мієломи кісткового мозку, культивованими in vitro. Слід зазначити альтруїзм творців гібридомної технології. В інтересах розвитку науки Г. Келер і Ц. Мільштейн відмовилися від патентування свого методу, більш того надали клітинну лінію плазмоцитоми для дослідження в усі провідні дослідницькі лабораторії в світі. Для отримання антитілопродукуючих клітин (АПК) тварин (мишей чи пацюків) активно імунізували певним антигеном. Коли продукція антитіл досягала високого рівня, з селезінки і лімфовузлів тварин (місць скупчення АПК) готували суспензію клітин. Потім викликали злиття АПК з клітинами мієломи, застосовуючи для цієї мети поліетиленгліколь (ПЕГ) - поліелектроліт, що сприяє злиттю клітинних мембран. Гібридома зберігала здатність до клітинного ділення, в процесі якого хромосоми обох ядер перемішувалися і утворювали одну спільну ядро, що містить гени імуноглобулінів обох клітин - попередників. Для того щоб відокремити дану гібридому від присутніх в системі окремих незлитих клітин і від гібридів іншого складу або іншої специфічності, автори розробили спеціальну схему, яка використовує відбір клітин в селективному ГАТ-середовищі, що містить гіпоксантин, аміноптерин і тимидин. Аміноптерин є високотоксичним агентом, що блокує синтез пуринових основ, необхідних для подальшого синтезу нуклеїнових кислот. Це призводить до загибелі пухлинних клітин, що мають метаболічний дефект, який не дозволяє використовувати резервний шлях синтезу пуринових основ. АПК здатні рости в ГАТ-середовищі, але, не будучи імморталізованими, гинуть природним шляхом через 1 - 2 тижні. Гібридоми ж зберігають життєздатність, оскільки поєднують властивості «безсмертної» пухлинної клітини і АПК, що використовують обхідний метаболічний шлях синтезу пуринів. Ті гібриди, що вижили в ГАТ-середовищі розсіюють в пластикові планшети на 96 лунок ємністю 0,2 см3 (в кожну по 10 гібридом), через кілька днів вміст лунок перевіряють на наявність антитіл потрібної специфічності. Клітини з лунок, що містять такі антитіла, клонують, розсіюючи по 1 клітці в лунку. Ця клітина-попередник дає початок формуванню «безсмертного» клону, який продукує моноклональні антитіла. Процедура повторюється до 2 разів. Отримані клони гібридомних клітин можна зберігати тривалий час при -70 ° С, як завгодно довго культивувати на поживних середовищах, накопичуючи антитіла. Інший метод отримання антитіл заснований на ін'єкції отриманої гібридоми в черевну порожнину мишки. Там гібридома реплікується і викликає утворення асцитної пухлини (скупчення клітин, які плавають у рідині, що заповнює черевну порожнину). Асцитна рідина, виділена з цієї миші, представляє суспензію, яка містить антитіла. Клітини і білки, що не належать до МКА, видаляються. Решту матеріалу, представлену переважно антитілами, використовують. Цей метод дозволяє отримувати висококонцентровані препарати антитіл. Але масове виробництво вимагає одночасного використання декількох тисяч мишей. Крім того, одержуваний матеріал вимагає доочистки. Це дорого і складно, тому в даний час перевага віддається першому способу, з використанням культури клітин. В даний час гібридомна технологія лежить в основі отримання абзимів, про що говорилося вище. Моноклональні антитіла в силу своєї високої специфічності, стандартності і технологічності широко застосовуються як діагностикуми для визначення широкого спектру біологічно активних речовин: білків, гормонів, медіаторів запалення, бактеріальних і вірусних антигенів, різних отрут. Моноклональні антитіла широко використовуються в онкології, з їх допомогою доставляються радіоактивні мітки в пухлини і їх метастази, що дозволяє по локалізації радіоактивності виявити навіть невеликі скупчення пухлинних клітин. Зараз у всьому світі активно ведуться дослідження по застосуванню моноклональних антитіл як переносників токсичних речовин в місця локалізації пухлин. Досягнення фармацевтики: моноклональні антитіла Перший крок - імунізація антитілами тварин (XIX ст. - початок XX в.) Вчених з давніх пір цікавило питання про те, яким чином організм створює безліч різних антитіл, що володіють унікальною специфічністю щодо чужорідних речовин (антигенів), і яким чином ці антитіла працюють. Один з перших кроків до відповіді на це питання був зроблений групою вчених, які працювали в Інституті інфекційних хвороб в Берліні і відкрили методи лікування дифтерії. В кінці XIX століття дифтерія у дітей вважалася смертельним невиліковним захворюванням. Лікар імунолог-бактеріолог Еміль Берінг (Emil Behring) припустив, що лікування дифтерії може бути успішним в разі прояву природної захисної реакції людського організму, а саме, якщо секретований дифтерійними бактеріями токсин нейтралізувати. У 1890 р Берінг спільно з японським вченим Сібасабуро Кітасато встановили, що неімунізовані тварини можуть бути захищені від токсину дифтерійних бактерій за допомогою ін'єкції антитоксина (антитоксичної сироватки) імунізованих тварин. У 1894 р в період епідемії дифтерії, що забрала життя 50 000 дітей в Німеччині, були зроблені перші 25 000 доз антитоксина для застосування в лікуванні людей. У 1901 р Емілю Берингу була присуджена Нобелівська премія за роботу по сироваткової терапії. Однак на той момент ефективність сироватки була досить низькою, оскільки антитіла в сироватці вироблялися клітинами тварин, а не самого пацієнта і викликали лише пасивний імунітет. Антитоксин необхідно було вводити відразу після інфікування, інакше було занадто пізно. Ще одним прикладом використання антисироватки в терапії людей стали дослідження Чарльза Річета (Charles Richet) і Жюля Ерікур (Jules Héricourt), які застосовували для лікування онкологічних захворювань антисироватки, отриману шляхом імунізації тварин тканинами саркоми. З середини 30-х років практика пасивної імунізації зійшла нанівець у зв'язку з відкриттям антибіотиків широкого спектру дії. Другий крок - розшифровка структури моноклональних антитіл (30-70-і рр. XX ст.) 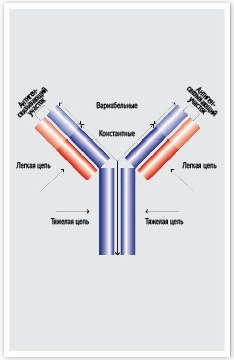 Рис 1. Структура антитіла, за яку вчені Родні Портер і Джеральд Едельман в 1972 р отримали Нобелівську премію з фізіології і медицині У 30-х рр. з'явилися ультрацентрифуги, що дозволяли розділяти антитіла за розміром і формою. У 40-х рр. вчені навчилися сортувати антитіла по електричному заряду і розміру. Однак подальша розшифровка структури антитіла була поки недоступна через їх великий розмір, що в 20 разів перевищував розмір молекул білків, структури яких на той час вже були розшифровані. Тільки в 1962 р на базі численних досліджень, що проводилися різними вченими, Родні Портер (Rodney Porter) розшифрував основну структуру антитіл, стало відомо, що антитіло складається з легкого і важкого ланцюгів. Пізніше Родні Портеру спільно з Джеральдом Едельманом (Gerald Edelman) вдалося визначити послідовність 1300 амінокислот, що входять в білкову ланцюг антитіла, виробленого клітинами ракової пухлини мієломи. У той час це була найбільша розшифровка амінокислотної послідовності, за що в 1972 році вчені отримали Нобелівську премію. В результаті досліджень Портера і Едельмана стало відомо, що антитіло має форму літери Y, в якій нижня частина (важкий ланцюг) має постійну структуру для різних антитіл, а плечі (легкі ланцюги) значно різняться у різних антитіл. Саме ці плечі відповідають за зв'язування антитіла з антигеном і його нейтралізацію. Третій крок - розробка першої технології синтезу антитіл (70-80-і рр. XX ст.) До 1970-х років уже були відомі деякі важливі моменти про те, яким чином в організмі людини виробляються антитіла. Зокрема, було відомо, що за продукування антитіл відповідають В-лімфоцити, причому кожен В-лімфоцит може виробляти тільки одне специфічне антитіло, при цьому він редуплікується і за рахунок цього швидко виробляє велику кількість ідентичних за структурою антитіл - так званих моноклональних, тобто що відбулися від однієї клітини-попередниці. Домогтися такого ж швидкого вироблення антитіл в лабораторних умовах вдалося в 1975 році вченим Георгу Кьолеру (Georges Köhler) і Сезар Мільштейн (César Milstein). На той момент була досліджена здатність клітин ракової пухлини мієломи швидко виробляти ідентичні самим собі клітини. Крім того, існувала можливість виділення антитілопродукуючих клітин з організму тварин. Технологія Келера і Мільштейна включала кілька етапів: у миші вироблявся імунітет до відомого антигену, потім з її селезінки виділялися антитілопродукуючі клітини, ці клітини за допомогою особливої технології з'єднувалися з клітинами мієломи з отриманням гібридоми, клітини якої безперервно у великій кількості синтезували антитіла проти відомого антигену. Ця методика зробила переворот у вивченні антитіл, оскільки дозволила отримувати антитіла з точною відповідністю певній структурі. Надалі технологія була вдосконалена, і в 1984 році Келер, Мільштейн і данський імунолог Нільс Ерне (Niels Jerne) отримали Нобелівську премію за участь в створенні антитіл, які можна використовувати для діагностичних досліджень і створення лікарських засобів. Надалі було розроблено безліч технологій, що дозволили вдосконалити синтез антитіл за рахунок розвитку технологій рекомбінації ДНК, технологій клонування клітин і інших досягнень генної інженерії. Четвертий крок - застосування штучно синтезованих антитіл для лікування захворювань (80-і рр. XX ст.) При перших спробах застосування для лікування людей антитіл, штучно синтезованих з клітин тварин, вчені зіткнулися з труднощами. У 1979 р вперше в світі вчені Філіп Сташенко (Philip Stashenko) і Лі Надлер (Lee Nadler) застосували штучно синтезовані моноклональні антитіла, отримані з клітин мишей, проти антигенів, які виробляються на поверхні клітин ракових пухлин. Однак було виявлено, що мишачі антитіла в незначній мірі зв'язувалися з пухлинними антигенами і сприймалися організмом як чужорідні клітини. З 1986 р на фармацевтичному ринку почалася реалізація препарату компанії Janssen «Ортоклон ОКТ3» (муромонаб), який дозволяє купірувати реакцію відторгнення трансплантата нирки, надаючи вибіркову іммунопригнучуючу дію. Препарат має повністю мишаче походження, тобто синтезується мишачими гібридомами, отриманими злиттям мишачої мієломи і мишачих В-лімфоцитів. Незабаром після виходу препарату на ринок стало ясно, що при тривалому застосуванні мишачих моноклональних антитіл в якості лікарських засобів їх ефективність знижувалася. Це пов'язано з тим, що мишачі білки є імуногенними для організму людини, тобто сприймаються як чужорідні об'єкти. У зв'язку з цим у пацієнтів, яким вводять мишачі антитіла, швидко утворюються людські антимишачі антитіла (human antimurine antibody - HAMA). Утворені HAMA-антитіла нейтралізують ефект мишачих антитіл. П'ятий крок - створення химерних антитіл (90-і рр. XX ст.) На початку 90-х рр. з використанням молекулярно-біологічних методів, заснованих на застосуванні рекомбінантних ДНК, були створені химерні антитіла. В химерних антитілах частина «мишачої» молекули за допомогою методів генної інженерії замінювалося на ділянку людського походження, а частина залишалася фрагментом мишачого походження. Оскільки білкова послідовність химерних антитіл на 75% складалася з «людських» послідовностей амінокислот, то у пацієнтів, які отримували химерні антитіла, HAMA-антитіла утворювалися в значно меншій кількості, і це зробило препарати на основі химерних антитіл значно ефективнішими, ніж на основі мишачих. Надалі був випущений цілий ряд лікарських засобів на основі химерних антитіл: ритуксимаб, що випускається під брендами «Мабтера» і «Рітуксан», - для лікування ракових пухлин, «Ремикейд» (інфліксімаб) - для лікування хвороби Крона, «Симулект» (Базіліксімаб) - для профілактики гострого відторгнення трансплантата нирки, «Реопро» (абциксимаб) - для профілактики стенокардії та гострого інфаркту міокарда, а також інші препарати. Розробка химерних антитіл дозволила практично повністю відмовитися від використання мишачих антитіл. Однак в деяких випадках використання мишачих антитіл і сьогодні залишається виправданим. З схвалених до застосування лікарських засобів сьогодні лише три є мишачими: «Ортоклон-ОКТ3» (муромонаб-CD3), «Зевалін» (ібрітумомаб тіуксетан) і «Бексар» (тозітумомаб-йод 131). Два останніх є радіоактивно міченими мишачими МАТ. Їх функція полягає в доставці радіоізотопів до клітин лімфоми. Наявність радіоактивності дозволяє застосовувати ці антитіла в дуже невеликих кількостях, тому імуногенність, обумовлена мишачими послідовностями, в цьому випадку не так значима. Те, що ці препарати містять саме мишачі, а не гуманізовані або людські форми робить їх більш ефективними, тому що гуманізувані форми могли б зв'язуватися одночасно не тільки з клітинами-мішенями, але і зі здоровими клітинами, завдаючи їм шкоди. Також до застосування сьогодні схвалений один препарат на основі щурачо-мишачих МАТ - це препарат «Ремоваб» (катумаксомаб) для лікування злоякісного асциту. Шостий крок - створення гуманізованих і людських моноклональних антитіл (кінець 90-х рр. XX ст. - 2000-і рр. XXI ст.) В кінці 90-х рр. за допомогою методів генної інженерії вдалося звести до мінімуму відсоток мишачих послідовностей амінокислот в штучно синтезованих антитіл, завдяки чому були отримані гуманізовані антитіла, ще меншою мірою викликають утворення HAMA-антитіл у людини. Починаючи з кінця 90-х рр., на ринок було випущено безліч препаратів на основі гуманізованих антитіл. Наприклад: «Зенапакс» (Даклізумаб) - для профілактики відторгнення після трансплантації нирки, «Герцептин» (трастузумаб) - для лікування раку молочної залози і раку шлунка, «Ксолар» (омалізумаб) - для лікування атопічної бронхіальної астми та сезонного алергічного риніту, « Раптива »(ефалізумаб) - для лікування псоріазу, а також багато інших. У 2000-х роках вдосконалені методи генної інженерії нарешті дозволили домогтися довгоочікуваного результату і отримати людські МАТ. В даний час людські МАТ найчастіше отримують за допомогою технології трансгенних мишей (мишей, виведених з використанням фрагментів чужорідної ДНК) або фагового дисплея (особливий метод генної інженерії з використанням вірусів-бактеріофагів). Наприклад, сьогодні для клінічного застосування схвалені такі препарати, створені на основі людських МАТ, як «Бенліста» (белімумаб) - для лікування червоного вовчака, «Ервой» (іпілімумаб) - для лікування меланоми, «Сімпоні» (голімумаб) - для лікування ревматоїдного артриту, псоріатичного артриту, хвороби Бехтерева, а також інші препарати. Ще один тип речовин, створених методами генної інженерії для лікування пацієнтів, - це так звані «білки злиття», в яких штучно з'єднані два окремих білка, часто з різними функціями. Наприклад, на основі такої речовини створений препарат «Амевів» (алефацепт) моноклональні антитіла при псоріазі, орфанний препарат «Аркаліст» (рілонацепт) - для лікування рідкісних генетичних аутозапальних захворювань. Розробка нових моноклональних антитіл сьогодні Розробка лікарського засобу з використанням моноклональних антитіл - це дуже тривалий і дорогий процес. Наприклад, перший препарат на основі мишачих антитіл «Ортоклон OKT3» був зареєстрований в 1986 р, тільки через 11 років після того, як мишачі антитіла були вперше описані. Перший препарат на основі химерного МАТ «Реопро» був схвалений в 1994 р, через 10 років після перших робіт по вивченню химерних МАТ. Перший препарат на основі гуманізовані МАТ «Зенапакс» був затверджений в 1997 році, через 11 років після першої доповіді про конструкції гена гуманізовані антитіла. Препарат «Енбрел» на основі злитих білків був схвалений в 1998 р, через 10 років після опису «білків злиття». Препарат «Хуміра» на основі людських МАТ був схвалений в 2002 році, через 12 років після першої статті про подібні МАТ. Перед сучасними вченими, що досліджують моноклональні антитіла, стоїть безліч актуальних завдань. Зокрема, пошук вирішення проблеми імуногенності препаратів, виготовлених на основі МАТ. Більшість препаратів на основі МАТ, які сьогодні проходять стадію клінічних досліджень, включають до складу людські антитіла. Використання цього типу антитіл знизило імуногенність препаратів, проте не усунуло проблему повністю, оскільки імунна система людини здатна виробляти антитіла проти будь-якого терапевтичного білка. Ще одна проблема, пов'язана із застосуванням препаратів на основі моноклональних антитіл, обумовлена тим, що МАТ являють собою великі молекули, які не здатні проникати всередину клітини або глибоко в тканини. Сьогодні МАТ можна застосовувати всередину, так як їх концентрація для досягнення ефекту повинна в кілька тисяч разів перевищувати концентрацію молекул-мішеней. У зв'язку з цими особливостями, сьогодні вчені стурбовані створенням нового покоління лікарських засобів, які об'єднають в собі переваги МАТ і дрібномолекулярних препаратів. На цьому шляху зроблено вже кілька важливих наукових відкриттів. Перше з них - створення шведською компанією Affibody особливих «аффітіл», які мають властивості звичайних антитіл, але мають в десятки разів меншу молекулярну масу, що дозволяє їм краще проникати в тканини. Ще одне досягнення науки - розробка «нанотіл» бельгійською компанією Ablynx. Ці препарати характеризуються високою стабільністю, що дозволяє використовувати їх всередину і місцево. Крім того, вони прості у виробництві. Зараз на стадії клінічних досліджень у пацієнтів з тромбозами і остеопорозом знаходяться чотири «нанотіла». Нарешті, ще один надсучасний напрямок - розробка доменових антитіл американською компанією Domantis. Ці антитіла повинні відповідати різним відділам важкого і легкого ланцюга антитіл людини і бути в десять разів менше, ніж звичайні антитіла, що дозволить застосовувати їх всередину і інгаляційно. Поки що тривалість і висока вартість виробництва лікарських засобів з використанням моноклональних антитіл робить їх не завжди доступними для пацієнтів. Однак вчені працюють над створенням нових технологій, які дозволять випускати нові препарати швидше і за нижчою вартістю. Завдяки сучасним технологіям, вже сьогодні багато препаратів стали доступними для великої кількості пацієнтів і дозволили вилікувати захворювання, які раніше вважалися невиліковними. Можна сподіватися, що в майбутньому спектр виліковних захворювань ще більш розшириться, а лікарські засоби на основі моноклональних антитіл стануть ще більш ефективними. СПИСОК ДЖЕРЕЛ
|
