бх. Глюконеогенез. Сахар крови и его регуляция
 Скачать 4.04 Mb. Скачать 4.04 Mb.
|
Синтез глюкозы энергетически дорогГлюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот. Все аминокислоты, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Углеродные атомы некоторых из них (глюкогенных) полностью включаются в молекулу глюкозы, некоторых (смешанных) частично. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани. Как известно, в гликолизе существуют три необратимые реакции: пируваткиназная (десятая), фосфофруктокиназная (третья) и гексокиназная (первая). В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры, которые клетка обходит с помощью дополнительных реакций. Глюконеогенез включает все обратимые реакции гликолиза, и особые обходные пути, т.е. он не полностью повторяет реакции окисления глюкозы. Его реакции способны идти во всех тканях, кроме последней глюкозо-6-фосфатазной реакции, которая идет только в печени и почках. Поэтому, строго говоря, глюконеогенез идет только в этих двух органах. Обход десятой реакции гликолизаНа этом этапе глюконеогенеза работают два ключевых фермента – в митохондриях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа, при этом в реакциях тратятся два макроэрга - АТФ и ГТФ. В химическом плане обходной путь десятой реакции выглядит достаточно просто:  Упрощенный в(ЛИГАЗЫ)ариант написания обхода десятой реакции гликолизаОднако дело в том, что пируваткарбоксилаза находится в митохондрии, а фосфоенолпируват-карбоксикиназа – в цитозоле. Дополняет проблему непроницаемость митохондриальной мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшественник оксалоацетата по ЦТК. Поэтому в реальности все выглядит более сложно: 1. В цитозоле пировиноградная кислота может появиться при окислении молочной кислоты и в реакции трансаминированияаланина. После этого пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. В митохондриях пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Пируваткарбоксилазная реакция идет в клетке постоянно, так как оксалоацетат является главным регулятором скорости ЦТК. Реакция называется анаплеротической (пополняющей) реакцией ЦТК. 2. Далее оксалоацетат мог бы превратиться в фосфоенолпируват, но для этого сначала он должен попасть в цитозоль. Поэтому происходит реакция восстановления оксалоацетата в малат при участии малатдегидрогеназы. В результате малат накапливается, выходит в цитозоль и здесь превращается обратно в оксалоацетат. Повернуть малатдегидрогеназную реакцию ЦТК вспять позволяет избыток НАДН в митохондриях. НАДН поступает из β-окисления жирных кислот, активируемого в гепатоците при голодании. 3. В цитоплазме фосфоенолпируват-карбоксикиназа осуществляет превращение оксалоацетата в фосфоенолпируват, для реакции требуется энергия ГТФ. От молекулы отщепляется тот же углерод, что и присоединяется.  Обход десятой реакции гликолизаОбход третьей реакции гликолизаВторое препятствие на пути синтеза глюкозы – фосфофруктокиназная реакция – преодолевается с помощью фермента фруктозо-1,6-дифосфатазы. Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким образом, эти ткани способны синтезировать фруктозо-6-фосфат и глюкозо-6-фосфат. 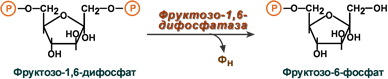 Обход третьей реакции гликолизаОбход первой реакции гликолизаПоследняя реакция катализируется глюкозо-6-фосфатазой. Она имеется только в печени и почках, следовательно, только эти ткани могут продуцировать свободную глюкозу.  Обход первой реакции гликолизаГИДРОЛАЗЫ  НА 1 моль глюкозы из двух моль пирувата расходуется 4 моль атф и два моль ГТФ Назовите ключевые реакции глюконеогенеза, ключевые ферменты и объясните механизмы регуляции их активности назовите гормоны, «запускающие» глюконеогенез, и объясните механизм их действия  ◊ Стимуляция глюконеогенеза. Глюкагон усиливает транспорт АК из крови в гепатоциты и одновременно активирует ключевые ферменты глюконеогенеза (пируваткарбоксилаза. Фруктозо01,6-дифосфатаза), что приводи к содержания глюкозы в цитоплазме клеток и её поступлению в кровь. Основными гормонами, активирующими гликогенолиз, являются глюкагон, ад-реналин и кортизол. В меньшей степени активации гликогенолиза способству-ют состояния, сопровождающиеся гиперпродукцией СТГ и гормонов щитовид-ной железы. 2. Сахар крови и его регуляция. Назовите концентрацию глюкозы в крови в норме натощак. Как изменяется содержание глюкозы в крови после приема пищи? Объясните понятие «алиментарная гипергликемия». Объясните, как регулируется метаболизм глюкозы после приема пищи (назовите гормон и метаболические процессы, которые он «запускает», механизм действия гормона и ключевые ферменты, которые он активирует). Назовите возможные причины гипергликемии, несвязанные с приемом пищи. Уровень сахара в крови (норма натощак). Определяется утром после ночного сна, составляет от 59 до 99 мг в 100 мл крови (нижняя граница нормы составляет 3,3 ммоль/л, а верхняя — 5,5 ммоль/л). Надлежащий уровень глюкозы после еды. Сахар в крови определяется через два часа после еды, в норме он не должен превышать 141 мг/100 мл (7,8 ммоль/л).  Гипергликемия – это увеличение концентрации глюкозы в плазме крови более 6,1 ммоль/л. Если же в пищеварительный тракт поступает большое количество легкорасщепляющихся и быстровсасывающихся углеводов, содержание глюкозы в крови быстро увеличивается. Развивающуюся при этом гипергликемию называют алиментарной, иначе говоря - пищевой. Ее результатом может являться глюкозурия, то есть выделение глюкозы с мочой, которое наступает в том случае, если уровень глюкозы в крови повышается до 8,9 - 10,0 ммоль/л. 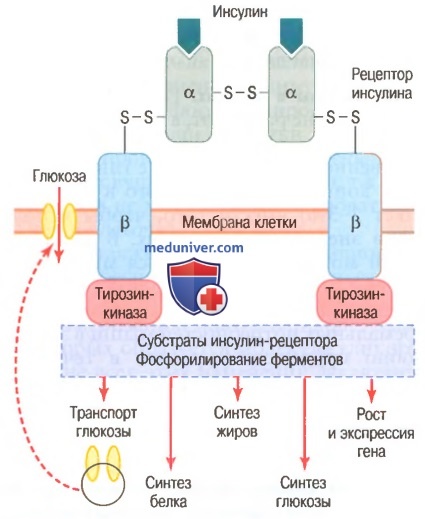 а) Влияние инсулина на обмен углеводов. Сразу после потребления пищи, богатой углеводами, глюкоза, всасываясь в кровь, стимулирует секрецию инсулина. Инсулин, в свою очередь, повышает поступление, хранение и использование глюкозы почти всеми тканями организма, особенно мышцами, жировой тканью и печенью. Схема инсулин-рецептора. Инсулин связывается с альфа-субъединицей рецептора, что вызывает фосфорилирование бета-субъединицы рецептора. Это, в свою очередь, индуцирует активность тирозинкиназы. Рецептор тирозинкиназной активности запускает каскад реакций фосфорилирования в клетке, что увеличивает или снижает активность ферментов, включая субстраты инсулин-рецептора, которыми опосредованы влияния глюкозы на метаболизм глюкозы, жиров и белков. Например, транспортеры глюкозы продвигаются к мембране клетки, облегчая поступление глюкозы в клетку б) Инсулин повышает поступление и метаболизм глюкозы в мышцах. Неоднократно на протяжении суток мышечная ткань обеспечивает свои энергетические потребности не столько глюкозой, сколько жирными кислотами. Это объясняется тем, что мембрана мышечной клетки в покое обладает низкой проницаемостью для глюкозы, кроме случаев, опосредованных стимулирующими влияниями инсулина; в промежутках между приемами пищи количество секретируемого инсулина слишком мало, чтобы обеспечить поступление значительного количества глюкозы в клетки. Однако существуют два состояния, когда мышцы потребляют большое количество глюкозы. Одно из них — тяжелые физические нагрузки. Потребление глюкозы в такой ситуации не требует большого количества инсулина, поскольку мышечные волокна становятся более проницаемы для глюкозы даже при отсутствии инсулина за счет процессов сокращения. Вторым случаем высокого потребления глюкозы мышцами становится период через несколько часов после приема пищи. В это время концентрация глюкозы в крови высока и поджелудочная железа секретирует большое количество инсулина. Высокая концентрация инсулина обеспечивает быстрый транспорт глюкозы в мышечные клетки. Это вызывает преимущественное по сравнению с жирными кислотами использование глюкозы мышечными клетками, что мы обсудим далее. в) Хранение глюкозы в мышцах. Если мышцы после приема пищи не работают, а глюкоза в больших количествах еще поступает в клетки, она преимущественно запасается в виде гликогена (предельная концентрация которого в мышцах составляет 2-3%) вместо того, чтобы использоваться в энергетических целях. В дальнейшем гликоген может использоваться мышцами для получения энергии. Депонирование гликогена особенно полезно во время коротких периодов экстремальных потребностей мышц в энергии и способно продемонстрировать в течение нескольких минут высокий уровень энергообеспечения даже при отсутствии кислорода за счет гликолитического расщепления гликогена до молочной кислоты. г) Количественное влияние инсулина на облегчение транспорта глюкозы через мембраны мышечных клеток. Это влияние показано на рисунке ниже в виде результатов экспериментов. Влияние инсулина, облегчающее повышение концентрации глюкозы внутри мышечных клеток. Заметьте, что при отсутствии инсулина (контроль) внутриклеточная концентрация глюкозы остается близкой к нулю, несмотря на ее высокую внеклеточную концентрацию Нижняя кривая («контроль») показывает концентрацию свободной глюкозы, измеренную внутри клетки. Концентрация свободной глюкозы остается почти равной нулю, несмотря на то, что концентрация глюкозы во внеклеточной жидкости достигает 750 мг/дл. Кривая, помеченная «инсулин», показывает, что концентрация глюкозы во внутриклеточной жидкости достигает 400 мг/дл при добавлении инсулина. Таким образом, инсулин может повышать скорость транспорта глюкозы в покоящиеся мышечные клетки почти в 15 раз. а) Активация инсулином рецепторов клеток-мишеней и результирующие ответы клеток. Для воздействия на клетку-мишень инсулин прежде всего связывается и активирует рецептор, расположенный на мембране клеток, — белок с молекулярной массой около 300000 (для облегчения понимания просим вас изучить рисунок ниже). Схема инсулин-рецептора. Инсулин связывается с альфа-субъединицей рецептора, что вызывает фосфорилирование бета-субъединицы рецептора. Это, в свою очередь, индуцирует активность тирозинкиназы. Рецептор тирозинкиназной активности запускает каскад реакций фосфорилирования в клетке, что увеличивает или снижает активность ферментов, включая субстраты инсулин-рецептора, которыми опосредованы влияния глюкозы на метаболизм глюкозы, жиров и белков. Например, транспортеры глюкозы продвигаются к мембране клетки, облегчая поступление глюкозы в клетку Активация рецептора сопровождается определенной последовательностью реакций. Рецептор инсулина состоит из 4 субъединиц, связанных дисульфидными связями: 2 альфа-субъединицы располагаются практически снаружи мембраны и 2 бета-субъединицы прободают мембрану и продолжаются в цитоплазму. Инсулин взаимодействует с 2 наружными субъединицами, но благодаря существенным собственным связям субъединиц между собой внутренние бета-субъединицы при этом аутофосфорилируются, поэтому инсулиновый рецептор является примером энзим-связанного рецептора. Аутофосфорилирование бета-субъединиц рецептора приводит к местной активации тирозинкиназы, которая в итоге вызывает фосфорилирование многих других внутриклеточных ферментов, включая группу, названную субстратами инсулин-рецептора. Различные типы СИР (например, СИР1, СИР2, СИРЗ) представлены в различных клетках. Система действует, активируя одни ферменты одновременно с инактивацией других. Таким образом, инсулин управляет внутриклеточными метаболическими механизмами, вызывая желательные реакции обмена белков, жиров и углеводов. Окончательные эффекты действия инсулина следующие. 1. Через несколько секунд после взаимодействия инсулина с рецептором проницаемость мембран для глюкозы у 80% клеток организма заметно повышается. Это особенно справедливо для мышечных клеток и адипоцитов, но совершенно не распространяется на нейроны мозга. Поступившая в клетки глюкоза фосфорилируется и становится субстратом для всех обычных этапов обмена углеводов. Увеличение транспорта глюкозы в клетку предположительно является результатом перемещения множества внутриклеточных пузырьков к мембране клетки; эти пузырьки несут на своей мембране множество белков, обеспечивающих транспорт глюкозы; взаимодействуя с мембраной клетки, они облегчают поступление глюкозы в клетку. Если инсулина уже не оказывается в наличии, пузырьки отделяются от мембраны в течение 3-5 мин и возвращаются в середину клетки, сохраняя способность к использованию их по мере необходимости. 2. Мембрана становится более проницаемой для многих аминокислот, ионов калия, фосфатов, повышая транспорт этих веществ в клетку. 3. Медленные эффекты возникают через 10-15 мин и заключаются в изменении уровня активности большинства внутриклеточных метаболических ферментов. Этот эффект является результатом главным образом изменения процессов фосфорилирования ферментов. 4. Более медленные процессы продолжаются в течение нескольких часов и дней. Они являются результатом изменения скорости процесса трансляции на рибосомах и приводят к образованию новых белков. Еще более медленные эффекты опосредованы изменением скорости транскрипции ДНК в ядре клетки. Таким способом инсулин формирует многие ферментативные механизмы клеток для выполнения свойственных им метаболических задач. Причины гипергликемии Физиологические состояния Кратковременное повышение в крови сахара может наблюдаться во время беременности, при приеме углеводсодержащей пищи накануне сдачи биохимического анализа. При стрессе гипергликемия возникает по причине активации симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем и выработки контринсулярных гормонов. При данных состояниях гипергликемия является транзиторной (обратимой) и не требует никакого вмешательства. Сахарный диабет Сахарный диабет (СД) ‒ ведущая причина повышенного содержания в крови глюкозы. Патогенетические механизмы развития гипергликемии несколько отличаются при разных типах диабета. Для СД 1 типа характерно снижение выработки инсулина бета-клетками островков Лангерганса поджелудочной железы (абсолютная инсулиновая недостаточность), что приводит к нарушению утилизации глюкозы как энергетического субстрата периферическими тканями (жировой, мышечной) и, соответственно, ее задержке в крови. При СД 2 типа, напротив, вследствие длительно протекающей гиперинсулинемии, возникает инсулинорезистентность (повышение порога чувствительности к инсулину) в связи с уменьшением количества рецепторов к инсулину на поверхностях клеток мышечной и жировой тканей (относительная инсулиновая недостаточность). Гестационный сахарный диабет (ГСД) обусловлен снижением клиренса инсулина, а также действием фетоплацентарных гормонов (плацентарного лактогена, прогестерона). Диабет 1 типа. Типичен скачкообразный характер гипергликемии. Резкое увеличение в крови уровня сахара может возникнуть и в момент клинической манифестации заболевания, и, что чаще всего, при несоблюдении дозировок либо пропусках инъекций инсулина. Для поддержания глюкозы в пределах нормальных значений необходима пожизненная инсулинотерапия. Диабет 2 типа. Отличается медленным и неуклонным нарастанием концентрации глюкозы, из-за чего она может достигать очень высоких значений (30-40 ммоль/л). Уровень гликемии снижается под влиянием диеты и приема сахароснижающих средств. Нормализация массы тела и бариатрическая хирургия способны уменьшить либо полностью избавить от потребности в лечении. ГСД. При гестационном диабете сахар крови постепенно повышается во II-III триместрах беременности. Специфическое лечение проводится до наступления родов либо оперативного родоразрешения. В послеродовом периоде часто наблюдается спонтанная ремиссия, однако возможно сохранение гипергликемии с переходом в сахарный диабет 2 типа. Другие эндокринные расстройства Помимо сахарного диабета к гипергликемии могут приводить и другие заболевания эндокринной системы. Главным образом это касается эндокринопатий, сопровождающихся усиленной выработкой контринсулярных гормонов, т.е. гормонов повышающих концентрацию глюкозы путем влияния на различные этапы углеводного метаболизма: Тиреотоксикоз. При диффузном токсическом зобе или токсической аденоме гормоны щитовидной железы активируют гликогенолиз, глюконеогенез, стимулируют всасывание глюкозы в кишечнике. Гипергликемия умеренная, разрешается после нормализации уровня тиреоидных гормонов. Гиперкортицизм. Глюкокортикостероиды (кортизол) усиливают глюконеогенез и подавляют расщепление глюкозы. При болезни/синдроме Иценко-Кушинга нередко развивается так называемый «стероидный диабет». Феохромоцитома. Катехоламины (адреналин, норадреналин) стимулируют распад в печени гликогена. Гипергликемия протекает пароксизмально, уровень глюкозы резко увеличивается в момент симпато-адреналового криза. В межприступный период гликемия остается в пределах нормы. Акромегалия. Гормон роста, продуцируемый опухолью гипофиза соматотропиномой, помимо прямого гипергликемического эффекта, подавляет утилизацию глюкозы периферическими тканями, т.е. формирует инсулинорезистентность. Поэтому гипергликемия при акромегалии носит особый характер. В отличие от других эндокринопатий, при которых чаще имеет место нарушение толерантности к глюкозе, акромегалия довольно часто приводит к развитию 2 типа СД. Глюкагонома. Глюкагон как основной антагонист инсулина, стимулирует образование глюкозы из аминокислот в печени. Гипергликемия носит легкое течение. В большинстве случаев изменений в диете достаточно для нормализации сахара крови. Другие причины Судорожные состояния. Органические поражения ЦНС: энцефалиты, опухоли головного мозга, кровоизлияния в IV желудочек. Печеночная недостаточность. Тяжелые заболевания поджелудочной железы: панкреонекроз, муковисцидоз. Прием лекарственных препаратов: тиазидных диуретиков, глюкокортикостероидов, блокаторов бета-адренорецепторов. Тяжелые соматические расстройства: сепсис, обширные ожоги. Аутоиммунные полигландулярыне синдромы: синдром Шмидта. Редкие наследственные синдромы: липодистрофия Сайпа-Лоренса, синдром Прадера-Вилли, синдром Видеманна-Беквита. ВИЧ-инфекция. Объясните понятие гипогликемия. Назовите возможные причины гипогликемии. При какой концентрации глюкозы в крови возникает гипогликемическая кома? Объясните, как регулируется метаболизм глюкозы в постабсорбтивный период, при голодании, физической нагрузке и стрессе (назовите гормоны и метаболические процессы, которые они «запускают», механизм действия гормонов и ключевые ферменты, которые они активируют). 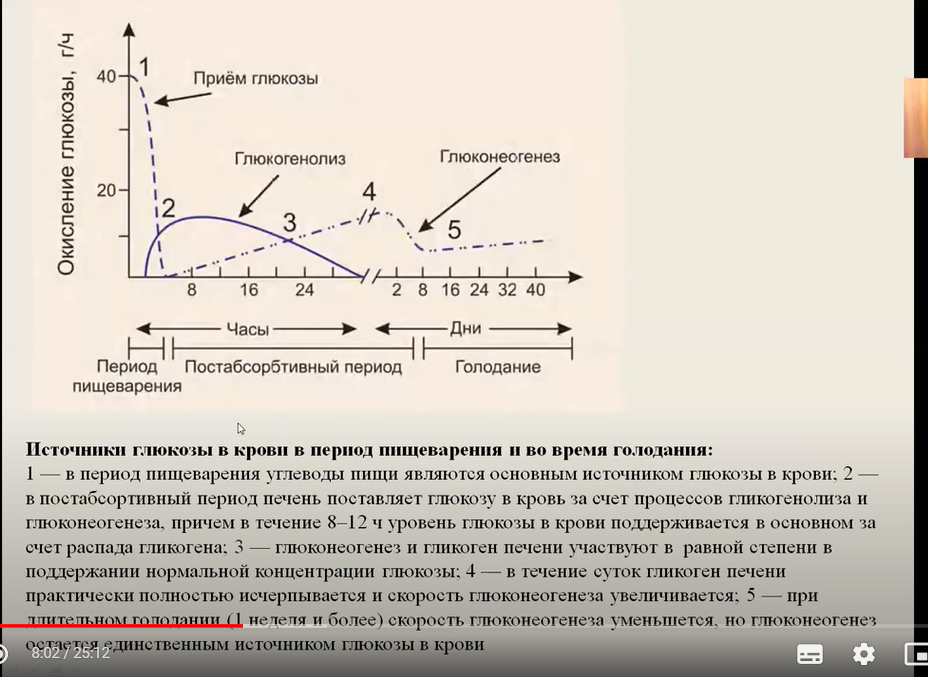 Гипогликемия – это снижение плазменной концентрации глюкозы менее 2,8 ммоль/л Причины включают несоблюдение режима инсулинотерапии при диабете (пропуск приема пищи, физическая нагрузка, употребление алкоголя), различные эндокринные и метаболические расстройства, онкологические заболевания. Причины гипогликемии Состояние имеет множество этиологических факторов. У здорового человека причинами снижения глюкозы меньше нормальных значений могут быть беременность, интенсивные физические нагрузки, длительное голодание. Однако такие случаи крайне редки. Чаще всего гипогликемия развивается при различных заболеваниях и патологических состояниях: Погрешности инсулинотерапии при диабете. Считаются наиболее частой причиной гипогликемии. В основном она развивается, если пациент, регулярно выполняющий себе инъекции инсулина, пропускает прием пищи, употребляет алкоголь, начинает заниматься физическими упражнениями. Иногда причиной становится нарушение техники инъекции, случайная или преднамеренная передозировка инсулина. Гиперинсулинизм. Секреция в кровь неадекватно большого количества инсулина бета-клетками поджелудочной железы встречается при инсулиноме, гиперплазии островков Лангерганса (незидиобластозе). Также причинами избыточной продукции инсулина и инсулиноподобного фактора роста являются некоторые злокачественные опухоли (карцинома, мезотелиома). Гипогликемия может возникнуть при наличии аутоантител к инсулину, связывающихся с инсулиновыми рецепторами (болезнь Хирата). Эндокринные расстройства. Дефицит так называемых контринсулярных гормонов, т.е. гормонов с антагонистическим действием по отношению к инсулину (кортизол, тироксин, соматотропин) наблюдается при гипотиреозе, надпочечниковой недостаточности, гипофизарном нанизме. Прием лекарств. Кроме инсулина причиной снижения концентрации глюкозы могут быть другие лекарственные препараты. В первую очередь к ним относятся медикаменты, использующиеся при диабете 2 типа (сахароснижающие средства), которые стимулируют выработку инсулина поджелудочной железой – производные сульфонилмочевины (глибенкламид), глиниды (репаглинид). Операции на органах ЖКТ. Такие оперативные вмешательства на органах пищеварения, как резекция желудка или начального отдела тонкой кишки, приводят к демпинг-синдрому, обусловленному ускоренным попаданием в кишечник непереваренной пищи. В результате этого происходит недостаточное расщепление и всасывание углеводов. Наследственные заболевания. Это тяжелые метаболические заболевания (гликогенозы, галактоземия, фруктоземия), характеризующиеся генетически детерминированным дефектом ферментов, участвующих в обмене углеводов (гликогена, фруктозы, галактозы). В результате дефицита энзимов происходит нарушение превращения глюкозы из других углеводов или затруднение ее высвобождения из гликогена, что становится причиной падения уровня гликемии. К развитию гипогликемии предрасполагают хронические заболевания, при которых замедляется клиренс сахароснижающих препаратов, регулирующих уровень глюкозы в крови – почечная, печеночная недостаточность. Гипогликемический эффект производных сульфонилмочевины усиливается при их одновременном приеме с сульфаниламидами, салицилатами, синтетическими противомалярийными средствами. Также гипогликемии способствует замедление опорожнения желудка (диабетический гастропарез). Гипогликемическая кома − состояние, развивающееся при снижении уровня глюкозы в плазме крови ≤ 2,8 ммоль/л или цельной крови ≤ 2,5 ммоль/л. Причины гипогликемии Гипогликемия — это состояние, при котором уровень глюкозы в крови снижается менее 2,8 ммоль/л и возникают явные симптомы, или снижается менее 2,2 ммоль/л независимо от наличия симптомов [16]. Недиабетические гипогликемия — снижение гликемии менее 3 ммоль/л у людей без сахарного диабета из-за дисбаланса в системе поддерживающей уровень глюкозы. Как правило, вызывает неврологические симптомы, вплоть до комы [17]. Гипогликемия может возникать: Под действием лекарственных средств (инсулина, сахароснижающих препаратов сульфонилмочевины и глинидов, Дизопирамида, Пентамидина, некоторых противомалярийных препаратов), интоксикаций (этиловым спиртом, салицилатами и др.). При наличии инсулиномы — опухоли, состоящей из β-клеток островков поджелудочной железы. При гиперплазии островков поджелудочной железы (микроаденоматозе и незидиобластозе). При различных заболеваниях, которые нарушают процесс образования глюкозы в печени, её усвоение или влияют на содержание инсулина в крови: хронической сердечной, почечной и печёночной недостаточности; септическом шоке; снижении активности эндокринных желёз (гипотиреозе, надпочечниковой, гипофизарной и эндокринной полигландулярной недостаточности); больших доброкачественных и злокачественных опухолях (более 5 см в диаметре). При нарушении всасывания углеводов из пищи — после операций на желудке, а также при реактивной гипогликемии в ответ на употребление пищи, богатой легкоусвояемыми углеводами [14]. При гипогликемии усиливается гликогенолиз под влиянием адреналина и глюкагона Сдвиги в концентрации глюкозы в крови от «заданного» (константного) значения воспринимаются глюкорецепторами гипоталамуса, который реализует свои регулирующие влияния на клетки через симпатический и парасимпатические отделы вегетативной нервной системы. Эти влияния обусловливают срочное повышение или снижение выработки инсулина, глюкагона и адреналина эндокринным аппаратом поджелудочной железы и надпочечников. Более медленный эффект гипоталамических влияний осуществляется через гормоны гипофиза. Для поддержания константного уровня концентрации глюкозы существует и более короткая петля обратной связи — влияние глюкозы, циркулирующей в крови, непосредственно на бета-клетки островков Лангерганса поджелудочной железы, вырабатывающих гормон инсулин. При снижении содержания глюкозы в литре крови до уровня менее 0,5 г, вызванном голоданием, передозировкой инсулина, имеет место недостаточность снабжения энергией клеток мозга. Нарушение их функций проявляется учащением сердцебиения, слабостью и тремором мышц, головокружением, усилением потоотделения, ощущением голода. При дальнейшем снижении концентрации глюкозы в крови указанное состояние, именуемое гипогликемией, может перейти в гипогликемическую кому, характеризующуюся угнетением функций мозга вплоть до потери сознания. Введение в кровь глюкозы, прием сахарозы, инъекция глюкагона предупреждают или ослабляют эти проявления гипогликемии. Кратковременное повышение уровня глюкозы в крови (гипергликемия) не представляет угрозы для здоровья человека. В крови организма человека обычно содержится около 5 г глюкозы. При среднесуточном потреблении с пищей взрослым человеком, занимающимся физическим трудом, 430 г углеводов в условиях относительного покоя, тканями ежеминутно потребляется около 0,3 г глюкозы. При этом запасов глюкозы в циркулирующей крови достаточно для питания тканей на 3—5 мин и без ее восполнения неминуема гипогликемия. Потребление глюкозы возрастает при физической и психоэмоциональной нагрузках. Так как периодический (несколько раз в день) прием углеводов с пищей не обеспечивает постоянного и равномерного притока глюкозы из кишечника в кровь, в организме существуют механизмы, восполняющие убыль глюкозы из крови в количествах, эквивалентных ее потреблению тканями. При достаточном уровне концентрации глюкозы в крови она частично превращается в запасаемую форму — гликоген. При уровне более 1,8 г в литре крови происходит выведение ее из организма с мочой. Избыток глюкозы, поступившей из кишечника в кровь воротной вены, поглощается гепатоцитами. При повышении в них концентрации глюкозы активируются ферменты углеводного обмена печени, превращающие глюкозу в гликоген. В ответ на повышение уровня сахара в крови, протекающей через поджелудочную железу, возрастает секреторная активность бета-клеток островков Лангерганса. В кровь выделяется большее количество инсулина — единственного гормона, обладающего резким понижающим концентрацию сахара в крови действием. Под влиянием инсулина повышается проницаемость для глюкозы плазматических мембран клеток мышечной и жировой тканей. Инсулин активирует в печени и мышцах процессы превращения глюкозы в гликоген, улучшает ее поглощение и усвоение скелетными, гладкими и сердечной мышцами. Под влиянием инсулина в клетках жировой ткани из глюкозы синтезируются жиры. Одновременно выделяющийся в больших количествах инсулин тормозит распад гликогена печени и глюконеогенез. Содержание глюкозы в крови оценивается глюкорецепторами переднего гипоталамуса, а также его полисенсорными нейронами. В ответ на повышение уровня глюкозы в крови выше «заданного значения» (>1,2 г/л) возрастает активность нейронов гипоталамуса, которые посредством влияния парасимпатической нервной системы на поджелудочную железу усиливают секрецию инсулина. При понижении уровня глюкозы в крови уменьшается ее поглощение гепатоцитами. В поджелудочной железе снижается секреторная активность бета-клеток, уменьшается секреция инсулина. Тормозятся процессы превращения глюкозы в гликоген в печени и мышцах, уменьшается поглощение и усвоение глюкозы скелетными и гладкими мышцами, жировыми клетками. При участии этих механизмов замедляется или предотвращается дальнейшее понижение уровня глюкозы в крови, которое могло бы привести к развитию гипогликемии. При уменьшении концентрации глюкозы в крови имеет место повышение тонуса симпатической нервной системы. Под ее влиянием усиливается секреция в мозговом веществе надпочечников адреналина и норадреналина. Адреналин, стимулируя распад гликогена в печени и мышцах, вызывает повышение концентрации сахара в крови. Норадреналин обладает слабовыраженной способностью повышать уровень глюкозы в крови. Под влиянием симпатической нервной системы стимулируется выработка альфа-клетками поджелудочной железы глюкагона, который активирует распад гликогена печени, стимулирует глюконеогенез и приводит к повышению уровня глюкозы в крови. Понижение в крови концентрации глюкозы, являющейся для организма одним из наиболее важных энергетических субстратов, вызывает развитие стресса. В ответ на снижение уровня сахара крови глюкорецепторные нейроны гипоталамуса через рилизинг-гормоны стимулируют секрецию гипофизом в кровь гормона роста и адренокортикотропного гормона. Под влиянием гормона роста уменьшается проницаемость клеточных мембран для глюкозы, усиливается глюконеогенез, активируется секреция глюкагона, в результате чего уровень сахара в крови увеличивается. Секретируемые под действием адренокортикотропного гормона в коре надпочечников глюкокортикоиды активируют ферменты глюконеогенеза и этим способствуют увеличению содержания сахара в крови. 3. Нарушения обмена углеводов при сахарном диабете. Назовите типы сахарного диабета (СД) и их возможные причины. Объясните понятие «инсулинорезистентность» и каковы её возможные причины. Сахарный диабет 1 типа Если по ряду причин поджелудочная железа начинает вырабатывать недостаточное количество гормона или вовсе его не производить, возникает патологическое состояние, классифицируемое как диабет 1 типа. Второе его название – инсулинозависимый диабет. Причины поражения тканей поджелудочной железы, ответственных за синтез инсулина, могут быть разными, но механизм заболевания сводится к одному – гормон не вырабатывается. В настоящее время выявлены токсины, уничтожающие секреторную функцию железы, вирусные инфекции, бактериальные панкреатиты, даже аутоиммунные расстройства. Патология может возникнуть даже в очень юном возрасте. Сахарный диабет 1 типа у детей называется ювенильным. Единственным способом терапии является инъекционное введение препаратов инсулина. Данный тип неизлечим, и прием гормона становится пожизненной необходимостью. Сахарный диабет 2 типа  По ряду причин может возникнуть невосприимчивость клеток мишеней к молекулам гормона. В результате поджелудочная железа вырабатывает нужное или даже избыточное количество гормона, но ее клетки становятся невосприимчивыми (резистентными) к нему. Итог этого сбоя тот же – повышение уровня глюкозы в крови. Так как проблема заключается не в недостатке инсулина, его введение не влияет на течение болезни. По этой причине у этого типа диабета есть второе название «инсулинонезависимый». Панкреатический диабет Поджелудочная железа может быть повреждена в результате заболевания панкреатитом. Это может сопровождаться частичной или полной потерей её способности вырабатывать гормон. В результате развивается так называемый панкреатический диабет. Если удается вылечить поджелудочную железу без утраты частей ответственных за синтез инсулина, восстанавливается функция выработки гормона, и заболевание исчезает. Если же поражение железы необратимо, возникает диабет 1 типа. Синдром Вольфрама Редкое генетическое заболевание, при котором в раннем возрасте возникает сахарный и несахарный диабет. Сопровождается дегенеративными явлениями в нервной системе (больше всего страдает зрительный нерв). Механизм заболевания не изучен. Наследуется заболевание по рецессивному (скрытому) признаку, и проявляется, если у обоих родителей есть дефектный ген (по обеим линиям были случаи болезни). Другие типы сахарного диабета Можно выделить следующие нетипичные виды этой болезни: Диабет беременных (гестационный). На фоне серьезных гормональных изменений во время беременности может быть временно нарушена регуляция глюкозного обмена. После родов заболевание проходит. Иммунный (аутоиммунный) диабет. Причины и механизм его не до конца изучены. Проявляется в выработке антител к инсулину, инсулиновым рецепторам клеток или к клеткам островков Лангерганса, ответственных за синтез гормона. Генетический (наследственный). Есть целый ряд синдромов, обусловленных наследственностью, которые сопровождаются диабетом. Эти типы достаточно редки. Инсулинорезистентность – это снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки. Инсулинорезистентность – это снижение восприимчивости инсулин-чувствительных тканей к действию инсулина при достаточной его концентрации в крови. Специфических симптомов у инсулинорезистентности нет. Частыми сопутствующими признаками являются: висцеральное ожирение, артериальная гипертензия, жировой гепатоз, атеросклероз, черный акантоз (пигментированные морщинистые области кожи). |
