бх. Глюконеогенез. Сахар крови и его регуляция
 Скачать 4.04 Mb. Скачать 4.04 Mb.
|
КлассификацияПо степени тяжести гипергликемию разделяют на: Легкую – до 8,2 ммоль/л. Умеренную – от 8,3 до 11 ммоль/л. Тяжелую – свыше 11 ммоль/л. Данное числовое разделение считается весьма условным, так как большее значение имеет не уровень гликемии, а скорость не нарастания. По характеру выделяют физиологическую (стресс, прием углеводной пищи) и патологическую гипергликемию. По происхождению гипергликемии бывают: Гормонально-обусловленные. Повышение сахара вызвано различными эндокринными патологиями (диабет, гиперкортицизм и т.д.). Центрального генеза. Увеличение уровня глюкозы происходит при заболеваниях центральной нервной системы и травмах головного мозга. Алиментарно-обусловленные. Гипергликемия развивается вследствие редких наследственных конституциональных и метаболических нарушений. Причины гипергликемииФизиологические состоянияКратковременное повышение в крови сахара может наблюдаться во время беременности, при приеме углеводсодержащей пищи накануне сдачи биохимического анализа. При стрессе гипергликемия возникает по причине активации симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем и выработки контринсулярных гормонов. При данных состояниях гипергликемия является транзиторной (обратимой) и не требует никакого вмешательства. Сахарный диабетСахарный диабет (СД) ‒ ведущая причина повышенного содержания в крови глюкозы. Патогенетические механизмы развития гипергликемии несколько отличаются при разных типах диабета. Для СД 1 типа характерно снижение выработки инсулина бета-клетками островков Лангерганса поджелудочной железы (абсолютная инсулиновая недостаточность), что приводит к нарушению утилизации глюкозы как энергетического субстрата периферическими тканями (жировой, мышечной) и, соответственно, ее задержке в крови. При СД 2 типа, напротив, вследствие длительно протекающей гиперинсулинемии, возникает инсулинорезистентность (повышение порога чувствительности к инсулину) в связи с уменьшением количества рецепторов к инсулину на поверхностях клеток мышечной и жировой тканей (относительная инсулиновая недостаточность). Гестационный сахарный диабет (ГСД) обусловлен снижением клиренса инсулина, а также действием фетоплацентарных гормонов (плацентарного лактогена, прогестерона). Диабет 1 типа. Типичен скачкообразный характер гипергликемии. Резкое увеличение в крови уровня сахара может возникнуть и в момент клинической манифестации заболевания, и, что чаще всего, при несоблюдении дозировок либо пропусках инъекций инсулина. Для поддержания глюкозы в пределах нормальных значений необходима пожизненная инсулинотерапия. Диабет 2 типа. Отличается медленным и неуклонным нарастанием концентрации глюкозы, из-за чего она может достигать очень высоких значений (30-40 ммоль/л). Уровень гликемии снижается под влиянием диеты и приема сахароснижающих средств. Нормализация массы тела и бариатрическая хирургия способны уменьшить либо полностью избавить от потребности в лечении. ГСД. При гестационном диабете сахар крови постепенно повышается во II-III триместрах беременности. Специфическое лечение проводится до наступления родов либо оперативного родоразрешения. В послеродовом периоде часто наблюдается спонтанная ремиссия, однако возможно сохранение гипергликемии с переходом в сахарный диабет 2 типа. Объясните причины возникновения следующих симптомов СД: глюкозурия (назовите почечный порог глюкозы), полиурия, полидипсия, утомляемость. Почечная глюкозурияНарушение реабсорбции глюкозы в проксимальных канальцах нефрона приводит к повышению ее концентрации в моче. Такое может наблюдаться при изолированной почечной глюкозурии – доброкачественным заболеванием, не требующим никакого лечения. Но чаще это встречается при тубулярных дисфункциях - почечном канальцевом ацидозе, синдроме Фанкони. При органических патологиях почек (гломерулонефрит, острое почечное повреждение), глюкозурия наблюдается гораздо реже и имеет умеренный характер. Глюкозурия считается характерным проявлением некоторых заболеваний, сопровождающихся канальцевой дисфункцией (болезнь Вильсона-Коновалова, цистиноз, витамин Д-резистентный рахит). Помимо выделения с мочой глюкозы, обнаруживается повышенная экскреция аминокислот, бикарбонатов, фосфатов. Отличительная особенность почечных глюкозурий заключается в том, что уровень глюкозы в плазме остается нормальным, а иногда и пониженным, даже несмотря на выраженную глюкозурию. Степень глюкозурии зависит от тяжести нефрологического заболевания. У многих пациентов после лечения в моче может сохраняться высокая концентрация глюкозы. Диабетическая почечная гликозурия (глюкозурия)Другой причиной глюкозурии является нарушение функции почек. Это происходит, когда почечные канальцы плохо поглощают глюкозу. У людей без нарушения метаболизма глюкозы это будет называться «недиабетической почечной глюкозурией». У людей с диабетом такое состояние обычно связано с пагубным воздействием высоких сахаров крови. Диабетическое повреждение почек называют нефропатией. Долгосрочные последствия плохой компенсации диабета- повреждение кровеносных сосудов и нервных окончаний в почках и мочевом пузыре, а также мочевыводящих путях. «Почечный порог» для глюкозы крови составляет 8-10 ммоль/л. Т.е. когда глюкоза в крови выше этого уровня, почки начинают пропускать глюкозу в мочу. Сахарный диабетНаиболее частой причиной полиурии выступает декомпенсированный сахарный диабет. Глюкоза обладает высокой осмотической активностью. При гипергликемии большое количество глюкозы не успевает реабсорбироваться в почках. В результате по осмотическому градиенту вода пассивно переходит в просвет почечных канальцев, это приводит к увеличению объема выделяемой мочи. Полиурия при плохо контролируемом сахарном диабете может достигать 8-10 литров, ее выраженность напрямую коррелирует с уровнем гликемии. При снижении показателей глюкозы крови до референсных значений быстро наступает нормализация диуреза. Полидипсия является компенсаторной реакцией организма, направленной на восстановление водного баланса. Полифагия - также своего рода компенсаторная реакция, позволяющая в какой-то мере увеличить поступление источников энергии в организм и нивелировать их потерю, которая при сахарном диабете проявляется в виде глюкозурии. Дегидратация организма приводит к сухости слизистых оболочек кожи и снижению ее тургора. Состояние кожи и слизистых оболочек может являться до некоторой степени индикатором степени выраженности нарушенных обменных процессов и состояния компенсации диабета. При декомпенсации углеводного обмена кожа, язык и губы становятся сухими, снижается тургор кожи. Сухость во рту, сильная жажда обусловлены, с одной стороны, обезвоживанием организма вследствие избыточного выделения жидкости через почки, с другой - повышением концентрации глюкозы, мочевины, натрия в крови. При диабете наблюдается угнетение функции слюнных желез. Усталости может предшествовать: стремительное падение или скачок уровня глюкозы в роки; повышение кетонов на фоне дефицита инсулина или при низкоуглеводном питании; развитие осложнений; избыток или недостаток веса; дефицит витаминов в осенне-весенний период; психологические проблемы на фоне диабета. Колебания уровня глюкозы в крови Люди с сахарным диабетом часто испытывают чувство усталости. Как правило, это связано с приемом пищи и действием инсулина. Когда в кровь попадает глюкоза, уровень сахара стремительно растет, инсулин резко снижает его. Именно в этот момент диабетики испытывают чувство сонливости и усталости. Чтобы этого избежать, нужно употреблять пищу с небольшим гликемическим индексом, тогда подъем и снижение сахара будет более плавным и без резких скачков. Объясните причины острых осложнений СД: 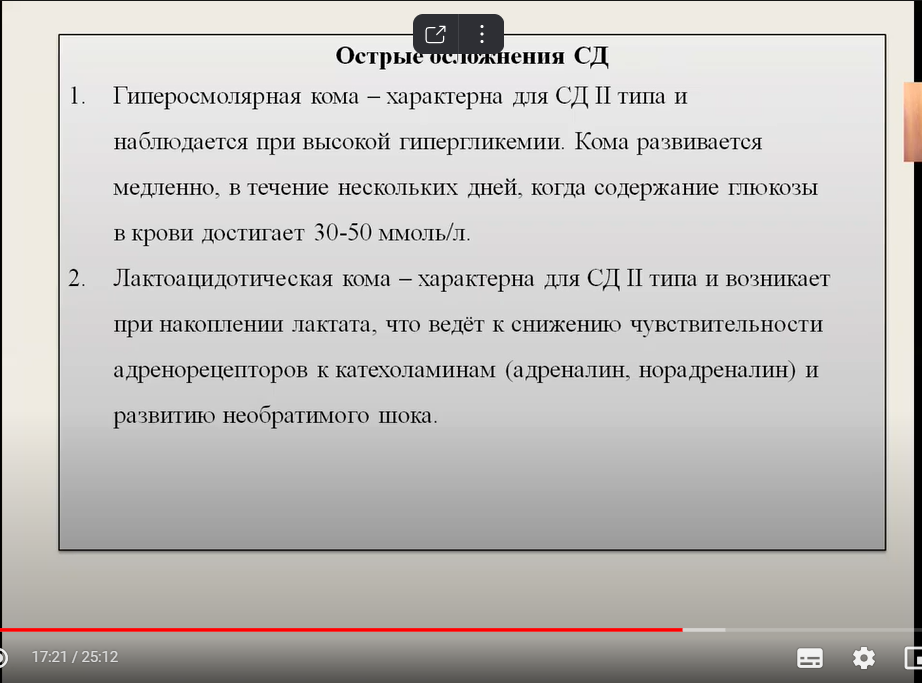 смолярной комы, кето- и лактацидотической комы, гипогликемической комы при инсулинотерапии. смолярной комы, кето- и лактацидотической комы, гипогликемической комы при инсулинотерапии.Гиперосмолярная некетоновая кома – это острое осложнение сахарного диабета второго типа, характеризующееся нарушением метаболизма глюкозы и повышением ее уровня в крови, резким увеличением осмолярности плазмы, выраженной внутриклеточной дегидратацией, отсутствием кетоацидоза. Причины ГОНК развивается на базе сильного обезвоживания. Частыми предшествующими состояниями являются полидипсия и полиурия – усиленное выведение мочи и жажда на протяжении нескольких недель либо дней до проявления синдрома. По этой причине группу особого риска составляют пожилые люди – у них нередко нарушено восприятие жажды, изменена функция почек. Среди других провоцирующих факторов выделяют: Неправильное лечение диабета. К возникновению осложнения приводит недостаточная доза инсулина, пропуск очередной инъекции препарата, пропуск приема пероральных сахароснижающих лекарств, самопроизвольная отмена терапии, ошибки процедуры введения инсулина. Опасность ГОНК заключается в том, что симптомы не проявляются сразу, и пациенты не обращают внимания на допускаемые погрешности лечения. Сопутствующие заболевания. Присоединение других тяжелых патологий увеличивает вероятность гиперосмолярной гипергликемической некетоновой комы. Симптомы развиваются у инфекционных больных, а также при остром декомпенсированном панкреатите, травмах, шоковых состояниях, инфаркте миокарда, инсульте. У женщин опасным периодом является беременность. Изменение питания. Причиной осложнения может стать увеличение количества углеводов в рационе. Зачастую это происходит постепенно и не расценивается пациентами как нарушение лечебной диеты. Потеря жидкости. Обезвоживание возникает при приеме диуретиков, ожогах, переохлаждении, рвоте и диарее. Кроме этого, ГОНК провоцируется систематической ситуационной невозможностью утоления жажды (невозможностью отвлечься от рабочего места и восполнить потерю жидкости, дефицитом питьевой воды в местности). Прием лекарств. Появление симптомов может быть спровоцировано приемом мочегонных или слабительных средств, выводящих жидкость из организма. К «опасным» препаратам также относятся кортикостероиды, бета-адреноблокаторы и некоторые другие лекарства, нарушающие толерантность к глюкозе. Диабетическая кетоацидотическая кома – специфическое острое осложнение заболевания, обусловленное абсолютным или резко выраженным относительным дефицитом инсулина вследствие неадекватной инсулиновой терапии или повышения в нем потребности. Встречаемость этой комы составляет около 40 случаев на 1 тыс. пациентов, а смертность достигает 5-15%, у больных старше 60 лет – 20% даже в специализированных центрах. Больше 100 милиграм на децелитр Факторы, провоцирующие развитие диабетическую кетоацидотическую кому Недостаточная доза или пропуск инъекции инсулина (или приема таблетированных сахароснижающих средств) Самовольная отмена сахароснижающей терапии Нарушение техники введения инсулина Присоединение других заболеваний (инфекции, травмы, операции, беременность, инфаркт миокарда, инсульт, стресс и др.) Злоупотребление алкоголем Недостаточное проведение самоконтроля обмена веществ Прием некоторых лекарственных препаратов Причины декомпенсации сахарного диабета: 1. Несвоевременное обращение больного с начинающимся инсули-нозависимым сахарным диабетом к врачу или запоздалая его диагностика (жажда, полиурия, похудание). 2. Ошибки в инсулинотерапии. 3. Неправильное поведение и отношение больного к своему заболеванию (нарушение диеты, прием алкоголя, самовольное изменение дозы инсулина и т. д.). 4. Острые заболевания (особенно гнойные инфекции). 5. Физические и психические травмы, беременность, операции. ПРИЧИНЫ РАЗВИТИЯ ЛАКТАЦИДОТИЧЕСКОЙ КОМЫ Шоки различного происхождения Сердечная недостаточность Дыхательная недостаточность Лейкоз (злокачественной заболевание кроветворной системы) Хронический алкоголизм Отравление салицилатами (группа препаратов) Отравление метиловым спиртом Прием бигуанидов (препараты, используемые для лечения сахарного диабета) Хронические заболевания печени Лактацидотическая кома – осложнение сахарного диабета, развивающееся вследствие дефицита инсулина и накопления в крови большого количества молочной кислоты, что ведет к тяжелому ацидозу и потере сознания. Чаще возникает у больных старше 50 лет при приеме бигуанидов на фоне сердечно-сосудистой, печеночной и почечной недостаточности, выраженной анемии. Патогенез лактацидемической комы обусловливается высокой гликемией на фоне дефицита инсулина, в ответ на массивный выброс катехоламинов в кровь. Дефицит инсулина способствует накоплению пировиноградной кислоты, избыток которой, в свою очередь, вызывает усиление продукции молочной кислоты, а дефицит кислорода, неизбежный в данной ситуации, затрудняет переход пирувата в ацетил-СоА. Кроме этого, катехоламины активируют анаэробный гликолиз, при котором увеличивается превращение пирувата в лактат. В результате происходит накопление большого количества пирувата и лактата, что вызывает быстрое развитие молочно-кислого ацидоза, характеризующегося большим дефицитом бикарбонатных буферов, основной опасностью которого является угнетение функций сердечно-сосудистой системы с развитием брадикардии и падением минутного объема сердца. Кроме этого, при лактоацидозе возникает блокада адренергических рецепторов сердца и сосудов, нарушается хронотропное и констриктивное действие катехоламинов, что в конечном итоге может привести к возникновению необратимого шока. Под гипогликемией понимаются те или иные клинические симптомы, проявляющиеся у больных при снижении уровня гликемии ниже 3 ммоль/л; однако у больных сахарным диабетом (СД), находящихся на инсулинотерапии, симптомы гипогликемии могут появиться и при резких колебаниях (перепадах) уровня гликемии — когда сахар крови быстро снижается с высоких цифр, но не достигая при этом низкого уровня; гипогликемия может развиться и на фоне лечения таблетированными сахароснижающими препаратами (группа глибенкламида — манинил и его аналоги) больных диабетом пожилого возраста. Глубокая гипогликемическая кома наступает обычно при снижении гликемии до 1-2 ммоль/л. В основе патогенеза гипогликемии лежит резкое снижение поступления глюкозы в клетки (нейроны) головного мозга (углеводное и кислородное голодание головного мозга), что ведет к нарушению психики, сознания — вплоть до развития глубокой комы. Клиника гипогликемической комы Гипогликемическая кома (на фоне инсулинотерапии) развивается быстро, внезапно, в течение 15-30 минут, тем не менее, в клинике можно выделить начальную стадию, стадию психических нарушений с возбуждением или без него и стадию собственно (полной) гипогликемической комы. Начальная стадия гипогликемической комы характеризуется внезапной общей слабостью, профузной потливостью, дрожью всего тела, чувством голода; может быть головная боль, сердцебиение, онемение губ, языка, парестезии, диплопия. У детей нередко наблюдаются тошнота, рвота, подавленное настроение, иногда возбуждение, агрессивность. При отсутствии помощи, через несколько минут развивается состояние психоза: поведение больного может напоминать алкогольное опьянение, нередко наблюдаются агрессивность, негативизм, немотивированные поступки; у больных могут быть слуховые, зрительные галлюцинации. Больной в этой стадии комы невменяем. Затем присоединяются клонико-тонические судороги, наступает оглушенность, сопорозное состояние и полная потеря сознания — кома. При осмотре характерны следующие симптомы гипогликемической комы: дыхание ровное, кожные покровы влажные, гипертонус мышц, умеренная тахикардия, иногда брадикардия, АД нормальное или незначительно повышено. Гипогликемическая кома может осложниться развитием отёка мозга, что наблюдается или при запоздалой диагностике, и соответственно, поздно начатом лечении, или в результате проведения неадекватной терапии. Диагностика гипогликемической комы В случае развития гипогликемии вне дома, отсутствие медицинских документов может сильно затруднить постановку диагноза. При подозрении у больного развития гипогликемии с лечебно-диагностической целью на догоспитальном этапе можно ввести внутривенно 40-60 мл 40% глюкозы. Если с момента развития гипогликемической комы прошло не более 1 часа, то обычно после введения 40-60 мл глюкозы наступает улучшение состояния больного до восстановления сознания. Диагноз гипогликемической комы окончательно может быть подтверждён исследованием глюкозы крови, когда обнаруживается низкий уровень гликемии. Напоминаем, что клиника гипогликемии может развиться и при быстром падении уровня гликемии с высоких цифр до нормальных значений из-за введения высоких доз инсулина. Неотложная помощь при гипогликемической коме. В начальной стадии гипогликемия может купироваться приёмом внутрь легкоусвояемых углеводов - сладкий чай, варенье, сахар, конфеты - у больных сохраняется глоточный рефлекс. На стадии психических нарушений или при развитии глубокой комы неотложная помощь оказывается путём струйного вливания в вену 40% раствора глюкозы. Количество вливаемой глюкозы зависит от степени скорости восстановления сознания, в тяжёлых случаях гипогликемической комы может потребоваться введение до 100-150 мл 40% раствора глюкозы. В случае затянувшейся тяжёлой гипогликемии, несмотря на вливание больших доз глюкозы, если не происходит восстановления сознания, это может свидетельствовать о развитии осложнения — отёка мозга. При этом желательно ведение больного совместно с невропатологом. Какова причина поздних осложнений СД? Охарактеризуйте процесс неферментативного  лирования белков и превращение глюкозы в сорбитол. Приведите примеры поздних осложнений СД. лирования белков и превращение глюкозы в сорбитол. Приведите примеры поздних осложнений СД.Неферментативное гликозилирование белков – это реакция между глюкозой и лизиновыми аминокислотными остатками циркулирующих или структурных белков, не требующая присутствия специфических ферментов. Процесс неферментного гликозилирования белков проходит несколько этапов: вначале образуются обратимые продукты гликозилирования (основания Шиффа), затем слабо обратимые – продукты Амадори и, наконец, – необратимые конечные продукты гликозилирования (КПГ). Как обратимые, так и необратимые продукты гликозилирования оказывают неблагоприятное воздействие на почки. Продукты Амадори нарушают внутрипочечную гемодинамику, способствуя поддержанию гиперфильтрации. Однако наибольшее повреждающее действие оказывают необратимые КПГ, изменяющие структуру и метаболизм основных белков организма (коллагена, миелина, ДНК). КПГ образуются в организме больного СД очень быстро – в течение нескольких месяцев. В дальнейшем даже строгая компенсация СД не способна устранить эти продукты. Гликозилирование структурных белков базальной мембраны клубочков и мезангия приводит к нарушению их конфигурации, потере зарядо- и размероселективности базальной мембраны клубочков, торможению метаболизма основных белковых компонентов почечных структур, что сопровождается увеличением объема мезангиального матрикса и утолщением базальных мембран сосудов. Гепарансульфат (ГС) сосудистой стенки участвует в создании отрицательного заряда эндотелия, обеспечивает антикоагулянтные свойства сосудистой стенки, регулирует пролиферацию гладкомышечных клеток. При гипергликемии снижается активность ферментов, отвечающих за сульфатирование ГС. Неполноценно сульфатированные цепочки ГС, встраиваясь в базальную мембрану клубочка (БМК), не обеспечивают достаточного отрицательного заряда, что приводит к потере зарядоселективных свойств клубочкового фильтра и проникновению альбумина через БМК. В свою очередь неполноценно сульфатированные цепочки ГС на эндотелии других сосудов также приводят к повышенной проницаемости мембран и генерализованной эндотелиальной дисфункции. Установлено также, что КПГ реагируют с эндотелиальными и макрофагальными клетками, вызывая их повреждение. Повреждение эндотелиальных клеток способствует повышению проницаемости эндотелиального барьера для низкомолекулярных веществ, а также выбросу прокоагулянтных факторов, что провоцирует тромботическую окклюзию капилляров и развитие коагулопатий. Макрофагальные клетки участвуют в захвате и поглощении продуктов гликозилирования, при этом выбрасывая в ткани цитокины (фактор некроза опухоли , интерлейкин-1), которые в свою очередь провоцируют склеротические изменения тканей. Расшифрован механизм экспрессии генов под влиянием КПГ. Вначале указанные соединения связываются со специфическими КПГ-рецепторами, локализованными на моноцитах, макрофагах, эндотелиальных клетках, которые опосредуют трансдукцию этого сигнала посредством увеличения образования свободных радикалов кислорода. Последние в свою очередь активируют транскрипцию ядерного NF-kB фактора-регулятора экспрессии многих генов, отвечающих на различные повреждения. Это специфическое, активирующее экспрессию различных белков, действие КПГ может быть прервано или заблокировано применением антител к рецепторам КПГ или антител к КПГ. Циркулирующие в крови КПГ влияют на липидный обмен. С одной стороны, они вызывают перекисное окисление липидов, с другой стороны – их гликозилирование. Процесс гликозилирования липидов нарушает их биологическую активность, транспорт в клетки и расщепление. Это приводит к тому, что в клетки продолжает поступать холестерин ЛПНП, несмотря на перенасыщение клеток холестерином. Кроме того, гликозилированный коллаген сосудов приобретает способность связывать в три раза большее количество ХС-ЛПНП, чем коллаген здоровых людей. Walcher D. и соавт. установили, что при связывании КПГ с рецептором для КПГ (RAGE) происходит выделение провоспалительных медиаторов в различных типах сосудистых клеток, что вызывает различные микрососудистые и макрососудистые осложнения. В исследованиях на животных было показано, что разрыв взаимодействия КПГ с их рецептором уменьшает патологические изменения и развитие бляшки, дефицит рецепторов КПГ в аполипопротеине Е у мышей-двойников уменьшает развитие атеросклероза при СД [17]. Полиоловый путь обмена глюкозы – это превращение глюкозы в сорбитол при участии фермента альдозоредуктазы. Метаболизм глюкозы по полиоловому пути происходит преимущественно в тех органах и тканях, которые не требуют присутствия инсулина для проникновения глюкозы в клетки. К таким тканям относятся нервные волокна, хрусталик, эндотелий сосудов и клетки почечных клубочков. В результате в этих тканях накапливается сорбитол и одновременно истощаются запасы внутриклеточного миоинозитола. Подобные биохимические изменения приводят к нарушению внутриклеточной осморегуляции, отеку ткани и развитию микрососудистых осложнений. Основная масса исследований свидетельствует о ведущей роли полиолового пути обмена глюкозы в развитии диабетической полинейропатии и ретинопатии [3]. Нарушение функции периферических нервов и повышение скорости клубочковой фильтрации, которая наблюдается у животных с различными моделями диабета, нормализуется после назначения таким животным сорбинила – ингибитора альдозоредуктазы. Однако применение ингибиторов альдозоредуктазы для лечения поздних осложнений СД не сопровождается столь значительными положительными эффектами, которые выявляются у диабетических животных [2]. Одним из путей метаболизма глюкозы является ее превращение в сорбитол и фруктозу в метаболическом пути, получившим название полиоловый путь. Для обеспечения реакций полиолового пути в клетках присутствует фермент альдозоредуктаза, которая превращает глюкозу в сорбитол. Обычно в данную реакцию попадает не более 1% глюкозы, и она используется для получения фруктозы в процессе синтеза глюкозаминов.  Полиоловый путь превращения глюкозыОтдельное значение путь имеет в семенных пузырьках, которые синтезируют фруктозу для семенной жидкости. Сперматозоиды, находящиеся здесь, используют фруктозу в качестве основного энергетического субстрата, но при переходе в женские половые пути переключаются на глюкозу. Считается, что использование фруктозы повышает стабильность и предотвращает преждевременное разрушение акросомы спермия. Клиническая значимость полиолового пути проявляется в инсулиннезависимых тканях, в которые глюкоза поступает неконтролируемо по градиенту концентрации – эндотелий, хрусталик глаза, клетки клубочков почек, но в первую очередь, нейроны. Путь активируется при гипергликемиях, когда поток глюкозы в клетки увеличивается и скорость синтеза сорбитола резко возрастает. Накопление сорбитола в нейронах подавляет синтез циклического спирта инозитола, входящего в состав фосфолипидов и используемого при передаче гормонального сигнала, и снижает активность Na+,K+-АТФазы, что нарушает проведение нервного импульса. Избыток в клетке осмотически активных сорбитола и фруктозы удерживает воду, изменяет форму клеток и их функциональную активность. Избыточная работа альдозоредуктазы приводит к расходованию НАДФН в клетках, что подавляет ряд процессов, например восстановление глутатиона, используемого в антиоксидантной системе клеток и в метаболических процессах, реакцию синтеза вазодилататора оксида азота (NO), нейтрализация аммиака в реакции восстановительного аминирования α-кетоглутарата, микросомальное окисление. |
