БХ 5 1 и 2 часть. Гормоны поджелудочной железы
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
1 часть1. Гормоны поджелудочной железы 1.1. Глюкагон: структура, механизм действия и влияние на обмен веществ 1.2. Инсулин: структура, секреция, механизм действия и влияние на обмен углеводов, липидов и белков. Гормоны поджелудочной железы Островки Лангерганса являются эндокринной частью поджелудочной железы. Их количество доходит до миллиона и более. В них различают три основных типа гормонпродуцирующих клеток. Альфа(α)-клетки островков Лангерганса (около 20% клеток в островке) вырабатывают и секретируют в кровь глюкагон. Бета(β)-клетки (70% клеток) вырабатывают инсулин. D(d)-клетки составляют 5 – 10% клеток и вырабатывают соматостатин. Другие типы клеток встречаются реже и не во всех островках. Например, РР-клетки (до 2%), синтезирующие панкреатический полипептид. Основными гормонами, секретирующимися эндокринным аппаратом поджелудочной железы, являются инсулин и глюкагон. Инсулин — это анаболический гормон, способствующий сохранению глюкозы, жирных кислот и аминокислот. Глюкагон, наоборот, является гормоном катаболического типа действия. Он мобилизирует глюкозу, жирные кислоты и аминокислоты из тканевых запасов в кровоток. Эти два гормона функционально взаимосвязаны. Глюкагон – гормон α-клеток островков Лангерганса Глюкагон относится к группе гормонов белково-пептидной природы. Он состоит из 29 аминокислот. Основным регулятором секреции глюкагона является глюкоза. В ответ на гипогликемию и снижение концентрации глюкозы в крови наблюдается стимуляция его секреции. Кроме того, секреция гормона возрастает при потреблении белков и повышении концентрации аминокислот. Секреции предшествует стадия активации гормона из предшественника (препроглюкагона) в двух последовательных реакциях частичного протеолиза. Глюкагон реализует свое действие через 7-TMС-рецепторы по классическому мембранно-внутриклеточному механизму передачи сигнала за счет формирования в клетках цАМФ. Мишенями глюкагона являются печень, жировая ткань и миокард. Скелетные мышцы не содержат рецепторов к гормону. Глюкагон является гормоном гипергликемического типа действия. Он влияет на метаболизм гликогена и глюконеогенез в гепатоцитах. Гормон усиливает распад гликогена печени за счёт активации гликогенфосфорилазы (с участием цАМФ). Под действием глюкагона в печени ингибируется активность гликогенсинтазы – регуляторного фермента синтеза гликогена. В отличие от гликогенфосфорилазы, гликогенсинтаза неактивна в фосфорилированном виде. Кроме активации распада гликогена печени до глюкозы, в основе гипергликемического эффекта глюкагона лежит цАМФ-зависимое фосфорилирование ферментов гликолиза (фосфофруктокиназы и пирувакиназы) и пируватдегидрогеназы, что приводит к подавлению аэробного катаболизма глюкозы. Гормон стимулирует глюконеогенез за счет активации фруктозо-2,6-дифосфатазы путем цАМФ-зависимого фосфорилирования. Внутриклеточная концентрация эффектора гликолиза и глюконеогенеза - фруктозо-2,6-дифосфата снижается. Этот эффектор формируется из фруктозо-6-фосфата при действии изофермента фосфофруктокиназы. Фруктозо-2.6-дифосфат является активатором для фосфофруктокиназы гликолиза и ингибитором для фруктозо-1,6-дифосфотазы глюконеогенеза. Глюкагон – это гормон липолитического действия. Повышая содержание цАМФ в адипоцитах, он активирует гормончувствительную липазу. Образующиеся при этом в большом количестве жирные кислоты могут использоваться в качестве источников энергии или превращаться в кетоновые тела. Высвобождаемый в результате липолитического действия глюкагона на адипоциы глицерол активно захватывается гепатоцитами и используется в глюконеогенезе. Вторым важным метаболическим эффектом активации липолиза в жировой ткани и β-окисления ВЖК в печени является повышение уровней ацетилКоА. Скорость его окисления в ЦТК жестко контролируется эффекторами цикла Кребса, поэтому его «избыток» активирует пируваткарбоксилазу, запускающую глюконеогенез. Таким образом, глюкагон и инсулин являются антагонистами. В период голодания или при повышении энергозатрат он способствует перераспределению энергосубстратов. Глюкоза используется мозгом, а жирные кислоты и кетоновые тела – мышцами и другими инсулинзависимыми тканями. Инсулин – гормон β-клеток островков Лангерганса Инсулин — это гормон белково-пептидной природы. Он состоит из двух цепей: А-цепь содержит 21 аминокислоту, B-цепь — 30 аминокислот. Обе цепи связаны двумя дисульфидными связями. Инсулин человека отличается от инсулина свиньи только одной аминокислотой. Синтез и секрецияинсулина реализуются поэтапно (рис. 1). Повышение концентрации глюкозы крови является мощным стимулом к секреции инсулина. Инсулин образуется путем частичного протеолиза своего предшественника - препроинсулина. В результате наряду с самим гормоном формируется С-пептид. Оба продукта секретируются в кровь в эквимолярных количествах. Период полураспада инсулина в системном кровотоке составляет несколько минут, а С-пептида - около 30 минут. Поэтому в клинике определение уровней С-пептида используют в качестве показателя инсулиносекреторной функции поджелудочной железы. 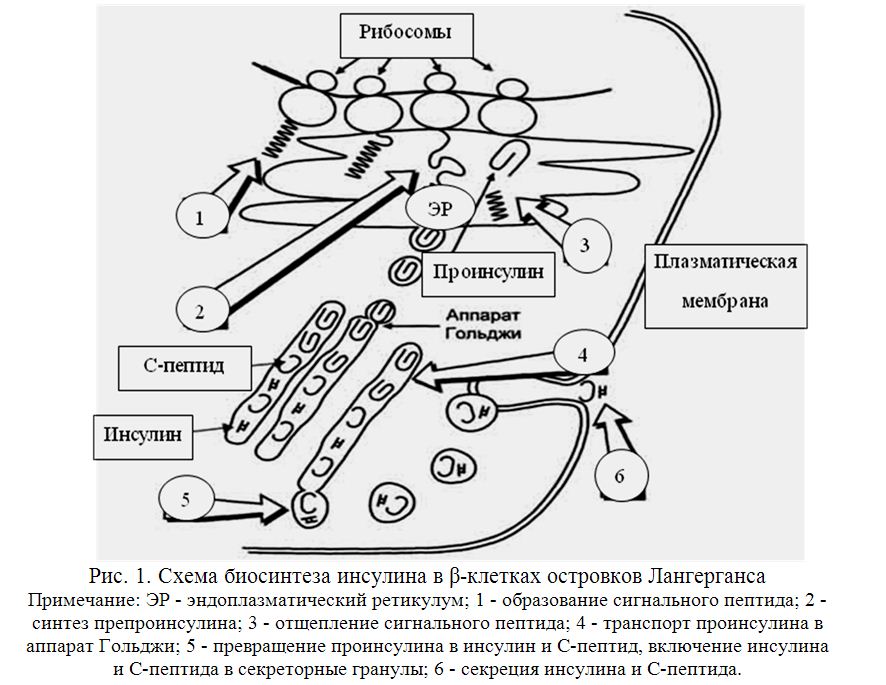 Основными мишенями считают скелетные мышцы, жировую ткань, печень. Реализация гормонального сигнала инсулина в тканях-мишенях затрагивает механизм, связанный с 1-ТМС- рецепторами Эффекты инсулина многообразны, причем они имеют временную зависимость: 1) очень быстрый ответ (секунды) включает ускорение транспорта глюкозы, аминокислот и калия в инсулинзависимые ткани; 2) быстрый эффект (минуты) заключается в стимуляции синтеза белков и торможении их распада; активации ферментов гликолиза и гликогенсинтазы, угнетении ферментов глюконеогенеза и фосфорилазы гликогена; активации ферментов липогенеза; 3) медленный эффект (часы) приводит к увеличению синтеза мРНК, ферментов липогенеза, пентозофосфатного цикла (ПФЦ), гликолиза, окислительного декарбоксилирования пирувата, цикла трикарбоновых кислот (ЦТК); 4) очень медленный ответ клеток (часы – дни) - стимулирует репликацию ДНК, деление клеток, активируя пролиферацию ткани (митогеный эффект). Последнее придает гормону свойства фактора роста. Механизмы повышения проницаемости мембран миоцитов и адипоцитов для глюкозы связаны со стимуляцией инсулином энергозависимого перемещения цитозольных везикул со специфическими белками-транспортерами глюкозы (ГЛЮТ4) к клеточной мембране и активным поглощением глюкозы. (Всего известно 5 типов тканеспецифичных ГЛЮТ). В результате в тканях-мишенях инсулина проницаемость мембран для глюкозы повышается в 15 – 20 раз. Быстрое воздействие на активность ферментов (минуты) происходит за счет активации фосфодиэстеразы цАМФ (фермента, катализирующего распад цАМФ, см. лекцию 2) и протеинфосфатаз, катализирующих дефосфорилирование регуляторных ферментов. За счет ковалентной модификации путем дефосфорилирования происходит активация синтетазы гликогена, фосфофруктокиназы и пируваткиназы гликолиза, пируватдегидрогеназного комплекса, β-ОМГ-КоА редуктазы в синтезе холестерола, а также ацетилКоАкарбоксилазы синтеза жирных кислот. Результирующий эффект влияния инсулина на обмен веществ сводится к накоплению углеводов, белков и липидов, что говорит о его универсальном анаболическом действии. Эффекты инсулина являются тканеспецифичными. 2. Сахарный диабет. Изменения метаболизма при сахарном диабете Комплекс нарушений, вызванных недостаточностью функций инсулина, называется сахарным диабетом (СД). Выделяют четыре клинических типа заболевания: 1. СД 1-го типа (аутоиммунный, идиопатический): причиной является деструкция клеток β-клеток поджелудочной железы и, как следствие, и абсолютный дефицит инсулина. 2. СД 2-го типа: характеризуется инсулинорезистентностью с относительным дефицитом инсулина, а затем секреторной недостаточностью β-клеток поджелудочной железы. 3. Другие типы, которые обусловлены такими факторами как генетические дефекты функции β-клеток или путей передачи гормонального сигнала (моногенные формы СД); патология экзокринного аппарата поджелудочной железы (панкреатопривный СД); другие эндокринопатии; а также индуцированный диабет (например, ксенобиотиками, в том числе лекарствами) и генетические синдромы с развитием СД (синдром Вольфрама). 4. Гестационный сахарный диабет (диабет беременных). Полная классификация СД насчитывает до 50 вариантов заболевания, ежегодно обновляясь, и публикуется на сайте Американской диабетической ассоциации (http:// care.diabetesjournals.org/cgi/reprint/31/Supplement_1/S55). Сахарный диабет характеризуется гипергликемией, глюкозурией, полиурией, полидипсией (повышенной жаждой), полифагией (повышенным аппетитом), постепенной потерей массы тела. Очень условно, но кратко можно сказать, что СД – это гипергликемия и 3 «П» (три «пэ»): полиурия, полидипсия и полифагия. По мере прогрессирования заболевания развиваются кетоз и ацидоз, которые нередко заканчиваются комой. Биохимические изменения при сахарном диабете связаны не только с недостаточной функцией инсулина, но и с избыточной секрецией глюкагона и глюкокортикоидов в ответ на дефицит инсулина. Вследствие гормональной дисгармонии нарушаются все виды обмена веществ. Избыток внеклеточной глюкозы при сахарном диабете сопровождается её внутриклеточным дефицитом. При этом происходит «голодание среди изобилия», уменьшается поступление аминокислот в мышцы, и увеличивается скорость липолиза. Следовательно, кроме гипергликемии в крови повышаются концентрации аминокислот, высших жирных кислот (ВЖК), глицерола. Нарушения углеводного обмена при сахарном диабете характеризуется следующими изменениями: происходят снижение проницаемости мембран и транспорта глюкозы в клетки; ингибирование запасания и активация распада глигогена; активация глюконеогенеза из аминокислот и глицерола. Гипергликемия, характерный признак сахарного диабета, заметно проявляется после еды. Поэтому после глюкозной нагрузки концентрация глюкозы в плазме крови больных сахарным диабетом значительно выше, чем у здоровых людей, а возвращение к ее начальному уровню проходит медленнее. Эти особенности используют для выявления скрытых форм нарушения обмена углеводов методом «сахарной нагрузки» (тест на толерантность к глюкозе или глюкозотолерантный тест (ГТТ). Через 2 часа после нагрузки глюкозой при скрытых формах СД или других эндокринопатиях, сопровождающихся нарушениями обмена углеводов и гипергликемией, уровень глюкозы выше исходного (снижение толерантности к глюкозе). Гипергликемия более 10 ммоль/л превышает реабсорбционные возможности почек и становится причиной глюкозурии. Выделение oсмотически активных молекул глюкозы влечет за собой потерю больших количеств воды (осмотический диурез). Кроме того, реабсорбция глюкозы в почках является энергозатратным процессом, а сахарный диабет характеризуется гипоэнергетическим состоянием. Потребности в энергии при сахарном диабете восполняются за счет усиленного катаболизма белков и липидов. Кроме активации катаболизма, нарушения обмена липидов при сахарном диабете характеризуются снижением синтеза жирных кислот и триацилглицеролов. В крови повышается концентрация ЛПОНП из-за снижения активности липопротеинлипазы капилляров. В результате усиленного бета-окисления высших жирных кислот в печени образуется большое количество ацетил-КоА – предшественника для синтеза кетоновых тел. Скорость образования кетоновых тел превышает возможности клеток по их использованию в цикле трикарбоновых кислот из-за дефицита оксалоацетата и аллостерического ингибирования ЦТК избытком НАДН2. Это приводит к постепенному развитию метаболического ацидоза. К дегидратации добавляются потери натрия и калия. Врачу важно знать, что при хронической гипергликемии уровень глюкозы в клетках, не являющихся мишенями для инсулина (нервной, соединительной тканей, глаз, почек), резко возрастает. Избыток внутриклеточной глюкозы не может быть метаболизирован, поэтому преобразовывается иными способами. Часть избыточной глюкозы под влиянием редуктазы восстанавливается в сорбитол, который может окислиться во фруктозу. Появление и накопление этих веществ (глюкозы, сорбитола, фруктозы) в избытке внутри клеток хрусталика и в нейронах грозит патологическим ростом осмотического давления (гипергидратацией). Это пусковые факторы развития катаракты, атрофии зрительного нерва, полинейропатии, ведущих к осложнениям СД. Длительная некоррегируемая лекарственными препаратами гипергликемия способствует неферментативному гликозилированию глюкозой белков. При этом нарушается структурная организация белка, что влечет за собой его дисфункцию. Например, гемоглобин (Нb), подвергаясь гликозилированию становится нефункциональным гликозилированным гемоглобином (HbA1С). В эритроцитах здорового человека может находиться до 6% гликозилированного Нb (HbA1с), у больных СД его содержание резко увеличено пропорционально эпизодам гипергликемии. Поэтому у пациентов с диабетом количественное определение гликозилированного гемоглобина служит маркером степени контролируемой гипергликемии, используется для оценки эффективности лечения. Повышение концентрации гликозилированного гемоглобина в крови приводит к развитию гемической гипоксии, снижению интенсивности тканевого дыхания и накоплению восстановленного НАДН2 в тканях организма. Восстановленный кофермент является ингибитором общих путей катаболизма углеводов, липидов и белков (ЦТК, окислительного декарбоксилирования пирувата). Поэтому эффективность аэробного катаболизма глюкозы падает, подавляется β-окисление ВЖК. Эти нарушения являются причиной гипоэнергетического состояния тканей. Метаболическим маркером этого являются уровни лактата в крови. Это связано стем, что пируват, образующийся в результате гликолиза, при избытке цитозольного НАДН2 может восстанавливаться в лактат в лактатдегидрогеназной реакции. Еще одним примером неферментативного гликозилирования может быть гликозилирование ЛПНП. Это нарушение снижает сродство липопротеинов к своим рецепторам на фибробластах, отвечающих за катаболизм ЛПНП. Накопление ЛПНП грозит не только развитием атеросклероза. Их мицеллы, агрегируя с эритроцитами, увеличивают толщину плазмолеммы последних, что приводит к уменьшению скорости диффузии кислорода и способствует гипоксии. Гликозилирование кристаллина и гликозамингликанов хрусталика повреждают его прозрачность (диабетическая катаракта). Подобная реакция с белками миелиновых оболочек усиливает их деградацию макрофагами, вызывая демиелинизацию нервных волокон (диабетическая нейропатии). При взаимодействии фибриногена с глюкозой замедляется скорость его гидролиза, развивается гиперкоагуляция (повышенное свёртывание крови). Сам инсулин тоже гликозилируется и, естественно, также меняются его свойства.  Нарушение про- и антиоксидантного равновесия при СД также обусловлены гипергликемией. При этом снижается активность антиоксидантных ферментов из-за их неферментативного гликозилирования. Из-за накопления продуктов перекисного окисления и окисленных ЛПНП активируется образование свободных радикалов. Активное потребление НАДФН2 в альдозоредуктазной реакции при трансформации глюкозы в сорбитол (полиоловый шунт), угнетение активности глюкозо-6-фосфатдегидрогеназы пентозофосфатного пути при ее окислительной модификации, ведут к нарушению восстановления угнетению глутатиона, необходимого для антирадикальной защиты. Поэтому у больных сахарным диабетом повышается уровень метаболитов перекисного окисления липидов (ПОЛ). Окислительный стресс, сопровождающийся значительным увеличением уровня свободных радикалов и приводящий к интенсификации ПОЛ, блокирует синтез белков и нуклеиновых кислот. При длительной декомпенсации гликемии гликозилирование белков становится необратимым. Такие белки быстрее разрушаются. Это ведет к формированию токсичных для клеток конечных продуктов неферментативного гликирования (КПГ), избыток которых также является фактором патогенеза хронических осложнений сахарного диабета. При сахарном диабете развивается белковая недостаточность, что проявляется в потере массы тела, снижении синтеза белков на фоне активации их катаболизма, а также отрицательным азотистым балансом. Концентрация свободных аминокислот и мочевины в крови больных сахарным диабетом повышены. В результате описанных нарушений могут развиваться острые или хронические осложнения СД. Наиболее опасные острые осложнения, ведущие при их декомпенсации к развитию соответствующих коматозных состояний: диабетический кетоацидоз; диабетический лактоацидоз; гиперосмолярная бескетонная кома; гипогликемическая кома. При развитии хронических осложнений важными факторами являются макро- и микроангиопатии. Первые характеризуются выраженным атерогенезом, осложняющемся ишемической болезнью сердца, либо инсультами. Микроангиопатиям подвержены сосуды сетчатой оболочки глаза и почек, что провоцирует развитие диабетических ретинопатии, нефропатии, полинейропатии. Эти процессы лежат в основе угрожающих жизни пациентов таких хронических осложнений СД как слепота, хроническая почечная недостаточность. 3. Гормоны ЖКТ: структура, биологическое действие 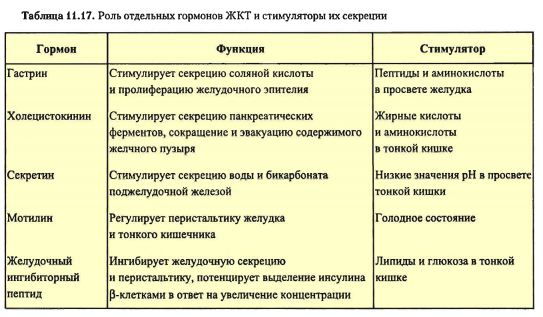   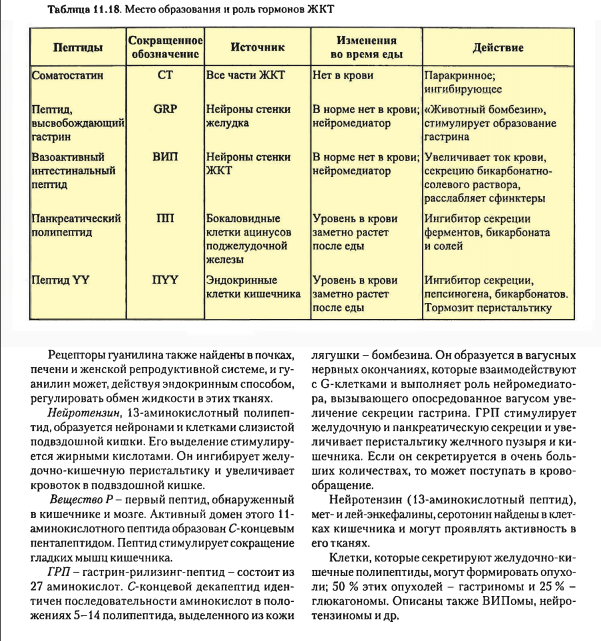 |
