задачи по химии. Государственное образовательное учреждение
 Скачать 410.9 Kb. Скачать 410.9 Kb.
|
Химическая кинетика и равновесие.Примеры наиболее важных расчетных задач. Пример 1. Вычисление скорости реакции по концентрациям реагирующих веществ. Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В – 5 моль/л. Константа скорости реакции равна 0,5 л2∙моль-2∙с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В. Решение. Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере V = к [А]2 [В] Скорость реакции в начальный момент равна V1 = 0,5∙62∙5 = 90,0 моль∙с-1∙л-1. По истечении некоторого времени останется 45% В, т.е. 5∙0,45 = 2.25 моль/л. Значит концентрация В уменьшилась на 5 – 2,25 = 2,75 моль/л. Так как вещества А и В взаимодействуют в соотношении 2:1, то концентрация А уменьшилась на 5,5 моль/л (2,75∙2) и стала равной 0,5 моль/л (6-5,5). Следовательно, V2 = 0,5 (0,5)2∙2,25 = 0,28 моль∙с-1∙л-1. Пример 2. Определение изменения скорости реакции при изменении температуры. Вычислите, во сколько раз возрастает скорость реакции при увеличении температуры на 400С, если температурный коэффициент этой реакции равен 3. Решение. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа, согласно которому при увеличении температуры на 100 скорость реакции увеличивается в 2-4 раза. Число, показывающее, во сколько раз увеличивается скорость химической реакции при повышении температуры на 100, называют температурным коэффициентом γ. Математически правило Вант-Гоаффа можно выразить так: 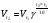 В данном примере 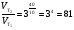 Пример 3. Вычисление времени протекания реакции при изменении температуры. При 353 К реакция заканчивается за 20 с. Сколько времени длится реакция при 293 К, если температурный коэффициент равен 2. Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость 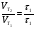 , где t1 и t2 - время протекания реакции при температурах Т1 и Т2. , где t1 и t2 - время протекания реакции при температурах Т1 и Т2.Правило Вант-Гоффа в данном случае можно записать в виде –  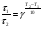 , , откуда откуда 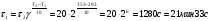 Пример 4. Определение температурного коэффициента реакции. Найдите температурный коэффициент скорости некоторой реакции, если константа скорости этой реакции при 413 К равна 4,5×10-4л×моль-1×с-1 а при 453 К - 9×10-3л×моль-1×с-1. Решение. Температурный коэффициент реакции определяют, пользуясь правилом Вант-Гоффа: 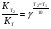 ; ; 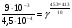 = g4 = g420 = g4; 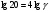 ; ; 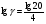 g = 2,115 Пример 5. Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций. Равновесие реакции А + 3ВÛ2С установилось при следующих концентрациях реагирующих веществ (моль/л): [А] = 2,5; [В] = 1,8; [С] = 3,6. Рассчитайте константу равновесия этой реакции и исходные концентрации А и В. Решение. Определяем константу равновесия Кр этой реакции 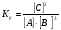 = = 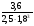 = 0,89 = 0,89Исходные концентрации А и В находим на основе уравнения реакции. На образование 2 моль С расходуется 1 моль А, а на образование 3,6 моль С потребовалось 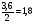 моль А. Учитывая равновесную концентрацию А, находим его исходную концентрацию: [А]исх = 2,5 + 1,8 = 4,3 моль/л. На образование 2 моль С необходимо 3 моль В, а для получения 3,6 моль С требуется 3×3,6/2 = 5,4 моль В; [В]исх = 1,8 + 5,4 = 7,2 моль/л. моль А. Учитывая равновесную концентрацию А, находим его исходную концентрацию: [А]исх = 2,5 + 1,8 = 4,3 моль/л. На образование 2 моль С необходимо 3 моль В, а для получения 3,6 моль С требуется 3×3,6/2 = 5,4 моль В; [В]исх = 1,8 + 5,4 = 7,2 моль/л.Пример 6. Вычисление равновесных концентраций реагирующих веществ. Реакция протекает по уравнению А + В Û 2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия – 50 . Решение. К моменту наступления равновесия концентрации веществ А и В понизятся, а концентрация С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому если понижение концентрации веществ А и В обозначить через х моль, то увеличение концентрации вещества С будет равно 2х моль. Равновесные концентрации реагирующих веществ будут: [А]р = (0,5 - х)моль/л; [В]р = (0,7 – х) моль/л; [С]р = 2х моль/л. 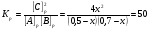 46х2- 60х + 17,5 = 0; Решая это уравнение, получаем х1 = 0,86; х2 = 0,44. По условию задачи справедливо значение х2. Отсюда: [А]р = 0,5 – 0,44 = 0,06 моль/л; [В]р = (0,7 – 0,44) = 0,26 моль/л; [С] = 2∙0,44 = 0,88 моль/л. Пример 7. Влияние изменения концентрации реагирующих веществ на смещение равновесия. Реакция протекает по уравнению 4А + В → 2С + 2Д В каком направлении сместится химическое равновесие, если концентрацию всех реагирующих веществ увеличить в 2 раза. Решение. Первоначальные скорости прямой и обратной реакций были следующие: V→= К1 [А]4[В] ; V← = К2[С]2[Д]2 После увеличения концентраций: V1→ = К1[2А]4[2В] = 32К1[А]4[В] V1← = К2[2С]2[2Д]2 = 16К2[С]2[Д]2 т.е. скорость прямой реакции возросла в 32 раза, а скорость обратной – в 16 раз. Следовательно, равновесие сместится вправо (в сторону прямой реакции). Пример 8. Влияние изменения температуры на смещение химического равновесия. В какую сторону сместится химическое равновесие реакции АВ А + В, если повысит температуру на 300? Температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 3. Решение. При повышении температуры на 300. Скорость прямой реакции возрастает 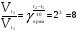 , а скорость обратной ─ , а скорость обратной ─ 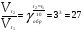 Таким образом, равновесие сместится влево, так как скорость обратной реакции возрастет в 27 раз, а прямой в 8 раз. Пример 9. Влияние изменения давления на смещение химического равновесия. Равновесие реакции 2А(г) + В(г)2АВ(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [А] = 0,5; [В] = 0,7;[АВ] = 2,1. Как изменятся скорости прямой и обратной реакций, если в системе уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Решение. До уменьшения давления в системе выражения для скоростей прямой и обратной реакций: V→ = К1[А]2[В] = К1[0,5]2[0,7] = 0,175 К1 V← = К2[АВ]2 = К2[2,1]2 = 4,41 К2 При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшится в 2 раза. Тогда V1→ = К1 (0,5/2)2(0,7/2) = 0,0219 К1; V1← = К2(2,1/2)2 = 1,1015 К2. В результате уменьшения давления скорости прямой и обратной реакций уменьшились: 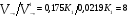 ; ; 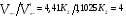 Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой смещение равновесия произойдет справа налево, то есть в сторону разложения АВ. Пример 10. Вычисление равновесных концентраций реагирующих веществ после смещения равновесия. Химическое равновесие реакции А + В С + Д установилось при следующих концентрациях реагирующих веществ (моль/л): [А] = 7,[В] = 5, [С] = 10, [Д] = 14. Равновесие системы было нарушено из-за уменьшения концентрации [Д] до 11 моль/л. Вычислите, какими стали новые равновесные концентрации реагирующих веществ после сдвига равновесия. Решение. Из условия задачи видно, что при уменьшении концентрации Д равновесие системы сместится вправо. Это вызовет уменьшение концентраций А и В и увеличение концентраций С и Д. Все вещества в этой реакции реагируют в одинаковом соотношении, поэтому изменение всех концентраций обозначим через х моль/л. Тогда новые равновесные концентрации: [А]р = 7 – х; [В]р = 5 – х; [С]р = 10 + х; [Д]р = 11 + х. Константа равновесия данной реакции 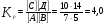 После смещения равновесия: После смещения равновесия: 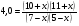 ; х2 23х + 10 = 0; х = 0,44моль/л. Отсюда: [А]р = 6,65 моль/л; [В]р = 4,56 моль/л; [С]р = 10,44 моль/л; [Д] = 11,44 моль/л. ; х2 23х + 10 = 0; х = 0,44моль/л. Отсюда: [А]р = 6,65 моль/л; [В]р = 4,56 моль/л; [С]р = 10,44 моль/л; [Д] = 11,44 моль/л.Задания Вариант 3.1.
NO2 = 0,06; NO = 0,24 моль/л, О2 = 0,12 моль/л. Чему равна константа равновесия системы 2NO2 = 2NO + O2.
Вариант 3. 2.
Вариант 3. 3.
2NO + Cl22NOCl(г); 2Fe(к) + 3Cl2(г) 2FeCl3(к)
а) N2 + 3H22NH3; б) 2Fe(к) + 3Cl2(г)2FeCl3(к)
Вариант 3.4.
2Na2CO3(к) + СО2 + Н2О(г) 2NaHCO3 (к); 2NOCl (г) 2NO + Cl2
а) H2(г) + S(к)  H2S(г); б) Са(ОН)2(к)СаО(к) + Н2О(г) H2S(г); б) Са(ОН)2(к)СаО(к) + Н2О(г)
Вариант 3. 5.
2Cr(к) = 3Сl2(г) 2СrCl3(к); 3C2H2 C6H6
А + В=С +Д. После установления равновесия [Д] = 1,5 моль/л. Вычислите К равновесия.
Вариант 3.6.
2HJ(г) H2 (г) +J2 (г) 2S(к) +2H2O(г) 2H2S(г) +O2
N2O5 N2O4 + 1/2О2 при 298 К равна 2,0310-3лмоль-1с-1, а при 288 К равна 4,7610-4лмоль-1 с-1. Найдите температурный коэффициент скорости реакции.
Na2CO3(к) + CO2(г) + H2O(пар)  2NaHCO3(к) 2NaHCO3(к)
СО + Н2О = СО2 + Н2 8. Определить число степеней свободы в системе Na2CO3(к) + СО2 + Н2О(пар) = 2NaHCO3(к) |
