|
|
задачи по химии. Государственное образовательное учреждение
Растворы
Примеры наиболее важных расчетных задач
Пример. 1. Массовая доля растворенного вещества.
Определите массовую долю (%) хлорида калия в растворе, содержащем 53 г KCl в 0,5 л раствора, плотность которого 1,063 г/л.
Решение. Массовая доля 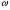 показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах: показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
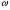 = 100 = 100 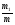 ; где ; где 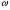 − массовая доля (%) растворенного вещества; m1 – масса растворенного вещества, г; m – масса раствора, г. Масса раствора равна произведению объема раствора V на его плотность ρ − массовая доля (%) растворенного вещества; m1 – масса растворенного вещества, г; m – масса раствора, г. Масса раствора равна произведению объема раствора V на его плотность ρ
M = ρV, тогда: 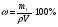 . Массовая доля хлорида калия в растворе: . Массовая доля хлорида калия в растворе: 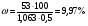
Пример 2. Молярная концентрация раствора.
Какова масса NaOH, содержащегося в 0,2 л раствора, если моляраня концентрация раствора 0,2 моль/л?
Решение. Молярная концентрация (молярность) раствора показывает число молей растворенного вещества, содержащихся в 1 л раствора. Молярную концентрацию (моль/л) выражают формулой
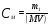 , где m1 – масса растворенного вещества, г; М – его молярная масса, г/моль; V – объем раствора, л. М(NaOH) = 40 г/моль. Масса NaOH, содержащегося в растворе, равна , где m1 – масса растворенного вещества, г; М – его молярная масса, г/моль; V – объем раствора, л. М(NaOH) = 40 г/моль. Масса NaOH, содержащегося в растворе, равна
m1 = СМ ∙ М∙V = 0,2∙40∙0,2 = 1,6 (г).
Пример 3. Молярная концентрация эквивалента.
Определите молярную концентрацию эквивалента хлорида железа (Ш), если в 0,3 л раствора, содержится 32,44 г FeCl3.
Решение. Молярная концентрация эквивалента (нормальность раствора) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора 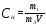 ; где m1 – масса растворенного вещества, г; mэ – молярная масса эквивалента растворенного вещества, г/моль; V - объем раствора, л. ; где m1 – масса растворенного вещества, г; mэ – молярная масса эквивалента растворенного вещества, г/моль; V - объем раствора, л. 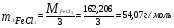
Молярная концентрация эквивалента FeCl3 равна 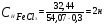
Пример 4. Определите титр 0,01 н КОН.
Решение. Титр раствора показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. 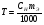 , где Т – титр раствора, СН – молярная концентрация эквивалента, mЭ – молярная масса эквивалента растворенного вещества. , где Т – титр раствора, СН – молярная концентрация эквивалента, mЭ – молярная масса эквивалента растворенного вещества. 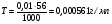 . .
Пример 5. Для нейтрализации 28 мл H2SO4 потребовалось прибавить 14 мл 0,3 н щелочи. Определите нормальность кислоты.
Решение. Поскольку вещества взаимодействуют в эквивалентных количествах, то можно написать 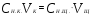 , где , где 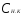 и и 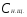 − нормальность кислоты и щелочи; − нормальность кислоты и щелочи; 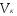 и и 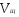 - соответствующие объемы. - соответствующие объемы.
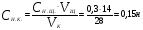 . .
Пример 6. Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы С6Н12О6 при 00С.
Решение. Осмотическое давление раствора определяют согласно закону Вант-Гоффа: 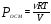 , где ν – количество растворенного вещества, моль; V – объем раствора, м3; R – молярная газовая постоянная, равная 8,31 Дж/(моль∙К). В 1,4 л раствора содержится , где ν – количество растворенного вещества, моль; V – объем раствора, м3; R – молярная газовая постоянная, равная 8,31 Дж/(моль∙К). В 1,4 л раствора содержится 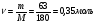 глюкозы. М - молярная масса глюкозы. Осмотическое давление этого раствора: глюкозы. М - молярная масса глюкозы. Осмотическое давление этого раствора:
РОСМ = 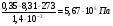 . .
Пример 7. Определение температуры кипения и замерзания раствора неэлектролита.
Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола С6H5NO2 в 10 г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 5,10С. Температура кипения чистого бензола 80,20С, температура замерзания -5,40С.
Решение. По закону Рауля следует, что 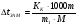 ; ; 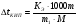 , где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора, Кк и КЭ – криоскопическая и эбуллиоскопическая константы; m – масса растворенного вещества, г; М – его молярная масса, m1 – масса растворителя, г. , где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора, Кк и КЭ – криоскопическая и эбуллиоскопическая константы; m – масса растворенного вещества, г; М – его молярная масса, m1 – масса растворителя, г.
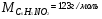 ; ;
∆tкип = 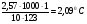 ; tкип = 80,2 + 2,09 = 82,290C; ∆tзам = ; tкип = 80,2 + 2,09 = 82,290C; ∆tзам = 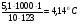 ; ∆tзам = 5,4 – 4,14 = 1,2600С. ; ∆tзам = 5,4 – 4,14 = 1,2600С.
Пример 8. Вычисление изотонического коэффициента раствора сильного электролита по осмотическому давлению раствора.
Осмотическое давление 0,1 н ZnSO4 при 00С равно 1,59∙105 Па. Вычислите изотонический коэффициент этого раствора.
Решение. Изотонический коэффициент i показывает, во сколько раз значение осмотического давления Росм, повышения температуры кипения ∆t’кип (или понижения температуры замерзания ∆t’зам ) найденные экспериментально, больше соответствующих значений (Росм, ∆tкип, ∆tзпм.) для растворов неэлектролитов при той же молярной концентрации. 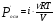 , отсюда , отсюда 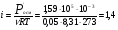 . 0,1 н ZnSO4 соответствует 0,05 М ZnSO4. . 0,1 н ZnSO4 соответствует 0,05 М ZnSO4.
Пример 9. Вычисление кажущейся степени диссоциации по значению изотонического коэффициента.
Изотонический коэффициент 0,2 н раствора нитрата кальция равен 2,48. Вычислите кажущуюся степень диссоциации этого электролита.
Решение. В случае сильных электролитов кажущуюся степень диссоциации определяют экспериментально, она всегда меньше истинной степени диссоциации, которая близка к единице. Степень диссоциации и изотонический коэффициент связаны между собой соотношением 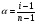 , где n – число ионов, образующихся при диссоциации молекулы электролита. При диссоциации Ca(NO3)2 образуется три иона. , где n – число ионов, образующихся при диссоциации молекулы электролита. При диссоциации Ca(NO3)2 образуется три иона. 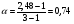 (или 74 %). (или 74 %).
Пример 10. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации LiCl в 0,1 М растворе соли, если этот раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 00С.
Решение. Моль сахара равен 342,3 г. Осмотическое давление 0,19 М раствора сахара равно 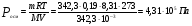 . .
М(LiCl) = 42,39 (г/моль). По осмотическому давлению определяем изотонический коэффициент раствора LiCl.
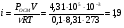
Кажущаяся степень диссоциации в 0,1 М LiCl равна
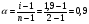 (или 90 %). (или 90 %).
Пример 11. Вычисление степени диссоциации электролита по понижению температуры замерзания его раствора.
Температура замерзания водного раствора, содержащего 0,25 моль HNO3 в 2,5 л воды, равна -0,350С. Рассчитайте кажущуюся степень диссоциации кислоты (КК для воды 1,860С).
Решение. Молярная масса HNO3 равна 63. Из второго закона Рауля для электролитов находим значение изотонического коэффициента: 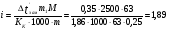 . Кажущаяся степень диссоциации HNO3 в этом растворе равна . Кажущаяся степень диссоциации HNO3 в этом растворе равна 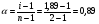 (или 89 %). (или 89 %).
Пример 12. Вычисление водородного показателя раствора.
Вычислите водородный показатель рН раствора, если концентрация ионов ОН- равна 10-5 моль/л.
Решение. Исходя из ионного произведения воды 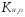 , находим концентрацию ионов Н+: , находим концентрацию ионов Н+: 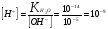 (моль/л). (моль/л).
Водородный показатель раствора равен: рН = -lg [H+] = -lg 10-9 = 9
Задания
Вариант 4.1.
Для нейтрализации некоторого объема H2SO4 израсходовано 24,2 мл 0,1 н раствора щелочи. Вычислить, сколько граммов Н2SO4 было в растворе.
Чему равна молярность и нормальность 20 %-ного раствора H2SO4
(ρ = 1,14 г/мл)?
Определите температуру кипения водного раствора глюкозы, если массовая доля С6Н12О6 равна 10 %.
Изотонический коэффициент 0,2 М NaOH равен 1,8. Вычислите осмотическое давление этого раствора при 100С.
Напишите выражения для произведения растворимости солей Ba3(PO4)2, Ag2SO4.
Составьте по три молекулярных уравнения реакций к каждому из молекулярно-ионных:
а) Са2+ + СО32- = СаСО3↓; б) СО32- + 2Н+ = СО2 + Н2О
Определите концентрации ионов Н+ и ОН- в растворах, водородный показатель которых равен: 3; 9. Во сколько раз концентрации ионов Н+ больше или меньше концентрации ионов ОН-.
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде: а) сульфида калия, б) сульфата меди. Определите реакцию среды растворов этих солей. Определите направление смещения равновесия при добавлении в эти растворы HCl.
Вариант 4. 2.
На нейтрализацию 5,0 мл КОН раствора потребовалось 100 мл 6 %-ного раствора HCl (ρ = 1,028 г/мл). Вычислите нормальность раствора КОН.
В 12 л 3 М раствора содержится 1440 г вещества. Найти молекулярную массу растворенного вещества.
Рассчитайте осмотическое давление раствора неэлектролита, содержащего 1,52∙1023 молекул его в 0,5 л раствора при 300С.
Раствор, содержащий 16,5 г Ba(NO3)2 в 500 г воды, кипит при 100,1220. рассчитайте изотонический коэффициент этого раствора.
Напишите выражение для произведения растворимости солей CuS и Ag3PO4.
Вычислите водородный показатель (рН) раствора, если концентрация ионов ОН- равна: 0,001 моль/л; 0,017 г/л.
Составьте молекулярные и молекулярно-ионные уравнения гидролиза: а) фосфата натрия, б) хлорида алюминия. Укажите рН растворов этих солей. Определите направление смещения равновесия при добавлении в эти растворы NaOH.
Подтвердите уравнениями реакций в молекулярной и молекулярно-ионной форме амфотерность гидроксида алюминия.
Вариант 4. 3.
На титрование 10 мл раствора HCl пошло 15 мл 0,5 н раствора щелочи. Вычислить: а) нормальность раствора HCl; б) титр раствора.
Сколько граммов FeCl3 надо взять для приготовления 1 л 0,1 н раствора?
Раствор, содержащий 0,162 г серы в 20 г бензола, кипит при температуре на 0,0810 выше, чем чистый бензол. Рассчитайте молекулярную массу серы в растворе, Сколько атомов содержится в одной молекуле серы?
Вычислите кажущуюся степень диссоциации MgCl2 в водном растворе
(ω = 0,5 %) с плотностью 1000 кг/м3, если при 180С осмотическое давление этого раствора равно 3,2 ∙ 105 Па.
Напишите выражения для произведений растворимости солей Mg3(PO)2, PbCl2.
рН растворов равен 2; 12. Определите концентрации ионов Н+ и ОН- в этих растворах. Во сколько раз концентрации ионов Н+ больше или меньше концентрации ионов ОН-?
Можно ли приготовить раствор, содержащий одновременно пары веществ: а) Zn(OH)2 + KOH; б) Ba(OH)2 + HCl; в) Fe(OH)3 + NaOH. Представьте возможные реакции в молекулярном и молекулярно-ионном виде.
Напишите ионно-молекулярные и молекулярные уравнения гидролиза солей: а) CuCl2; б) Cs2CO3 . Какое значение рН имеют растворы этих солей? К раствору CuCl2 добавили NaOH. Усилится или уменьшится гидролиз CuCl2. Почему?
Вариант 4. 4.
К 100 г 20 %-ного раствора сахара добавили 300 г воды. Какой процентной концентрации получился раствор?
Сколько мл 96 % H2SO4 (ρ = 1,84 г/мл) нужно взять для приготовления 500 мл: а) 0,05 М раствора; б) 0,05 н раствора?
Чему равно осмотическое давление раствора неэлектролита, содержащего 0,2 моля вещества в 100 мл раствора при 250С? R = 8,31 Дж/моль.
При какой температуре будет кипеть раствор Na2SO4, содержащий 0,4 моля вещества в 100 г Н2О? КЭ = 0,52, кажущаяся степень диссоциации соли равна 0,9.
Напишите выражения для произведений растворимости солей Ag2CO3, MgCO3.
Вычислите рН раствора, если концентрация ионов ОН- равна:
а) 10-5моль/л; б) 0,00017 г/л.
Напишите уравнения реакций гидролиза солей в молекулярном и молекулярно-ионном виде: а) сульфата алюминия, б) ацетата натрия. Определите реакцию среды. Определите направление смещения равновесия для каждого случая при добавления в систему: а) ионов Н+, б) ионов ОН-.
Подтвердите уравнениями реакций в молекулярном и молекулярно-ионном виде амфотерность гидроксида цинка.
Вариант 4. 5.
К 250 мл 46 %-ной HNO3 (ρ = 1,29 г/мл) добавили 360 мл воды. Вычислите процентную концентрацию полученного раствора HNO3.
Чему равна молярность 38 % раствора HCl (α = 1,91 г/мл).
Определите осмотическое давление раствора, содержащего 90,08 г глюкозы С6Н12О6 в 4 л раствора при 270С.
При какой температуре будет замерзать раствор, содержащий 0,3 моля KCl в 100 г Н2О? ККР = 1,86, кажущаяся степень диссоциации соли равна 0,8.
Напишите выражения для произведения растворимости солей BaSO4 и Ca3(PO4)2.
Смешивают попарно растворы:
а) NaOH и KCl; б) CuCl2 и Ca(OH)2 в) HCOONa и H2SO4. В каких случаях реакции практически пойдут до конца? Составьте для этих реакций молекулярные и молекулярно-ионные уравнения.
Определите концентрации ионов Н+ и ОН- в растворах, водородный показатель которых равен: 6; 11. Во сколько раз концентрация ионов Н+ больше или меньше концентрации ионов ОН- в этих растворах?
Напишите уравнения реакций гидролиза солей в молекулярном и молекулярно-ионном виде: а) карбоната калия, б) хлорида хрома(III). Определите реакцию среды (рН). К раствору К2СО3 добавили КОН. Усилится или уменьшится гидролиз. Почему?
Вариант 4. 6.
В 164 г воды растворили 28,6 г соды Na2CO3. Какова процентная концентрация соды в этом растворе?
На нейтрализацию 25 мл раствора H2SO4 потребовалось 22,5 мл 0,152 н раствора едкого натра. Определите нормальность кислоты.
При какой температуре будет кипеть и замерзать раствор неэлектролита, содержащий 0,04 моля вещества в 200 г воды? ККР = 1,86; КЭ = 0,52.
Чему равно осмотическое давление раствора CaCl2, содержащего 0,4 моля вещества в 300 мл раствора при 250С? R = 8,31 Дж/моль∙К, кажущаяся степень диссоциации соли равна 0,95.
Напишите выражения для произведений растворимости солей PbCl2, Fe3(PO4)2.
Рассчитайте рН растворов, если концентрация ионов ОН- равна:
10-7моль/л; 0,17 г/л.
Напишите уравнения реакций гидролиза солей в молекулярном и молекулярно-ионном виде; а) Na2SiO3, б) ZnSO4. Определите реакцию среды (рН). В каком случае гидролиз силиката натрия усилится: а) при добавлении NaOH; б) при добавлении HCl. Почему?
Подтвердите уравнениями в молекулярном и молекулярно-ионном виде амфотерность гидроксида свинца (II).
Вариант 4. 7.
Какой объем 0,1 н HNO3 можно приготовить из 0,7 л раствора азотной кислоты с массовой долей 30 % (ρ = 1180 кг/м3)?
К 0,10 л раствора хлорида бария с массовой долей BaCl2 20%
(ρ =1203 кг/м3) прибавлен раствор сульфата хрома (III). Вычислите массу образовавшегося осадка BaSO4.
Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 250С было равно 2,47 кПа?
R = 8,31Дж/моль∙К.
При какой температуре будет кипеть раствор NaCl, содержащий 0,5 моля вещества в 1 л воды? КЭ = 0,52, кажущаяся степень диссоциации соли равна 0,85.
Напишите выражения для произведения растворимости солей BaCO3, Ag2CrO4.
рН растворов равен 7; 10. Определите концентрации ионов Н+ и ОН-. Во сколько раз концентрация ионов OH- больше или меньше концентрации ионов Н+ в этих растворах?
Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) NaOH + Ca(OH)2; б) Sn(OH)2
+NaOH; в) Sn(OH)2 + HNO3. Представьте возможные реакции в молекулярном и молекулярно-ионном виде.
Напишите уравнения реакций гидролиза солей: а) нитрата цинка, б) карбоната натрия. Определите реакцию среды (рН). В каком случае гидролиз нитрата цинка усилится: а) при добавлении КОН; б) при добавлении HCl. Почему?
Вариант 4. 8.
Чему равна молярность и нормальность 20 % раствора серной кислоты (ρ = 1,14 г/мл).
На нейтрализацию 25 мл раствора H2SO4 потребовалось 22,5 мл н раствора едкого натра. Определите нормальность кислоты.
Определите температуру кипения раствора 1 г нафталина С10Н8 в 20 г эфира, если температура кипения эфира равна 35,600С и КЭ = 2,160С.
Осмотическое давление 0,05 М NaOH при 100С равно 1,6 ∙ 105Па. Вычислите изотонический коэффициент этого раствора.
Напишите выражения для произведений растворимости солей AgCl и AgCO3.
Составьте по два молекулярных уравнения реакций к каждому из молекулярно-ионных уравнений: а) Be(OH)2 + 2OH- = [Be(OH)4]2- ; б) NH4+ + OH- = NH3 + H2O
Рассчитайте рН растворов, если концентрация ионов ОН- равна: 10-3 моль/л; 0,00017 г/л.
Напишите уравнения реакций гидролиза солей в молекулярном и молекулярно-ионном виде: MgCl2, Na2S. Определите смещение равновесия для каждого случая при добавлении в систему : а) ионов Н+; б) ионов ОН-.
Вариант 4. 9.
К 250 мл 46 %-ной HNO3 пл. 1,29 г/мл добавили 360 мл воды. Вычислите процентную концентрацию полученного раствора HNO3.
Сколько и какого вещества останется в избытке, если к 75 мл 0,3 н раствора H2SO4 прибавить 125 мл 0,2 н раствора КОН?
Найдите осмотическое давление при 00С для раствора, содержащего в 1 л 18,4 г глицерина С3Н8О3.
При какой температуре будет замерзать раствор электролита, содержащий 0,1 моль Na2CO3 в 100 г воды? ККР = 1,860С, кажущаяся степень диссоциации – 0,8.
Напишите выражение для произведения растворимости солей BaCO3, Ag2S.
Определите концентрации ионов Н+ и ОН- в растворах, водородный показатель которых равен: 2; 13. Во сколько раз концентрация ионов Н+ больше или меньше концентрации ионов ОН- в этих растворах?
Напишите уравнения реакций гидролиза солей FeCl2 и Na2CO3 в молекулярном и молекулярно-ионном виде. При смешивании растворов этих солей каждая гидролизуется необратимо до конца. Составьте уравнение реакции.
Подтвердите уравнениями реакций в молекулярном и молекулярно-ионном виде амфотерность гидроксида олова (II).
Вариант 4.10.
Сколько граммов безводного сульфата натрия надо взять для приготовления 1 л 0,1 н раствора; для приготовления 1 л 1 М раствора?
К 100 г 20 % раствора сахара добавили 300 г воды. Какой процентной концентрации получился раствор?
Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,2960С. Криоскопическая константа 5,10. Вычислите молярную массу растворенного вещества.
Осмотическое давление 0,125 М раствора КВr равно 5,63 ∙105 Па при 250С. Вычислите кажущуюся степень диссоциации этой соли в растворе.
Напишите выражения для произведения растворимости солей CuCrO4, MgCO3.
Какие из веществ ─ Al(OH)3; H2SO4; Ba(OH)2 ─ взаимодействуют с гидроксидом калия? Выразите эти реакции молекулярными и молекулярно-ионными уравнениями.
Рассчитайте рН растворов в которых концентрация ионов Н+ равна 10-4 моль/л; концентрация ионов ОН- равна 10-8 моль/л.
Напишите уравнения реакций гидролиза солей K2SO3 и CdSO4 в молекулярном и молекулярно-ионном виде. Укажите реакцию среды (рН). Определите смещение равновесия для каждого случая при добавлении в систему ионов Н+, при разбавлении.
Вариант 4.11.
В 164 г воды растворили 28,6 г соды Na2CO3. Какова процентная концентрация Na2CO3?
Для нейтрализации 30 мл 0,1 н раствора щелочи потребовалось 12 мл раствора кислоты. Определите нормальность кислоты.
Чему равно осмотическое давление раствора неэлектролита, содержащего 0,2 моля вещества в 200 мл раствора при 120С?
Раствор, содержащий 2,1 г КОН в 250 г воды, замерзает при – 0,5190С. Найдите для этого раствора изотонический коэффициент.
Напишите выражения для произведения растворимости солей CuS, Ag3PO4.
Определите концентрации ионов Н+ и ОН- в растворах водородный показатель которых равен: 1; 14. Во сколько раз концентрация ионов Н+ в первом растворе больше или меньше, чем во втором.
Напишите уравнения реакций гидролиза солей Al(NO3) и K2CO3 в молекулярном и молекулярно-ионном виде. При смешивании этих солей, каждая из них гидролизуется необратимо до конца. Выразите этот совместный гидролиз в молекулярном и молекулярно-ионном виде.
Подтвердите уравнениями реакций в молекулярном и молекулярно-ионном виде амфотерность гидроксида хрома (Ш).
Вариант 4. 12.
В каком количестве молей следует растворить 50 г H2SO4 для получения 10 %-ного раствора?
На нейтрализацию 40 мл раствора щелочи пошло 24 мл 0,5 н раствора серной кислоты. Какова нормальность раствора щелочи?
Сколько граммов сахарозы С12Н22О11 надо растворить в 100 г воды, чтобы: а) понизить температуру замерзания на 1 градус? б) повысить температуру кипения на 1 градус?
При 00С осмотическом давление 0,1 н раствора карбоната калия равно 272,6 кПа. Определите кажущуюся степень диссоциации К2СО3 в растворе.
Напишите выражения для произведений растворимости солей PbS, Fe2S.
Рассчитайте рН растворов в которых концентрация ионов ОН- :
10-2 моль/л; 0,0000017 г/л.
Составьте молекулярные и молекулярно-ионные уравнения реакций взаимодействия в растворах между:
а) CuS4O и H2S; б) BaCO3 и HNO3; в) Pb(OH)2 и NaOH.
Напишите уравнения реакций гидролиза солей Na2S и Pb(NO3)2 в молекулярном и молекулярно-ионном виде. Укажите реакцию среды (рН). Определите направление смещения равновесия для каждого случая при: добавлении в систему ионов Н+; добавлении в систему ионов ОН-.
Вариант 4.13.
Сколько граммов KCl следует добавить к 450 г 8%-ного раствора той же соли для получения 12 %-ного раствора?
Сколько литров 0,1 н раствора AgNO3 необходимо для обменной реакции с 0,5 л 0,3 н раствора AlCl3?
Раствор, в 100 мл которого находится 2,30 г вещества, обладает при 298 К осмотическим давлением равным 618,5 кПа. Определите молекулярную массу вещества.
Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при – 0,130С. Вычислите кажущуюся степень диссоциации соли.
Напишите выражения для произведений растворимости солей CrPO4, MnSiO3.
Определите концентрации ионов Н+ и ОН- в растворах водородный показатель которых равен: 4; 10. Во сколько раз концентрация ионов ОН- в первом растворе меньше или больше, чем во втором.
Напишите уравнения реакций гидролиза солей CdSO4 и KCN в молекулярном и молекулярно-ионном виде. Укажите реакцию среды (рН). Определите направление смещения равновесия при добавлении к раствору CdSO4 гидроксида натрия, а раствору KCN соляной кислоты.
Подтвердите уравнениями реакций в молекулярном и молекулярно-ионном виде амфотерность гидроксида олова (IV).
Вариант 4. 14.
Плотность 15 % раствора H2SO4 равна 1,105 г/см3. Вычислите:
а) нормальность, б) молярность раствора.
Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 8 мл NaOH. Сколько граммов NaOH содержит 1 л этого раствора.
При какой приблизительно температуре будет кипеть 50 % раствор сахарозы С12Н22О11?
Кажущаяся степень диссоциации хлорида калия в 0,1 М растворе равна 0,80. Чему равно осмотическое давление этого раствора при 170С?
Напишите выражения для произведения растворимости соединений PbJ2, Mg(OH)2.
Рассчитайте рН растворов в которых: а) концентрация ионов Н+ равна 0,00001 моль/л; б) концентрация ионов ОН- равна 0,00000017 г/л.
Составьте молекулярные и молекулярно-ионные уравнения реакций взаимодействия в растворах между:
а) Be(OH)2 и NaOH; б) Cu(OH)2 и HNO3; в) ZnOHNO3 и HNO3.
Напишите уравнения реакций гидролиза солей сульфата хрома (III) и ортофосфата натрия в молекулярном и молекулярно-ионном виде. Укажите реакцию среды (рН). Добавление каких из перечисленных ниже реагентов к раствору сульфата хрома (Ш) усилит гидролиз соли:
а) HCl; б) KOH; в) ZnCl2; г) Na2CO3; д) H2O?
Вариант 4. 15.
Сколько граммов Na2SO3 потребуется для приготовления 5 мл 8 % раствора, плотность которого 1,075 г/мл?
Для нейтрализации 30 мл 0,1 н раствора щелочи потребовалось 12 мл раствора кислоты. Определите нормальность кислоты.
Вычислите осмотическое давление раствора содержащего 16 г сахарозы С12Н22О11 в 350 г Н2О при 293 К. Плотность раствора считать равной 1.
Раствор, содержащий 16,05 г Ba(NO3)2 в 500 г воды, кипит при 100,1220. Рассчитайте изотонический коэффициент этого раствора.
Напишите выражения для произведения растворимости соединений Al(OH)3, Bi2(CO3)3.
Определите концентрации ионов Н+ и ОН- в растворах водородный показатель которых равен: 3; 8. Во сколько раз концентрация ионов Н+ больше или меньше концентрации ионов ОН- в этих растворах?
Составьте молекулярные и молекулярно-ионные уравнения реакций взаимодействия в растворах между: а) Fe(OH)3 и HCl; б) Zn(OH)2 и KOH; в) FeCl3 и NH4OH.
Напишите уравнения реакций гидролиза солей CuSO4 и K2SiO3 в молекулярном и молекулярно-ионном виде. Укажите реакцию среды (рН). Определите направление смещения равновесия при добавлении к раствору K2SiO3 соляной кислоты, а к раствору CuSO4 – гидроксида калия.
Вариант 4. 16.
Чему равна молярная концентрация эквивалента 30 %-ного раствора NaOH плотностью 1,328 г/мл?
Какой объем 0,3 н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 мл?
Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,7180 С. Температура кристаллизации уксусной кислоты 16,650С.
При растворении 0,1 моль HF в воды 15 % растворенных молекул распалось на ионы. Чему равен изотонический коэффициент этого раствора?
Напишите выражения для произведений растворимости соединений MnS, Zn(OH)2.
Рассчитайте рН растворов в которых: а) концентрация ионов ОН- равна 10-11 моль/л: б) концентрация ионов Н+ равна 10-3 моль/л.
Напишите уравнения реакций гидролиза солей AlCl3 и Na2CO3 в молекулярном и молекулярно-ионном виде. Укажите реакцию среды (рН). Определите направление смещения равновесия для каждого случая при: разбавлении; нагревании.
Подтвердите уравнениями реакций в молекулярном и молекулярно-ионном виде амфотерность гидроксида сурьмы (Ш).
Вариант 4. 17.
Сколько граммов 8 %-ного раствора NaOH потребуется для нейтрализации 292 г 20 % раствора HCl?
На нейтрализацию 30 мл 0,1 н раствора кислоты потребовалось 15 мл раствора едкого натра. Сколько граммов едкого натра содержит 1 л этого раствора?
В каком объеме должны быть растворены 10 г этилового спирта С2Н5ОН, чтобы осмотическое давление раствора при 150С равнялось 10 кПа?
Кажущаяся степень диссоциации MgCl2 в растворе, содержащем 0,25 моль MgCl2 в 1000 г воды, равна 0,84. Во сколько раз понижение температуры замерзания этого раствора больше понижения температуры замерзания эквимолярного раствора неэлектролита?
Напишите выражения для произведения растворимости солей BaC2O4, PbSO4.
Где и во сколько раз концентрация ионов Н+ больше – в растворе, в котором рН = 10, или в растворе, в котором рН = 12?
Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) Al(OH)3 + NaOH; б) Cu(OH)2 + HNO3; в) HCl + HNO3.
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде: а) СuSO4; б) Na2CO3. При смешивании этих солей каждая гидролизутся необратимо до конца. Составьте уравнения реакций в молекулярном и молекулярно-ионном виде.
Вариант 18.
Найти процентную концентрацию раствора азотной кислоты, в 1 л которого содержится 224 г HNO3 (ρ = 1,12 г/мл).
Для нейтрализации 30 мл 0,1 н раствора щелочи потребовалось 12 мл раствора кислоты. Определите нормальность кислоты.
Вычислите осмотическое давление при 00С раствора, содержащего 3,72 г анилина C6H5NH2 в 1 л раствора.
Степень диссоциации HCl в растворе, содержащем 7,3 г HCl в 200 г воды, равна 78 %. Вычислите температуру кипения раствора.
Напишите выражение для произведения растворимости соединений AgJ, Fe(OH)2.
Сколько ионов Н+ и сколько ионов ОН- содержится в 1 мл раствора, в котором рН = 3?
Составьте по три молекулярных уравнения реакций, которые выражаются молекулярно-ионными уравнениями:
а) Cu+ + S2- = CuS; б) SiO32- + 2H+ = H2SiO3.
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде: а) бромида цинка, б) ортофосфата натрия. Определите реакцию среды (рН). Определите направление смещения равновесия при добавлении в эти растворы: а) серной кислоты, б) гидроксида калия.
Вариант 19.
Для нейтрализации раствора, содержащего 2,25 г кислоты, потребовалось 25 мл 2 н раствора щелочи. Определите молярную массу эквивалента кислоты.
Сколько граммов Na2SO3 потребуется для приготовления 5 мл 8 %-ного раствора (ρ = 1,75 г/мл).
При 250С осмотическое давление раствора, содержащего 0,700 г растворенного вещества в 250 мл раствора, равно 2∙104 Па. Вычислите молярную массу растворенного вещества.
Кажущуюся степень диссоциации гидроксида натрия в растворе, содержащем 4,1 г NaOH в 200 г воды, равна 88 %. Определите температуру кипения этого раствора (КЭ для воды 0,520С).
Напишите выражения для произведения растворимости соединений: PbF2, AgJO3.
Вычислите рН раствора, в 1 л которого содержится 0,17 г ионов ОН-.
Составьте молекулярные и молекулярно-ионные уравнения реакций взаимодействия в растворах между:
а) FeCl3 и KOH; б) MgCO3 и HNO3; в) Zn(OH)2 и KOH.
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде K2SO3, FeCl3. Определите реакцию среды (рН). Определите направление смещения равновесия при добавлении в эти растворы хлорида цинка.
Вариант 20.
В каком количестве граммов воды следует растворить 100 г MgSO4 для получения раствора, содержащего 5 % безводной соли?
Сколько граммов СаСО2 выпадает в осадок, если к 400 мл 0,5 н раствора хлористого кальция СаCl2 прибавить избыток раствора соды?
В каком количестве сероуглерода нужно растворить 0,10 моль вещества, чтобы раствор кипел при 470С? Температура кипения сероуглерода 46,30С, эбуллиоскопическая константа 2,290С.
Осмотическое давление при 00С раствора, содержащего 0,050 г KNO3 в 100 мл раствора, равно 2,22∙104 Па. Вычислите кажущуюся степень диссоциации KNO3 в растворе.
Напишите выражение для произведения растворимости соединений: Ag3PO4; Cr(OH)3.
Где и во сколько раз концентрация ионов Н+ больше – в растворе, в котором рН = 4, или в растворе, в котором рН = 2?
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде NiCl, K2CO3. Определите реакцию среды (рН). Определите направление смещения равновесия при добавлении в эти растворы сульфида натрия.
Подтвердите уравнениями реакций в молекулярно и молекулярно-ионном виде амфотерность Ве(ОН)2.
Вариант 21.
На нейтрализацию 40 мл раствора щелочи израсходовано 24 мл 0,5 н раствора HCl. Какова нормальность раствора щелочи и титр раствора HCl.
Вычислите молярную концентрацию и молярную концентрацию эквивалента 20 %-ного раствора хлорида кальция плотностью 1,178 г/см2.
Вычислите массовую долю (%) водного раствора сахара С12Н22О11, зная, что температура кристаллизации раствора -0,930С. Криоскопическая константа воды 1,860С.
Кажущаяся степень диссоциации Na2CO3 в растворе, содержащем 0,01 моль Na2CO3 в 200 г воды, равна 0,70. Вычислите температуру замерзания раствора.
Напишите выражения для произведения растворимости соединений: MgS, Mn(OH)2.
Вычислите рН растворов по концентрации ионов ОН- равной: 1,7∙10-7 г/л; 0,01 моль/л.
Составьте молекулярные и молекулярно-ионные уравнения реакций взаимодействия в растворах между:
а) H2S c NaOH и Ba(OH)2; б) Al(OH)3 c KOH и HCl.
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде NaC2H3O2; CoCl2. определите реакцию среды (рН). Определите направление смещения равновесия при добавлении в эти растворы гидроксида калия.
Вариант 22.
Вычислите молярность 20 %-ного раствора хлорида цинка, плотность которого 1,186 г/мл.
Сколько мл 0,5 н раствора NaOH потребуется для осаждения железа, содержащегося в 20,1 мл 1,6 н раствора FeCl3?
Вычислите осмотическое давление раствора при 00С, содержащего 6,02∙1017 молекул растворенного вещества в 1 мл раствора.
5%-ный водный раствор КОН кипит при 100,860С. Вычислите кажущуюся степень диссоциации КОН.
Напишите выражения для произведения растворимости соединений: BaSO4, Cr(OH)3.
Найдите молярную концентрацию ионов ОН- в растворах, в которых концентрация ионов водорода (моль/л) равна: 10-3, 10-12.
В каком случае произойдет реакция:
а) нитрат цинка + сульфит натрия; б) хлорид магния + сульфат натрия; в) хлорид натрия + нитрат серебра. Составьте уравнения реакций в молекулярной и молекулярно-ионном форме.
На основании уравнений гидролиза солей в молекулярной и молекулярно-ионном форме ответе, в растворе какой соли среда щелочная: а) Na2SO3; б) Zn(NO3)2? Как влияет температура на гидролиз: а) ослабляет, б) усиливает, в) не влияет?
Вариант 23.
Смешали 100 мл раствора серной кислоты с массовой долей H2SO4 20 % (ρ = 1б14 г/мл) и 400 г раствора хлорида бария с массовой долей 5,2 %. Вычислите массу выпавшего осадка.
Сколько 0,50 н раствора щелочи требуется, чтобы осадить в виде Cu(OH)2 всю медь, содержащуюся в 15 мл 1,2 н раствора CuCl2?
При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,3720С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,860С.
Степень диссоциации HBr в 0,05 н растворе равна 0,889. Вычислите осмотическое давление раствора при 200С.
Напишите выражения для произведения растворимости солей: CuCO3, PbJ2.
Сколько ионов Н+ и ОН- содержится в 1 мл раствора, в котором рН=8?
Напишите уравнения реакций гидролиза в молекулярном и молекулярно-ионном виде FeCl2, FeCl3, K2S. Какая из данных солей железа сильнее подвергается гидролизу? Ответ поясните.
Подтвердите уравнениями реакций в молекулярном и молекулярно-ионном виде амфотерность Mn(OH)4.
Вариант 24.
Выразить в процентах концентрацию раствора, содержащего 200 г воды в 20 г глюкоы.
Сколько мл 0,5 М раствора H2SO4 можно приготовить из 15 мл 2,5 М раствора.
При 360С осмотическое давление раствора, содержащего 4,880 г растворенного вещества в 2 л раствора, равно 513,6 102. Вычислите молярную массу растворенного вещества.
Кажущуюся степень диссоциации K2SO4 в растворе, содержащем, 0,026 моль K2SO4 в 50 г воды равна 53 %. Вычислите повышение температуры кипения раствора.
Определите концентрацию ионов Н+ и ОН- в растворах, водородный показатель которых равен: 5; 11. Во сколько раз концентрации ионов ОН- в этих растворах.
Напишите выражения для произведения растворимости солей: PbСrO4; CaF2.
Составьте молекулярные и молекулярно-ионные уравнения реакций : a) Fe(OH)3 и HCl; б) Zn(OH)2 и NaOH.
Какая из солей в большей степени подвергается гидролизу: а) Na3PO4; б) NaCN [(Н3РО4) = 27 %; (НСN) = 0,009 %]? Напишите уравнения реакций гидролиза этих солей в молекулярном и молекулярно-ионном виде.
Вариант 4. 25.
Определите молярную концентрацию эквивалента, моляльность и массовую долю (%) Fe2(SO4)3 в растворе и титр 0,8 М Fe2(SO4)3, если плотность раствора 1000 кг/м3.
Какой объем 0,25 н раствора Н2SO4 можно нейтрализовать прибавление 0,6 л 0,15 н раствора Са(ОН)2?
Раствор, состоящий из 9,2 г иода и 100 г метилового спирта, закипает при 650С. Сколько атомов входит в состав молекулы иода в растворенном состоянии? Температура кипения спирта 64,70С, а его эбуллиоскопическая константа КЭ = 0,840С.
Вычислите кажущуюся степень диссоциации MgCl2 в водном растворе (0,5 %) с плотностью 1000 кг/м3, если при 180С осмотическое давление этого раствора равно 3,2∙105 Па.
Напишите выражения для произведения растворимости соединений: Mg(OH)2, CuCO3.
Рассчитайте рН растворов, если концентрация ионов ОН- равна:
4,92∙10-3 (моль/л), 10-11 (моль/л), 1,7∙10-3 (моль/л).
Смешали попарно растворы:
1) KCl и NaNO3; 2) NaOH и HNO3; 3) HCl и KOH; 4) KCl и AgNO3. Составьте молекулярные и молекулярно-ионные уравнения происходящих реакций. Между какими веществами реакция не происходит?
В растворе какой соли самая высокая концентрация ионов Н+: 1)Na2SO4; 2) Na2SO3; 3) ZnCl2? Составьте молекулярные и молекулярно-ионные уравнения происходящих реакций гидролиза.
Вариант 4. 26.
Какой объем раствора серной кислоты с массовой долей H2SO4 30 %
(ρ = 1219 кг/м3) можно приготовить из 12 кг раствора серной кислоты с массовой долей H2SO4 60 %?
Сколько миллилитров 0,2 М раствора Na2СО3 требуется для реакции с 50 мл 0,5 М раствора CaCl2?
Осмотическое давление раствора, содержащего в 1 л 3,2 г неэлектролита, равно 2,42∙105 Па при 200С. Вычислите молярную массу неэлектролита.
Вычислите кажущуюся степень диссоциации ZnCl2, если раствор, содержащий 1,7 г хлорида цинка в 250 г воды, замерзает при – 0,230С.
КК(Н2О) = 1,860С.
Напишите выражения для произведения растворимости соединений: Al(OH)3, SrSO4.
Определите концентрации ионов Н+ и ОН- в растворах, водородный показатель которых равен: 6,5; 10. Во сколько раз концентрации ионов ОН- больше или меньше концентрации ионов Н+ в этих растворах?
Составьте по два молекулярных уравнения к каждому из молекулярных ионных уравнений:
а) Au(OH)3 + OH- [A(OH)4]−; б) Fe(OH)2 + 2H+ Fe2+ + 2H2O.
При совместном гидролизе солей CrCl3 и Na2CO3 образуется осадок Cr(OH)3. Объясните причину и напишите соответствующие уравнения в молекулярном и молекулярно-ионном виде.
Вариант 4. 27.
Какова была масса Al(OH)3, если для его растворения потребовалось 0,2 л раствора азотной кислоты (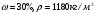 )? )?
Сколько граммов СаСО3 выпадает в осадок, если к 400 мл 0,5 н раcтвора CaCl2 прибавить избыток раствора соды?
При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения повысилась на 0,4530С. Определите молярную массу растворенного вещества.
Вычислите кажущуюся степень диссоциации NaCl в 0,25 н растворе, если этот раствор изотоничен с 0,44 М раствором глюкозы С6Н12О6 при температуре 180С.
Напишите выражения для произведения растворимости солей: Ag2CO3, PbS.
Определите рН растворов, если концентрация ионов Н+ равна 10-8 моль/л; концентрация ионов ОН- равна 1,7∙10-5 г/л.
Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) NaOH + KOH; б) Sn(OH)2 + KOH; в) Sn(OH)2 + HNO3. Представьте возможные реакции в молекулярном и молекулярно-ионном виде.
Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3, FeCl3 или FeCl2. Почему? Составьте молекулярные и молекулярно-ионные уравнения гидролиза этих солей. [Кгидр(H2CO3)=4,45·10-7; Кгидр(H2SO3)=1,3·10-2].
Вариант 4. 28.
Какой объем раствора соляной кислоты, в котором массовая доля 6 %
(ρ = 1018 кг/м3), необходимо прибавить к 0,5 л 0,02 н раствора AgNO3 для полного осаждения иона Ag+ в виде AgCl.
Вычислите молярную концентрацию эквивалента 20,8 %-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора.
При 00С осмотическое давление раствора сахара С12Н22О11 равно 3,55∙105 Па. Какая масса сахара содержится в 2 л раствора?
Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при – 0,130С. Вычислите кажущуюся степень диссоциации соли.
Напишите выражения для произведения растворимости солей: AgBr, Ca3(PO4)2.
Какие из веществ – KCl, NiSO4, Be(OH)2 – взаимодействуют с растворами гидроксида натрия, соляной кислотой. Запишите возможные реакции в молекулярном и молекулярно-ионном виде.
Определите концентрации ионов Н+ и ОН- в растворах, в которых рОН равен: 10; 5.
Составьте молекулярные и молекулярно-ионные уравнения гидролиза солей: NiSO4; K2SiO3. Укажите реакцию среды (рН). К растворам этих солей добавили NaOH. В каком случае гидролиз усилится? Почему?
Вариант 4. 29.
Какой объем 50 %-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6 % раствора (пл. 1,048 г/см3).
На нейтрализацию 2 л раствора, содержащего 2,8 г КОН, требуется 100 мл раствора кислоты. Вычислите молярную массу эквивалента раствора кислоты.
Вычислите температуру кристаллизации 2 %-ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,860.
Осмотическое давление 0,125 М KBr равно 5,56∙105 Па при 250С. Вычислите кажущуюся степень диссоциации этой соли в растворе.
Напишите выражения для произведения растворимости соединений: Zn(OH)2, CdCO3.
Сколько ионов Н+ и сколько ионов ОН- содержится в 1 мл раствора, в котором рН = 2?
Составьте по три молекулярных уравнения к каждому из молекулярно-ионных уравнений: а) NH4- + OH- = NH3 + H2O; б) Fe2+ + 2OH- = Fe(OH)2; в) Zn(OH)2 + 2OH- = [Zn(OH)4]2-.
Напишите уравнения гидролиза солей Al(SO4)3 и K2S в молекулярном и молекулярно-ионном виде. При смешивании этих растворов в осадок выпадает Al(OH)3. Укажите причину этого и составьте соответствующие молекулярные и молекулярно-ионные уравнения.
Вариант 4. 30.
Для осаждения в виде AgCl всего серебра, содержащегося в 200 мл раствора AgNO3, потребуется 100 мл 0,2 н раствора HCl. Какова молярная концентрация эквивалента раствора AgNO3? Какая масса AgCl выпадет в осадок?
Какой объем 10 %-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2 %-ного раствора (пл. 1,02 г/см3).
Вычислите массовую долю (%) водного раствора глицерина С3Н5(ОН)3, Эбуллиоскопическая константа воды 0,520С.
Определите осмотическое давление 0,02 М MgSO4 при 180С, если кажущаяся степень диссоциации этого электролита равна 70 %.
Напишите выражения для произведения растворимости солей: PbCl2, SrCO3.
Вычислите рН растворов в 1 л которых содержится: 0,000001 моль/л Н+ и 0,000017 г/л ОН-.
Представьте в молекулярном и молекулярно-ионном виде реакции взаимодействия между: а) гидроксидом хрома (III) и серной кислотой ; б) гидроксидом калия и гидроксидом хрома (Ш).
Какая из двух солей при равных условиях в большей степени подвергается гидролизу: K3BO3 или K2S; Pb(NO3)2 или ZnCl2. Почему? Составьте уравнения гидролиза этих солей в молекулярном и молекулярно-ионном виде. [Kгидр(Н3BO3)=5,7·10-10; Kгидр(Н2S)=6,8·10-8; Kгидр(Pb(OH)2)=9,6·10-4; Kгидр(Zn(OH)2)=1,5·10-9].
Тема 5
|
|
|
 Скачать 410.9 Kb.
Скачать 410.9 Kb.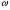 показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах: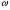 = 100
= 100 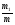 ; где
; где 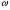 − массовая доля (%) растворенного вещества; m1 – масса растворенного вещества, г; m – масса раствора, г. Масса раствора равна произведению объема раствора V на его плотность ρ
− массовая доля (%) растворенного вещества; m1 – масса растворенного вещества, г; m – масса раствора, г. Масса раствора равна произведению объема раствора V на его плотность ρ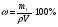 . Массовая доля хлорида калия в растворе:
. Массовая доля хлорида калия в растворе: 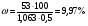
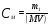 , где m1 – масса растворенного вещества, г; М – его молярная масса, г/моль; V – объем раствора, л. М(NaOH) = 40 г/моль. Масса NaOH, содержащегося в растворе, равна
, где m1 – масса растворенного вещества, г; М – его молярная масса, г/моль; V – объем раствора, л. М(NaOH) = 40 г/моль. Масса NaOH, содержащегося в растворе, равна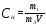 ; где m1 – масса растворенного вещества, г; mэ – молярная масса эквивалента растворенного вещества, г/моль; V - объем раствора, л.
; где m1 – масса растворенного вещества, г; mэ – молярная масса эквивалента растворенного вещества, г/моль; V - объем раствора, л. 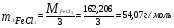
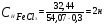
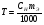 , где Т – титр раствора, СН – молярная концентрация эквивалента, mЭ – молярная масса эквивалента растворенного вещества.
, где Т – титр раствора, СН – молярная концентрация эквивалента, mЭ – молярная масса эквивалента растворенного вещества. 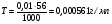 .
.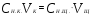 , где
, где 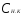 и
и 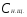 − нормальность кислоты и щелочи;
− нормальность кислоты и щелочи; 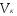 и
и 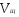 - соответствующие объемы.
- соответствующие объемы.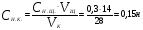 .
.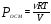 , где ν – количество растворенного вещества, моль; V – объем раствора, м3; R – молярная газовая постоянная, равная 8,31 Дж/(моль∙К). В 1,4 л раствора содержится
, где ν – количество растворенного вещества, моль; V – объем раствора, м3; R – молярная газовая постоянная, равная 8,31 Дж/(моль∙К). В 1,4 л раствора содержится 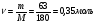 глюкозы. М - молярная масса глюкозы. Осмотическое давление этого раствора:
глюкозы. М - молярная масса глюкозы. Осмотическое давление этого раствора: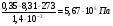 .
.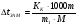 ;
; 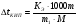 , где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора, Кк и КЭ – криоскопическая и эбуллиоскопическая константы; m – масса растворенного вещества, г; М – его молярная масса, m1 – масса растворителя, г.
, где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора, Кк и КЭ – криоскопическая и эбуллиоскопическая константы; m – масса растворенного вещества, г; М – его молярная масса, m1 – масса растворителя, г.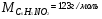 ;
;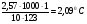 ; tкип = 80,2 + 2,09 = 82,290C; ∆tзам =
; tкип = 80,2 + 2,09 = 82,290C; ∆tзам = 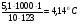 ; ∆tзам = 5,4 – 4,14 = 1,2600С.
; ∆tзам = 5,4 – 4,14 = 1,2600С.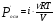 , отсюда
, отсюда 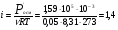 . 0,1 н ZnSO4 соответствует 0,05 М ZnSO4.
. 0,1 н ZnSO4 соответствует 0,05 М ZnSO4.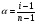 , где n – число ионов, образующихся при диссоциации молекулы электролита. При диссоциации Ca(NO3)2 образуется три иона.
, где n – число ионов, образующихся при диссоциации молекулы электролита. При диссоциации Ca(NO3)2 образуется три иона. 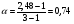 (или 74 %).
(или 74 %).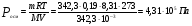 .
.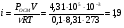
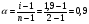 (или 90 %).
(или 90 %).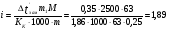 . Кажущаяся степень диссоциации HNO3 в этом растворе равна
. Кажущаяся степень диссоциации HNO3 в этом растворе равна 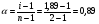 (или 89 %).
(или 89 %).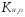 , находим концентрацию ионов Н+:
, находим концентрацию ионов Н+: 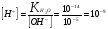 (моль/л).
(моль/л).
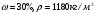 )?
)?