задачи по химии. Государственное образовательное учреждение
 Скачать 410.9 Kb. Скачать 410.9 Kb.
|
Вариант 3.7.
FeO(к) + CO(г) = Fe(к) + CO2(г) 2BH3(г) = B2H6(г).
300 К на это требуется 60 минут.
FeO(к) + CO(г) Fe(к) + CO2(г)
Вариант 3.8.
CaO(к) + CO2 (г)  CaCO3(к) CaCO3(к)CCl4(г) + 4HCl(г)  CH4 +4Cl2 CH4 +4Cl2
4Fe(к) + 3O2(г) 2Fe2O3(к)
[СOCl2] = 4,65 10-5 моль/л, [CO] = 0,001 моль/л, [Cl2] = 0,001 моль/л. Чему равна константа равновесия?
СО2 + Сграфит = 2СО Вариант 3.9.
CO2(г) + С(к) 2СО(г); H2O(г) + С2Н4  С2Н5ОН(г) С2Н5ОН(г)
SFe6(г) + 3H2O(г)  SO3(г) + 6HF(г); Са(к) + 2Н2О(г) SO3(г) + 6HF(г); Са(к) + 2Н2О(г)  Са(ОН)2(к) Са(ОН)2(к)
2NO2 = 2NO +O2, [NO2] = 0,06 моль/л, [NO] = 0,24 моль/л, [О2] = 0,12 моль/л. Чему равна константа равновесия?
Вариант 3.10.
СаСО3(к) СаО(к) + СО2(г); 2N2 + 6H2O(г) 4NH3 + 3O2
PCl5(г)  PCl3(г) + Cl2(г); 3Fe(к) + 4H2O(г) PCl3(г) + Cl2(г); 3Fe(к) + 4H2O(г) Fe3O4 ++ 4H2(г) Fe3O4 ++ 4H2(г)
N2 + O2 = 2NO.
3Fe(к) +4H2O(г) = Fe3O4(к) + 4H2(г) Вариант 3.11.
4HCl(г) + O2(г) 2H2O + 2Cl2(г); 2Na(к) + 2H2O(г) 2NaOH(к) +H2(г)
4Fe(к) + 3O2(г) 2Fe2О3(к); SF6(г) + 3H2O SO3(г)+ 6HF(г) 5. Найдите константу равновесия реакции N2O4 = 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия прореагировало 30% N2O4. 6. В каком направлении сместится равновесие системы 2Na2CO3(к) + CO2 +H2O(г) = 2NaHCO3(к) при повышении давления?
Вариант 3.12.
Fe3O(к) +3H2(г) 2Fe(к) + 3H2O(г); SO2Cl2(г)  SO2 + Cl2 SO2 + Cl2
Вариант 3. 13.
Вариант 3. 14.
3Fe(к) + 4Н2О(г) = Fe3О4(к) + 4Н2(г) Н2 + СО2  СО + Н2О(г) СО + Н2О(г)
2NО + Cl2 ↔ 2NCl2
4HCl + O2 = 2H2O(г) + 2Cl2 при увеличении концентрации HCl?
Вариант 3. 15.
CCl4 + 4HCl  CH4(г) + 4Cl2(г); N2 + 3H2 2NH3 CH4(г) + 4Cl2(г); N2 + 3H2 2NH3
SO2(г) + CaO(к)  CaSO3(к); СО + Н2О(г) CaSO3(к); СО + Н2О(г)  СО2 + Н2 СО2 + Н2
PCl5 = PCl3 + Cl2, ∆H = + 130 кДж, при повышении температуры?
Вариант 3. 16.
2С2Н6 + 7О2 4СО2 + 6Н2О(г)
3О2 2О3 Н0298 = +184,6 кДж; 2СО + Н2О(г) 2СО2 + Н2 Н0298 = - 41,2 кДж
(NH4)2Cr2O7(к) N2 + Cr2O3(к) + 4H2O(г) Вариант 3. 17.
С2Н5ОН + 3О2 2СО2 + 3Н2О(г)
2HJ H2 + J2 если исходная концентрация HJ составляет 0,55 моль/л, а константа равновесия 0,12.
а) 2СO CO2 +C H0298 = -172,5 кДж; б) 2H2S 2H2 + S2 Н0298 = +169,4 кДж
Вариант 3. 18.
Pb(к) + CO2 PbO(к) + CO; C4H10 C4H6 + 2H2
Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза?
СН4 + Н2О СО + 3Н2 при уменьшении объема в 3 раза ?
2NO + O2 2NO2 – 113 кДж; N2O4 2NO2 + 58 кДж
Вариант 3. 19.
2H2O(г) 2H2 + O2; SiO2(к) + 4F2 SiF4(г) + 2OF2(г)
2HCl H2 + Cl2 H 0; 2H2S + SO2 3S(к) + 2H2O H 0
Fe2O3(к) + 3CO(г) 2Fe(к) + 3CO2(г) при введении избытка диоксида углерода.
Вариант 3. 20.
H2O(г) + C2H4 C2H5OH(г); 2KOH(к) + Cr2O3 (к) 2KCrO2(к) + H2O(г).
а) С(к) + СО2(г)  2СО(г); б) J2(г) + 5CO2(г) 2СО(г); б) J2(г) + 5CO2(г)  J2O5(к) + 5CO(г). J2O5(к) + 5CO(г).
ZnS(к) + H2(г)  Zn(ж) + H2S(г), если ввести избыток а) Н2, б) Н2S. Zn(ж) + H2S(г), если ввести избыток а) Н2, б) Н2S.
С(к) + 2N2O(г)  CO2(г) + 2N2(г). CO2(г) + 2N2(г).Вариант 3. 21.
2Fe(к) + 3Cl2(г)  2FeCl3(к). 2FeCl3(к).Вариант 3. 22.
2F2 + H2O(г)  2HF(г) + OF2(г); 2Na(к) + 2H2O(г) 2HF(г) + OF2(г); 2Na(к) + 2H2O(г)  2NaOH(к) +Н2 2NaOH(к) +Н2
2Cl2(г) + 2H2O(г) 4  НCl(г) + O2(г) ∆Н > 0; НCl(г) + O2(г) ∆Н > 0; MgCO3 (к)  MgO(к) + CO2(г) ∆Н > 0 MgO(к) + CO2(г) ∆Н > 0
Fe(OH)2(к) + 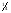 O2(г) + O2(г) + 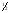 H2O(ж) H2O(ж)  Fe(OH)3(к). Fe(OH)3(к).Вариант 3. 23. 1. Напишите выражения скоростей прямых и обратных реакций: 2Pb(к) + O2(г)  2PbO(к) 2PbO(к)CO(г)+ Cl2(г)  СCl2O(г) СCl2O(г)2. Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В – 5 моль/л. Константа скорости реакции равна 0,5 л . моль-1∙ с-1 Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В. 3. Две реакции при 300 К протекают с одинаковой скоростью. Температурный коэффициент первой и второй реакций равны, соответственно 2 и 3. Как будут относится скорости реакций, если первую из них провести при 350 К, а вторую – при 330 К? 4. Напишите выражения констант равновесия следующих обратимых реакций: 2MoO3(к)  2MoO2(к) + O2(г) 2MoO2(к) + O2(г)CH4(г) + 2H2S(г)  CS2 (г)+4H2(г) CS2 (г)+4H2(г)5. Для реакции H2(г) + Br2(г)  2HBr(г) при некоторой температуре К = 1. Определите состав (в % по объему) равновесной реакционной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей Br2. 2HBr(г) при некоторой температуре К = 1. Определите состав (в % по объему) равновесной реакционной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей Br2.6. В какую сторону сместится равновесие обратимой реакции при увеличении: а) концентрации хлорида олова (II), б) хлорида олова (IV) SnCl2 + 2FeCl3  SnCl4 + 2FeCl2 SnCl4 + 2FeCl27. Определите влево или вправо смещается равновесие в системах Ca(к) + 2H2O2(г)  Ca(OH)2(к) + H2(г) ∆H <0 Ca(OH)2(к) + H2(г) ∆H <0SO2Cl2  SO2 + Cl2 ∆H > 0 SO2 + Cl2 ∆H > 0а) при понижении температуры б) при увеличении давления 8. Рассчитайте число степеней свободы в равновесной системе 4Fe(к) + 3O2(г)  2Fe2O3(к) 2Fe2O3(к)Вариант 3. 24. 1. Напишите выражения скоростей прямых и обратных реакций Н2О(г) + С2Н4(г)  С2Н5ОН(г) С2Н5ОН(г)2KOH(к) + Cr2O3 (к)  2KCrO2 (к)+ H2O(г) 2KCrO2 (к)+ H2O(г)2. Определите, как изменится скорость прямой реакции 2СО + О2  2СО2 2СО2Если общее давление в системе увеличить в 4 раза. 3. Напишите выражения констант равновесия следующих обратных химических реакций: С2Н5ОН(г) + 3О2 ↔ 2СО2 + 3Н2О FeO(к) + H2 ↔ Fe(к) + H2O(г) 4. Вычислите, при какой температуре реакция закончится за 45 минут, если при 290 К на это требуется 2,25 часа. Температурный коэффициент скорости реакции равен 3. 5. Константа равновесия реакции А + В  С + Д равна единице. Начальная концентрация [А]0 = 0,02 моль/л. Сколько процентов вещества А подвергается превращению, если начальная концентрация [В]0 равна 0,02 моль/л? С + Д равна единице. Начальная концентрация [А]0 = 0,02 моль/л. Сколько процентов вещества А подвергается превращению, если начальная концентрация [В]0 равна 0,02 моль/л?6. Установите, увеличится или уменьшится равновесный выход продуктов реакции (р, Т = сonst) NO2(г) + SO2(г)  SO3 (г) + NO(г) при уменьшении концентрации: SO3 (г) + NO(г) при уменьшении концентрации:а) оксида азота (II) б) оксида серы (IV) 7. Определите, влево или вправо сместится положение равновесия реакций 2HCl(г) + Br2 (г)  2HBr(г) + Cl2(г) ∆H > 0 2HBr(г) + Cl2(г) ∆H > 03Cl2 (г)+ 6NaOH(ж)  5NaCl(ж)+ NaClO3(ж)+3H2O(г), ∆H < 0 5NaCl(ж)+ NaClO3(ж)+3H2O(г), ∆H < 08. Рассчитайте число степеней свободы в равновесной системе NiS(к) + H2(г)  Ni(ж) +H2S(г) Ni(ж) +H2S(г)Вариант 3. 25. 1. Напишите выражения скоростей прямых и обратных реакций: C(к) + 2N2O(г)  CO2(г) + 2N2(г) CO2(г) + 2N2(г)PCl3(г) + Cl2(г)  PCl5(г) PCl5(г)2. Установите, во сколько раз увеличится скорость реакции СО(г) + 2Н2(г)  СН3ОН(ж) СН3ОН(ж)при увеличении концентрации водорода в 2 раза. 3. Константа скорости некоторой реакции 273 и 293 К соответственно 1,31 и 6,55 л·моль-1·мин-1. Найдите температурный коэффициент скорости реакции. 4. Напишите выражения констант равновесия следующих обратимых химических реакций СOCl2(г)  CO(г) + Cl2(г) CO(г) + Cl2(г)Ca(OH)2(ж) + 2CO2(г)  Ca(HCO3)2 (ж) Ca(HCO3)2 (ж)5. Химическое равновесие реакции СО2 + Н2  СО + Н2О установилось при следующих концентрациях реагирующих веществ (моль/л): [СО2] = 7, [Н2] = 5, [СО] = 10, [Н2О] = 14. Равновесие системы было нарушено из-за уменьшения концентрации Н2О до 11 моль/л. Вычислите, какими стали новые равновесные концентрации реагирующих веществ после сдвига равновесия. СО + Н2О установилось при следующих концентрациях реагирующих веществ (моль/л): [СО2] = 7, [Н2] = 5, [СО] = 10, [Н2О] = 14. Равновесие системы было нарушено из-за уменьшения концентрации Н2О до 11 моль/л. Вычислите, какими стали новые равновесные концентрации реагирующих веществ после сдвига равновесия.6. В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакций: N2O4  2NO2 ∆H0298 = +58,4 кДж 2NO2 ∆H0298 = +58,4 кДж2NO + Cl2  2NOCl ∆H0298 = -73,6 кДж 2NOCl ∆H0298 = -73,6 кДж7. Известны значения константы равновесия следующих реакций при некоторых условиях: 2BaO2(к)  2BaO(г) + O2(г) ; Кр = 0,3 2BaO(г) + O2(г) ; Кр = 0,34Al(к) + 3O3 (г)  2Al4O3(к) ; Кр = 1·106 2Al4O3(к) ; Кр = 1·106Какие вещества – реагенты или продукты – преобладают в равновесной смеси? Дайте обоснованный ответ. 8. Рассчитайте число степеней свободы в равновесной системе 4Al(к) + 3O2(г)  2Al2O3(к) 2Al2O3(к)Вариант 3. 26. 1. Напишите выражения скоростей прямых и обратных реакций: 2H2O(г) + 2Cl2(г)  4HCl(г) + O2(г) 4HCl(г) + O2(г)СаО(к) + СО2(г)  СаСО3(к) СаСО3(к)2. Найдите значение константы скорости реакции А + В → АВ, если при концентрациях веществ А и В , равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5·10-5( 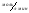 ). ).3. Константа скорости некоторой реакции при 288 К равна 2·10-2. Температурный коэффициент равен 3. Вычислите константу скорости этой реакции при 308 К. 4. Напишите выражения констант равновесия следующих обратимых химических реакций S8(к) + 16H2O(г) ↔ 8SO2(г) + 16H2(г) СО2(г) + 4 Н2(г) ↔ СН4(г) + 2Н2О(ж) 5. Для реакции, протекающей в стандартных условиях, найдены следующие значения Кр при разных температурах: 0,003; 1719; 2,5·1011; 1,0; 7,1·10-8. При каком из указанных значений Кр равновесный выход продуктов а) небольшой, б) наименьший. 6. Равновесные концентрации веществ в реакции СН3ООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О Равны (моль/л): [СН3СООН] = 0,02; [С2Н5ОН] = 0,32; [СН3СООС2Н] = 0,08; [Н2О] = 0,08. Какими стали равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в4 раза? 7. Как повлияет уменьшение давления и увеличение температуры на равновесие систем: 2СО ↔ СО2 + С(к) ; ∆Н0298 = -172,5 кДж 4Cr(к) + 3O2(г) ↔ Cr2O3(к) ; ∆Н0298 = -2282 кДж 8. Рассчитайте число степеней свободы в равновесной системе Cs2O(к) + H2O(ж) ↔ 2CsOH(к) Вариант 3. 27. 1. Напишите выражения скоростей прямых и обратных реакций 2NH3(г) + 3Cl2(г) N2(г) +6HCl(г) C(к) + 2N2O(г) CO2 (г)+ 2N2(г) 2. Реакция омыления уксусноэтилового эфира идет по уравнению СН3СООС2Н5 + NaOH = CH3COONa + C2H5OH Исходные концентрации реагирующих веществ до начала реакции были: СН3СООС2Н5 = 0,5 моль/л; NaOH = 0,25 моль/л. Вычислите концентрации всех участвующих в реакции веществ в момент, когда СН3СООС2Н5 стала 0,3 моль/л. 3. Константа скорости реакции омыления пропилового эфира уксусной кислоты щелочью при 283 и 293 К соответственно равны 2,15 и 4,30 лмоль-1мин-1. Найдите температурный коэффициент скорости реакции. 4. Укажите, к какому из значений константы равновесия Кр 0, Кр , Кр 1 относятся утверждения (условия стандартные): а) реакция протекает в прямом направлении практически необратимо; б) реакция в прямом направлении почти не протекает, но практически полностью протекает в обратном; в) оба направления протекания реакции практически равновероятны. 5. Равновесие реакции 2NO + O2 2NO установилось при следующих концентрациях реагирующих веществ (моль/л): NO = 0,5; O2 = 0,7; NO2 = 2,1 Как изменятся скорости прямой и обратной реакций, если в системе уменьшить общее давление в 2 раза ? Произойдет ли при этом смещение равновесия реакции? 6. Как повлияет понижение температуры и давления на равновесие обратимых реакций: P2O5(к) P2O3(к) + O2(г) H 0 3C2H2г) C6H6(г) Н 0 7. Установите увеличится или уменьшится равновесный выход продуктов реакции (р, Т = const) CS2(г) + 3O2 (г) CO2(г) + 2SO2 а) при увеличении концентрации CS2; б) при уменьшении концентрации СО2 8. Рассчитайте число степеней свободы в равновесной системе 2S(к) + 2H2O(ж) 2H2S(г) + O2(г) Вариант 3. 28. 1. Напишите выражения скоростей прямых и обратных реакций 2Na(к) + Cl2(г) 2NaCl(к) 2NOCl(г) 2NO(г) + Cl2(г) 2. Во сколько раз и как изменится скорость обратной реакции 2Fe(к) + 3CO2(г) Fe2O3(к) + 3CO(г) при уменьшении концентрации продуктов реакции в 3 раза. 3. Вычислите, при какой температуре реакция закончится за 30 минут, если при 300 К на это требуется 2 часа. Температурный коэффициент скорости реакции равен 2. 4. Установите, изменится ли (и если да, то как) значение константы равновесия процессов 2А(г) 3В(г) Н0 0 Х(к) + У(ж) Z(г) Н 0 при повышении температуры. 5. Химическое равновесие реакции А + В С + Д установилось при следующих концентрациях веществ (моль/л): А = 18,0; В = 16,0; С = 12; Д = 24,0. Концентрацию С понизили на 12 моль/л, в результате чего сместилось равновесие системы. Определите новые равновесные концентрации реагирующих веществ. 6. Определите, в какую сторону произойдет смещение равновесия реакции 2С2Н6(г) + 7О2(г) 4СО2(г) + 6Н2О(г) при введении: а) избытка кислорода; б) избытка СО2 7. Как повлияет повышение температуры и давления на равновесие обратимых реакций: 2HCl(г) + Br2(г) 2HBr(г) + Cl2(г) ; Н 0 S(к) + О2(г) SО2(г); Н 0 8. Рассчитайте число степеней свободы для данной равновесной системы (NH4)2Cr2O7(к) N2(г) + Cr2O3(к) + 4Н2О(г) Вариант 3. 29. 1. Напишите выражение скоростей прямых и обратных реакций: SF6 (г)+ 3H2O(г) SO3(г) + 6HF(г) 2BaSO4(к) 2BaSO3(к) + O2(г) 2. Реакция протекает по уравнению Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S Как изменится скорость реакции после уменьшения концентрации Na2S2O3 в 4 раза? 3. На сколько градусов нужно понизить температуру, чтобы скорость реакции понизилась в 64 раза? Температурный коэффициент равен 2. 4. В каком направлении будет смещаться равновесие реакции СН4(г) + Н2О(г) СО(г) + 3Н2(г) при уменьшении объема в 3 раза. 5. Химическое равновесие реакции COCl2 CO + Cl2 установилось при концентрациях реагирующих веществ (моль/л): СOCl2 = 10; CO = 2; Cl2 = 4. В равновесную систему добавили хлор в количестве 4 моль/л. Определите новые равновесные концентрации реагирующих веществ после смещения равновесия. 6. Определите, в какую сторону сместится равновесие в системе SiO2(к) + 4F2 (г) SiF4(г) + 2OF2(г) при введении избытка фтора. 7. Как повлияет понижение температуры и понижение давления на равновесие обратимых реакций: Н2О(г) + С2Н4(г) С2Н5ОН(г); Н 0 2KOH(к) + Cr2O3(к) 2KCrO2(к) + H2O; Н 0 8. Рассчитайте число степеней свободы для данной равновесной системы 2KOH(к) + Cr2O3(к) 2KCrO2(к) + H2O(ж) Вариант 3. 30. 1. Напишите выражения скоростей прямых и обратных реакций: СО2(г) + Н2(г) СО(г) + Н2О(г) SO2г) + CaO(к) CaSO3(к) 2. Реакция выражается уравнением 4HCl + O2 2H2O + 2Cl2 Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): HCl = 0,85; O2 = 0,44; Cl2 = 0,30. Какими были концентрации НCl и О2 в начале реакции? 3. Константа скорости некоторой реакции при 300 и 330 К равна соответственно 3,0210-4 и 8,1510-3 лмоль-1мин -1. Найдите температурный коэффициент скорости реакции. 4. Реакция протекает с выделением теплоты 2NO + Cl2  2NOCl; ∆H0298 = -73,6 кДж 2NOCl; ∆H0298 = -73,6 кДжВ сторону какой реакции сместится равновесие, если общее давление в системе понизить в 4 раза и одновременно повысить температуру на 400 (температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 4). 5. Напишите выражения констант равновесия следующих обратимых химических реакций: С2Н4Сl2(ж)  С2Н4(г) + Cl2(г) С2Н4(г) + Cl2(г)СаО(к) + СО2(г)  СаСО3(к) СаСО3(к)6. Определите: влево или вправо сместится положение равновесия в системе J2(г) + 5СО2(г)  J2O5(к) + 5CO(г) J2O5(к) + 5CO(г)При введении избытка йода. 7. Куда сместится равновесие вследствие уменьшения: а) температуры; б) давления С3Н8(г)  С3Н6(г) + Н2(г) ; ∆Н < 0 С3Н6(г) + Н2(г) ; ∆Н < 02MgO(к)  2Mg(к) + O2(г); ∆Н > 0 2Mg(к) + O2(г); ∆Н > 08. Рассчитайте число степеней свободы для данной равновесной системы: Pb(к) + CO2(г)  PbO(к) + CO(г) PbO(к) + CO(г)Тема 4 |

