хроматография-лекции. Хроматографические методы. Общая характеристика методов
 Скачать 6.82 Mb. Скачать 6.82 Mb.
|
|
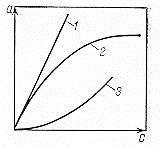
Изотермы адсорбции Изотермой адсорбции называется количественная зависимость между величиной адсорбции и равновесной концентрацией адсорбируемого вещества. В общем виде уравнение изотермы адсорбции записывается следующим образом: Г = f (C), ( 88 ) где Г величина равновесной адсорбции, моль/см2; С равновесная концентрация, моль/л. Наибольшее значение в адсорбционной хроматографии имеют изотерма мономолекулярной адсорбции Лэнгмюра и изотерма полимолекулярной адсорбции Фрейндлиха. Эти изотермы описывают адсорбционные процессы, протекающие по различным механизмам. При выводе уравнения изотермы адсорбции Лэнгмюр исходил из возможности реализации на практике следующих предположений:
Исходя из этих предположений, Лэнгмюр на основе молекулярно-кинетических представлений получил следующее уравнение изотермы адсорбции: Г = Г 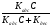 , (89) , (89)где Г предельная адсорбция, достигаемая при заполнении всех активных центров поверхности адсорбента, моль/см2; Кадс константа скорости процесса адсорбции; Кдес константа скорости процесса десорбции. Для преобразования уравнения (89), разделив числитель и знамена- тель на величину Кдеси обозначив отношение 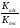 через b, получим: через b, получим: Г = Г 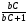 . (90) . (90)Отношение констант скоростей адсорбции есть величина постоянная. Поэтому произведение Гb также величина постоянная: Гb = К . (91) Таким образом, уравнение изотермы адсорбции Лэнгмюра принимает вид: Г = 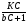 . (92) . (92)Для определения численных значений констант уравнения Лэнгмюра Г и b его приводят к виду 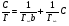 (93) (93)и строят график функции 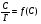 в координатах в координатах 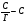 . .Отрезок, отсекаемый на оси ординат, равен 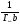 , а тангенс угла наклона функции равен , а тангенс угла наклона функции равен 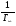 . .Выясним, какой вид имеет изотерма адсорбции Лэнгмюра. В области малых значений равновесных концентраций, когда С 0, величиной произведения bC в знаменателе уравнения (92) пренебрегаем и получаем уравнение: Г = К С. (94) Это так называемый закон Генри: отношение величины равновесной адсорбции к равновесной концентрации есть величина постоянная. Таким образом, теория мономолекулярной адсорбции Лэнгмюра предсказывает, что при малых равновесных концентрациях адсорбируемого соединения на изотерме адсорбции должен существовать прямолинейный участок, участок Генри. Далее, в области высоких значений равновесных концентраций в уравнении изотермы адсорбции пренебрегаем единицей в знаменателе и получаем уравнение Г = 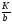 , (95) , (95)т.е. имеем случай, когда все адсорбционные центры поверхности адсорбента заняты и величина равновесной адсорбции не зависит от величины равновесной концентрации, так что на изотерме адсорбции должен существовать линейный участок, параллельный оси абсцисс. Таким образом, изотерма адсорбции Лэнгмюра должна иметь начальный линейный участок (участок Генри) и плато, соответствующее заполнению всех адсорбционных центров. Теория Лэнгмюра также позволяет количественно описывать адсорбцию многокомпонентных смесей, предполагая, что каждая адсорбируемая молекула занимает только один адсорбционный центр. Для двухкомпонентной смеси величины адсорбции компонентов рассчитываются по соотношениям: Г1 = 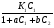 , (96) , (96) Г2 = 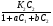 , (97) , (97)где Г1, Г2 величины адсорбции 1 и 2 компонентов соответственно; С1, С2 равновесные концентрации компонентов; К1, К2 константы уравнения Лэнгмюра; а, b постоянные величины. При описании процессов адсорбции с помощью представлений Лэнгмюра следует учитывать, что эта теория описывает только те случаи адсорбции, когда адсорбируемые молекулы образуют мономо-лекулярный адсорбционный слой на поверхности адсорбента. Однако адсорбционные процессы не всегда протекают только таким образом. В самом деле, если молекулы, образующие насыщенный адсорбционный слой, сильно поляризованы под действием силового поля адсорбента, тогда они сами обладают способностью взаимодействовать с молекулами, находящимися в растворе и образовывать второй адсорбционный слой. Молекулы второго адсорбционного слоя в свою очередь тоже поляризуются, и может произойти адсорбция третьего слоя. Таким образом, имеет место протекание процесса полимолекулярной адсорбции. Особенности протекания процессов полимолекулярной адсорбции были детально обследованы большим числом ученых: Брунауэром, Эмметом, Теллером, Поляни, Фрейндлихом. Основные типы изотерм физической адсорбции приведены на рис. 52. 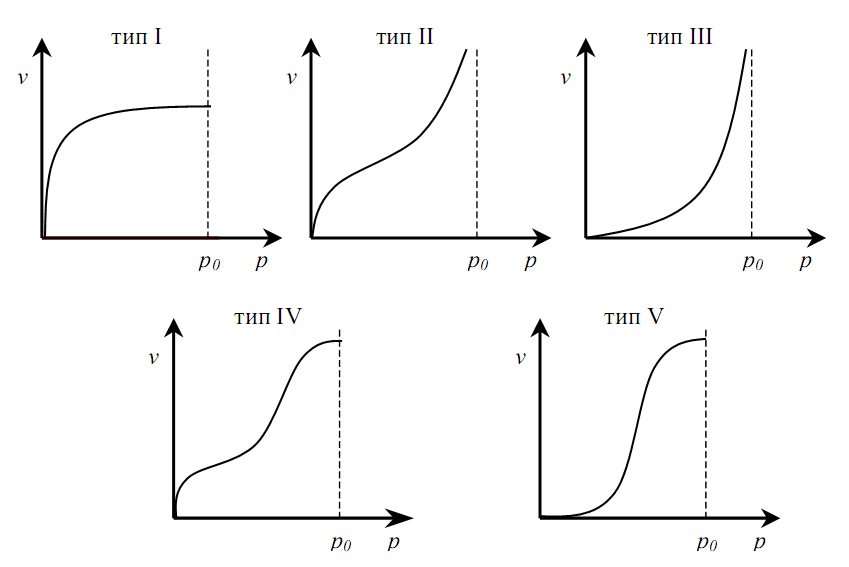 Уравнение, описывающее изотермы адсорбции типов 1, 2 и 3, имеет вид: 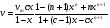 , (98) , (98)где  общий объем адсорбированного вещества; общий объем адсорбированного вещества; 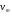 объем адсор-бированного вещества, когда вся поверхность адсорбента покрыта мономолекулярным слоем; n максимальное число слоев, которое может адсорбироваться; объем адсор-бированного вещества, когда вся поверхность адсорбента покрыта мономолекулярным слоем; n максимальное число слоев, которое может адсорбироваться; 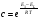 , (99) , (99) где E1 средняя теплота адсорбции вещества в первом слое; EL теплота конденсации вещества; 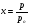 , ,где po величина давления насыщенного пара исследуемого соединения; p величина давления пара адсорбирующегося соединения. Уравнение ( 98 ) имеет два важных предельных случая. Если n = 1, то оно сводится к уравнению 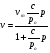 . (100) . (100)Сравнение с уравнением ( 92 ) показывает, что полученное уравнение является уравнением мономолекулярной адсорбции Лэнгмюра, в котором константа b приняла значение 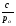 . .Если n > 1, то в зависимости от численного значения константы с получаем или изотерму типа 2, или изотерму типа 3. Действительно, если силы притяжения между адсорбентом и адсорбируемым соединением больше, чем силы притяжения между молекулами адсорбируемого вещества в жидком состоянии, т.е. если в уравнении ( 99 ) Е1>EL, то получается S-образная изотерма 2 типа. Если, напротив, силы притяжения между адсорбентом и адсорбируемым веществом малы, т.е. если Е1<EL, получается изотерма 3 типа. Наконец, если максимальное число адсорбированных слоев составляет 2n-1, то общий объем адсорбированного газообразного соединения определяется соотношением:  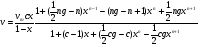 , (101) , (101)в котором 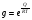 ; ; где 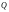 добавочная энергия испарения последнего адсорбированного слоя, определяемая из соотношения: добавочная энергия испарения последнего адсорбированного слоя, определяемая из соотношения: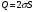 , ,где  величина поверхностного натяжения; величина поверхностного натяжения; 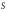 величина поверхности, покрываемая одним молем сжиженного газообразного соединения, распределенного в виде мономолекулярного слоя. величина поверхности, покрываемая одним молем сжиженного газообразного соединения, распределенного в виде мономолекулярного слоя.При с > 1 уравнение ( 101 ) описывает изотермы типа 4, а при с < 1 – изотермы типа 5. Если капиллярные силы очень малы, т.е. если Q  0, или g 0, или g  1, то уравнение ( 101 ) сводится к уравнению ( 100 ), которое в зависимости от численных значений с описывает изотермы типа 2 и 3. 1, то уравнение ( 101 ) сводится к уравнению ( 100 ), которое в зависимости от численных значений с описывает изотермы типа 2 и 3.Наконец, при n=1 уравнение (101) описывает изотермы типа 1. Таким образом, уравнение (101) содержит в качестве частных случаев все пять различных типов изотерм. Вследствие своей сложности это уравнение достаточно редко используется в практике. На практике для описания процессов полимолекулярной адсорбции применяется упрощенная форма уравнения (101) – уравнение Фрейндлиха: Г = а Сn, (102) где Г величина равновесной адсорбции; С равновесная концентрация; a, n константы. Вид изотермы Фрейндлиха соответствует третьему типу изотерм физической адсорбции, приведенных на рис. 35. В билогарифмических координатах уравнение Фрейндлиха представляет собой прямую; величина отрезка, отсекаемого на оси ординат, равна lga, а величина тангенса угла наклона равна n. Изотермы адсорбции и форма фронтов зон Рассмотрим вопросы применения теории адсорбции к описанию хроматографических разделений. Основными задачами теории адсорбции в приложении к хроматографии являются получение ответов на два вопроса:
Процессы хроматографических разделений могут рассматриваться либо с позиций линейной и идеальной, либо с позиций нелинейной и неидеальной теории. Линейная и идеальная теория является упрощенным вариантом нелинейной и неидеальной теории, поскольку предполагает существование следующих допущений:
 Эти положения конечно же не соответствуют реальному эксперименту. Для установления адсорбционных связей всегда требуется некоторое время, необходимое для диффузии молекул разделяемых соединений из подвижной фазы к поверхности адсорбента, время на диффузию этих молекул от поверхности зерна к центру, и наконец, время на установление адсорбционных связей. Далее, в потоке подвижной фазы всегда имеет место процесс перемешивания зон разделяемых компонентов, т.е. существованием процесса продольной диффузии пренебрегать также нельзя. Нелинейная и неидеальная теория обязательно учитывает эти факторы процесса разделения. Однако для предварительных рассуждений вполне можно ограничиться представлениями линейной и идеальной теории, поскольку с технической стороны возможно организовать выполнение экспериментальных исследований таким образом, чтобы достаточно строго реализовать требования нелинейной и неидеальной теории:
Эти условия эксперимента будут способствовать очень быстрому установлению адсорбционного равновесия и существенному снижению влияния процессов продольной диффузии на перемешивание зон разделяемых компонентов. Таким образом, выводы линейной и идеальной теории оказываются очень вескими, поскольку если они предсказывают невозможность разделения компонентов данной смеси, то кинетические факторы нелинейной и неидеальной теории будут только усиливать эту невозможность. Если линейная и идеальная теория предсказывает возможность разделения, целесообразно попробовать реализовать эту возможность практически. В этой связи рассмотрим, что дают представления линейной и идеальной теории с точки зрения обеспечения оптимальных условий для обострения фронтов зон разделяемых веществ. Используем полученное ранее выражение для описания скорости перемещения фронта зоны по колонке:  . . Приведенное уравнение позволяет сделать весьма важный вывод – скорость перемещения фронта зоны, а следовательно, и оптимизация условий обострения фронтов зоны определяется видом изотермы адсорбции. Рассмотрим вопросы формирования фронтов зон в случае описания процесса адсорбции изотермой Лэнгмюра. Верхняя часть изотермы адсорбции, описывающая область высоких равновесных концентраций, соответствует головному, или переднему, фронту зоны. Нижняя часть изотермы, область низких равновесных концентраций, соответствует заднему фронту хвостовой части зоны. При хроматографическом разделении непрерывно, последовательно повторяется один и тот же элементарный акт адсорбции и десорбции и исследуемое соединение либо полностью находится в адсорбенте (адсорбция), либо полностью находится в объеме подвижной фазы (десорбция). Величина  для плотно упакованных колонок имеет очень малое численное значение и остается постоянной в течение всего процесса разделения. для плотно упакованных колонок имеет очень малое численное значение и остается постоянной в течение всего процесса разделения.Следовательно, для головной части изотермы адсорбции производная 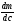 является величиной постоянной и малой по своему численному значению. Единица, деленная на малую величину, приводит к большим значениям скорости перемещения молекул, находящихся в этой части зоны. является величиной постоянной и малой по своему численному значению. Единица, деленная на малую величину, приводит к большим значениям скорости перемещения молекул, находящихся в этой части зоны.Таким образом, молекулы, входящие в головную часть зоны, продвигаются быстро и с одинаковой скоростью, что благоприятствует созданию условий обострения фронта зоны. Для хвостовой части зоны величина производной 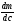 существенно больше по абсолютному значению; скорость перемещения молекул, находящихся в этой части зоны, уменьшается, причем уменьшается по-разному в соответствии с разными значениями производной; и фронт зоны, как следствие этого, размывается. существенно больше по абсолютному значению; скорость перемещения молекул, находящихся в этой части зоны, уменьшается, причем уменьшается по-разному в соответствии с разными значениями производной; и фронт зоны, как следствие этого, размывается.Таким образом, если процесс адсорбции описывается уравнением мономолекулярной адсорбции Лэнгмюра, то на хроматограмме передний фронт зоны обострен, а задний фронт – размыт. К этому выводу можно прийти и при установлении физического смысла связи изотермы адсорбции и размывания фронтов зоны. На начальном участке изотермы адсорбции, в области малых равновесных концентраций, хвосте зоны, на поверхности адсорбента много свободных адсорбционных центров, коэффициент распределения молекул исследуемого соединения, определяемый отношением концентрации в адсорбенте к концентрации в подвижной фазе велик. В результате этого скорость перемещения молекул мала и различна для различных участков зоны. Головная часть зоны соответствует участку изотермы полного насыщения адсорбционных центров, силы адсорбции уменьшены и скорость перемещения молекул высокая и одинаковая. В случае изотермы полимолекулярной адсорбции Фрейндлиха для головной части зоны величины производных 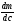 большие, следовательно, скорость перемещения молекул в зоне мала и различается по абсолютному значению, что приводит к размыванию головной части зоны. Хвостовая часть зоны описывается практически линейным участком и малым, по сравнению с головной частью, значением производной. Следовательно, хвостовая часть зоны выходит обостренной. большие, следовательно, скорость перемещения молекул в зоне мала и различается по абсолютному значению, что приводит к размыванию головной части зоны. Хвостовая часть зоны описывается практически линейным участком и малым, по сравнению с головной частью, значением производной. Следовательно, хвостовая часть зоны выходит обостренной.Рассмотрим третий случай, когда изотерма адсорбции линейна во всех областях равновесных концентраций. В этом случае величина производной 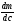 остается постоянной, одинаковой для молекул головной и хвостовой части зоны и выходная кривая регистрируется симметричной. остается постоянной, одинаковой для молекул головной и хвостовой части зоны и выходная кривая регистрируется симметричной.Из приведенного материала следует весьма важный вывод, позволяющий реализовать максимальную эффективность разделения используемой хроматографической колонки. Поскольку следует стремиться к таким условиям процесса разделения, когда пики на хроматограмме регистрируются как симметричные, реализовать это возможно лишь в тех случаях, когда величины равновесных концентраций разделяемых соединений в подвижной фазе соответствуют закону Генри, т.е. располагаются на начальных линейных участках изотерм адсорбции. 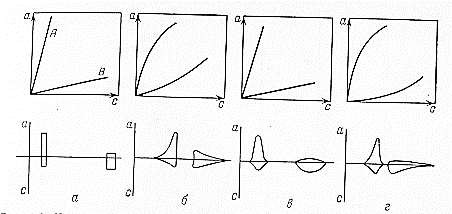 1.2.2. Основные факторы размывания хроматографических пиков. Для того чтобы разделить бинарную смесь компонентов, необходимо, чтобы они находились в колонке разное время. Однако даже время пребывания отдельных молекул одного и того же вещества в большей или меньшей степени отличается от среднего значения, характерного для этого вещества. Причиной этому являются процессы диффузии, конвекции и замедленного обмена между подвижной и неподвижной фазами. Насадочные колонки независимо от их внутреннего диаметра представляют собой трубки, заполненные частицами сорбента, которые образуют стационарный зернистый слой. Поток газа фильтруется через этот слой, двигаясь по транспортным каналам, образуемым зазорами между частицами. За счет разных по длине путей перемещения молекул разделяемых соединений возникает специфический размывающий фактор, характеризуемый “вихревой” диффузией.  Рис. 12. В капиллярных колонках имеется единственный транспортный канал вдоль ее оси. В этой связи в капиллярных колонках “вихревая” диффузия отсутствует, но возникает другой размывающий фактор, связанный с параболическим распределением скоростей по сечению канала, характеризуемый так называемой “тейлоровской” диффузией. Вследствие такого “рассеяния” времени пребывания в колонке отдельных молекул концентрация вещества на выходе из колонки изменяется во времени, при этом профиль концентрации подчиняется уравнению функции нормального распределения ошибок Гаусса, которое характеризует распределение концентрации исследуемого соединения C в пространстве в фиксированный момент времени “х” от времени положения максимума хроматографического пика 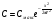 (20) (20) где Смакс– величина концентрации вещества в точке максимума пика, численное значение которой рассчитывается из уравнения (20) при х = 0 и равная коэффициенту перед экспоненциальным членом уравнения Гаусса 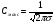 . (21) . (21)Параметр 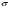 в уравнениях (20) и (21) называется средним квадратичным отклонением, а величину в уравнениях (20) и (21) называется средним квадратичным отклонением, а величину 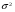 называют дисперсией. Этот параметр характеризует степень размывания кривой распределения случайных ошибок, а в случае хроматографических разделений – ширину регистрируемого хроматографического пика у основания (рис. 13). называют дисперсией. Этот параметр характеризует степень размывания кривой распределения случайных ошибок, а в случае хроматографических разделений – ширину регистрируемого хроматографического пика у основания (рис. 13).Чтобы придать величине среднего квадратичного отклонения графическую интерпретацию, допустим, что в уравнении (20) отношение 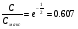 . (22) . (22)Тогда с учетом уравнения (20) можно записать: 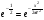 . (23) . (23)Отсюда, приравнивая показатели экспонент, получим х = 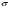 . .Это означает, что полуширина хроматографического пика, измеренная на высоте, составляющей 0.607 от максимальной высоты пика, равна среднеквадратичному отклонению 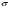 . .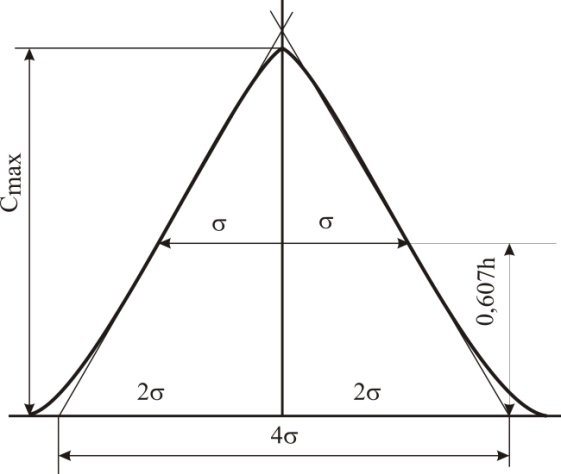 Кривая Гаусса имеет колоколообразную форму: наряду с максимумом она имеет две точки перегиба. Если к этим точкам перегиба провести касательные, то величина отрезка, отсекаемого касательными на оси абсцисс, характеризует ширину хроматографического пика у основания ω и оказывается равной 4 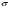 (рис. 14). (рис. 14).1.3 Теория теоретических тарелок Теория теоретических тарелок разработана для описания процесса дистилляции, однако она является общей для всех многостадийных процессов и позволяет оценить эффективность колонки. Теория теоретических тарелок является формальной и основана на представлении, что хроматографируемое вещество проходит через слой сорбента не непрерывным потоком, а порциями, распределяясь между подвижной и неподвижной фазами на отдельных элементарных участках слоя так называемых «тарелках». Через каждую такую тарелку вещество проходит периодическими толчками. При этом предполагается, что за время каждого толчка, т. е. практически мгновенно, на тарелках успевает установиться равновесие распределения всех компонентов между подвижной и неподвижной фазами. Таким образом, согласно этой теории, хроматографический процесс является многоступенчатым и состоит из большого числа актов сорбции=десорбции или растворения=испарения компонентов анализируемого вещества в хроматографической колонке, а сама колонка рассматривается как совокупность многих дискретных ступеней тарелок, хотя в действительности слой адсорбента или пленка неподвижной жидкой фазы в колонке является непрерывным. Анализируемое вещество вместе с элюентом попадает на первую тарелку. Новая порция элюента, подаваемая на первую тарелку, приводит к новому распределению вещества между подвижной и неподвижной фазами, причем часть вещества с данной тарелки переносится на следующую. На этой тарелке также мгновенно устанавливается равновесие, а часть вещества уносится на следующие тарелки. Вследствие этого с каждой новой порцией элюента концентрация вещества на первой тарелке падает, а на последующих возрастает. В результате такого перемещения и перераспределения хроматографируемое вещество оказывается не на одной, а на нескольких тарелках, причем на средних его концентрация достигает максимального значения по сравнению с соседними, так как свежие порции элюента, поступающие в колонку, встречают на первых тарелках все меньшие количества данного компонента в неподвижной фазе. Таким образом, вещество размывается по некоторой толщине слоя неподвижной фазы в колонке, по нескольким тарелкам, причем, чем сильнее размывание, тем большее число тарелок занимает вещество. Следовательно, число тарелок, занимаемых данным компонентом анализируемого вещества, может служить мерой степени размывания вещества по слою адсорбента, мерой эффективности колонки. Такой прием замены реального процесса, протекающего в реальной хроматографической колонке непрерывно и неравновесно, эквивалентным по результатам многоступенчатым дискретным процессом, также приводящим к размыванию полосы компонента, позволил на основании теории скоростей вывести уравнение хроматографической кривой, т.е. дал математическую модель продвижения полосы компонента через колонку. Гауссов характер хроматографического пика обусловлен беспорядочным статистическим характером перемещения большого числа частиц вещества в хроматографической колонке. Одни частицы передвигаются в ней быстрее, другие медленнее, и значения скорости перемещения имеют симметричный разброс относительно среднего значения, характеризующего поведение в колонке некоторой усредненной молекулы.
Если длину слоя сорбента в колонке (длину колонки) L, на которой осуществляется разделение смеси веществ и расположено некоторое число n теоретических тарелок, необходимое для разделения анализируемой смеси веществ, разделить на это число n, то получается величина Н, называемая высотой, эквивалентной одной теоретической тарелке (ВЭТТ): 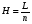 (1.21) (1.21)Высота эквивалентной теоретической тарелки представляет собой толщину слоя сорбента, необходимую для установления равновесного распределения вещества между подвижной и неподвижной фазами. Таким образом, число теоретических тарелок n и высота эквивалентной теоретической тарелки Н являются величинами, характеризующими эффективность хроматографической колонки. Высота эквивалентной теоретической тарелки выражают в единицах длины, как правило в миллиметрах. Так как = 4 мм, экспериментально Н можно определить как дисперсию, приходящуюся на единицу длины колонки L, мм, непосредственно из хроматограммы, используя полученное на хроматограмме значение ширины пика у его основания для нахождения величины : 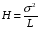 (1.22) (1.22)Так как 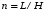 , то , то 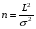 . Приняв время удерживания tR эквивалентом длины колонки, можно установить, что число теоретических тарелок n равно: . Приняв время удерживания tR эквивалентом длины колонки, можно установить, что число теоретических тарелок n равно: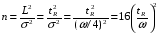 (1.23) (1.23)Если ширина пика измерена на середине его высоты, то 1/2 = 2,35 и 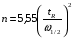 (1.24) (1.24)Под эффективностью в хроматографии понимают способность системы "предотвращать" (ограничивать) размывание зон разделяемых веществ. Эффективность колонки тем выше, чем уже пик получается при том же времени удерживания, и измеряется числом теоретических тарелок. Хроматографическая колонка считается высокоэффективной, когда размывание полос небольшое, пики узкие, высота Н составляет 0,31 мм. В идеальном случае величина Н приближается к диаметру dpзерна сорбента. При уменьшении значения Н максимумы на хроматограмме становятся более острыми. Для сравнения эффективности двух хроматографических колонок следует использовать приведенную высоту h тарелки: 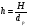 (1.25) (1.25)Теория теоретических тарелок позволяет сравнить эффективность различных колонок, оценить качество сорбента и заполнения колонки. Но эта теория не позволяет выявить зависимость эффективности работы хроматографической колонки от скорости подачи подвижной фазы, природы и дисперсности сорбента, не может дать практических рекомендаций, позволяющих минимизировать размывание хроматографических пиков. 6.2. Оценка параметров эффективности и селективности хроматографической колонки Для того, чтобы разделение двух последовательных пиков стало заметным, необходимо, чтобы расстояние между максимумами пиков на оси времени (t) было больше, чем ширина пиков у основания, выраженная через их стандартные квадратичные отклонения. Установлено, что достаточное разделение происходит лишь в том случае, если: t = 2(1+ 2). При существовании соотношения t (1 + 2), перекрытие (наложение) пиков настолько велико, что оба компонента воспринимаются детектором как одно вещество. Практически полное разделение происходит при условии:
С помощью соотношений (24), (25) и (26) можно непосредственно установить, произошло разделение компонентов или нет. Однако величины t и настолько сильно зависят от внешних условий, что становится невозможным на их основе сделать какие-либо выводы о параметрах разделительной колонки. Подставив в уравнение (24) вместо t разность (t2 - t1) и разделив обе части уравнения на время удерживания первого компонента t1, получим 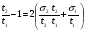 . (27) . (27)Относительные величины 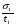 и и 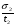 в уравнении (27) уже в значительно меньшей мере зависят от внешних условий и определяются главным образом параметрами колонки. в уравнении (27) уже в значительно меньшей мере зависят от внешних условий и определяются главным образом параметрами колонки.Из уравнения (27) следует, что главную роль в процессе разделения веществ в колонке играют:
Таким образом, определяющими для процесса разделения веществ являются следующие два свойства хроматографической колонки:
Под селективностью в самом общем смысле понимают способность хроматографической системы (сорбента и подвижной фазы) делить данную пару соединений. Как видно из изложенного в предыдущих разделах, роль хроматографической системы сводится, прежде всего к тому, чтобы обеспечить различие в скоростях перемещения компонентов. Чем больше это различие, тем сильнее раздвинуты максимумы пиков или пятна на пластине и тем лучше их разделение. Поэтому представляется логичным в качестве меры селективности использовать отношение скоростей перемещения компонентов. Коэффициент селективности является мерой относительного удерживания или относительной подвижности разделяемых веществ: Рис.1.8. Хроматографические пики при неполном разделении компонентов 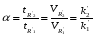 (1.31) (1.31)где t'R1 и t'R2 исправленное время удерживания соответственно веществ 1 и 2,VR’1 и VR’2 исправленный удерживаемый объем соответственно веществ 1 и 2, k'1 и k'2 коэффициенты емкости этих веществ. Если = 1, разделение компонентов сложного вещества невозможно, так как их характеристики одинаковы и на хроматограмме образуется один пик. Для разделения компонентов необходимо подобрать такие условия, чтобы разделяемые вещества перемещались по колонке с разными скоростями. Это достигается главным образом подбором соответствующей подвижной и неподвижной фазы. Так как зависит от коэффициентов емкости k' разделяемых компонентов, то повысив селективность разделения этих компонентов можно, увеличить объем неподвижной фазы, т. е. увеличив длину колонки и объем содержащегося в ней сорбента или неподвижной жидкой фазы. полное разделение (Rs > 1) частичное разделение (0 < Rs < 1) разделение отсутствует (Rs = 0) На хроматограмме пики компонентов анализируемой смеси могут иметь различный вид. Они могут быть расположены совершенно отдельно друг от друга или в большей или меньшей степени накладываться друг на друга (рис.1.8). Разделение двух соседних хроматографических пиков характеризуется разрешением Rs, (критерием разделения) которое описывается уравнением 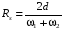 , (1.32) , (1.32)где 1, 2 ширина пиков у их основания. 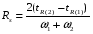 Для плохо разделяющихся пиков предложено несколько критериев: 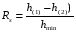 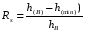 Критерий разделения меняется от 0 до бесконечности. Полное разделение пиков достигается при Rs=1. Кроме того критерий разделения можно представить в виде произведения: 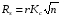 Где Kc критерий селективности, который показывает избирательность хроматографической колонки по отношению к данной паре разделяемых веществ. Он показывает увеличение расстояния между максимумами в ходе хроматографического разделения: 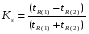 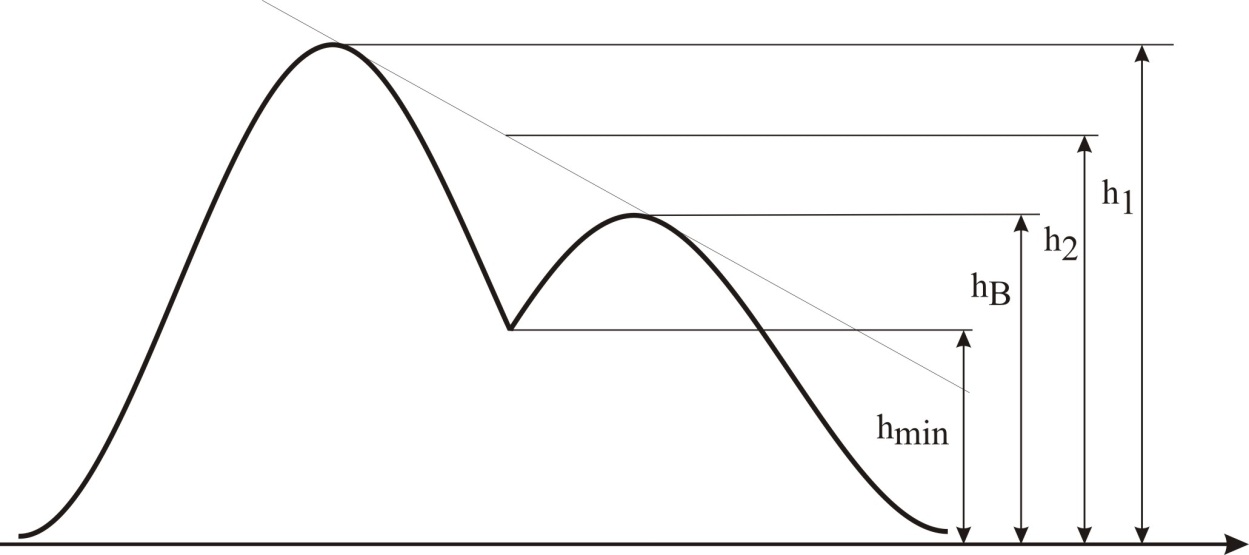 Данная формула удовлетворительно описывает избирательность колонки с большими значениями времен удерживания. Если хотят охарактеризовать избирательность колонки для слабосорбирующихся веществ, в данную формулу подставляют исправленные времена удерживания. Для количественного разделения компонентов вполне достаточно, чтобы Rs имело значение от 1 до 1,5. При Rs = 1 перекрывается только 2% площади пиков, при Rs = 1,5 два соседних пика разделены практически до нулевой (базовой) линии.  6.5. СТЕПЕНЬ РАЗДЕЛЕНИЯ И ЕЕ СВЯЗЬ С ПАРАМЕТРАМИ ХРОМАТОГРАФИЧЕСКОЙ КОЛОНКИ Для оценки степени разделения компонентов можно использовать параметры хроматографической колонки. При этом общее уравнение для эффективности разделения имеет вид: 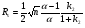 , (39) , (39)которое позволяет установить влияние числа теоретических тарелок (n) и коэффициента емкости колонки для второго компонента (k2) на величину степени разделения двух соединений. С помощью этого уравнения можно рассчитать, какой эффективностью должна характеризоваться хроматографическая колонка для получения заданного значения степени разделения Rs при заданном значении емкости колонки по отношению ко второму компоненту k2 и заданном значении относительного удерживания разделяемых компонентов . Если в соотношении (39) число теоретических тарелок выразить через отношение длины колонки к высоте, эквивалентной теоретической тарелки 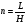 , то поскольку в зафиксированных условиях процесса разделения большая часть параметров этого уравнения остается постоянными, величина степени разделения оказывается пропорциональной корню квадратному из длины хроматографической колонки , то поскольку в зафиксированных условиях процесса разделения большая часть параметров этого уравнения остается постоянными, величина степени разделения оказывается пропорциональной корню квадратному из длины хроматографической колонки 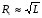 . .Это соотношение показывает, что в первом приближении повысить эффективность процесса разделения можно простым увеличением длины колонки, при сохранении остальных параметров процесса разделения постоянными. 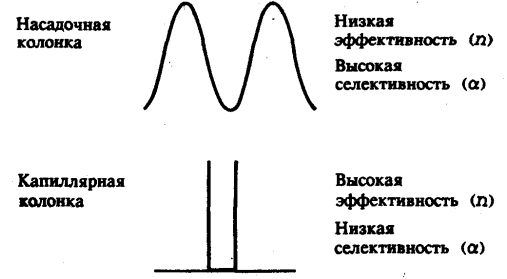 Первый сомножитель показывает, что достигаемое разделение пропорционально корню квадратному из числа теоретических тарелок n т.е. для увеличения разделения вдвое нужно увеличить эффективность колонки в 4 раза. Например, увеличить длину колонки в 4 раза, при этом время анализа увеличивается также в 4 раза. Если α = 1, то RS = 0, т.е. разделения нет независимо от числа теоретических колонок n. Однако из характера функции α в уравнении видно, что наибольшее изменение могут привести к заметному увеличению разделения, особенно для тех случаев, когда значения α близки к 1. Если за счет подбора условий разделения удается изменить α с 1,1 до 1,2, это приводит к улучшению разделения в два раза. Очевидно, что значимым членом является селективность системы. Если емкость колонки (третий сомножитель) принимает значение k = 0, то RS = 0, т.е. разделение отсутствует − оба разделяемых компонента элюируются как несорбируемые вещества (взаимодействия с НЖФ отсутствует). С ростом значения k степень разделения возрастает, при этом скорость анализа уменьшается. Как правило, если эффективность колонки недостаточна, а скорость анализа − важный фактор, то идут следующим путем. Для увеличения эффективности используют колонку с более мелким по зернистости сорбентом, хотя при этом увеличивается и давление в колонке. Следует отметить, что эффективность колонки меньше влияет на разделение, чем селективность и коэффициент емкости, тем не менее повышению эффективности придается большое значение. Влияние условий анализа на эффективность разделения Любая хроматографическая колонка может заметно изменять свои разделительные свойства при изменении условий анализа. Наибольшее влияние оказывают скорость потока газа-носителя и температурапроцесса разделения. ВЛИЯНИЕ СКОРОСТИ ПОТОКА ГАЗА-НОСИТЕЛЯ НА ЭФФЕКТИВНОСТЬ НАСАДОЧНОЙ КОЛОНКИ В ВАРИАНТЕ ГАЗО-ЖИДКОСТНОЙ ХРОМАТОГРАФИИ Эффективность насадочной хроматографической колонки и скорость потока газа-носителя (  ) связаны между собой уравнением Ван-Деемтера: ) связаны между собой уравнением Ван-Деемтера: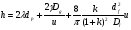 , (40) , (40)где h высота, эквивалентная теоретической тарелке; dp диаметр частиц носителя; коэффициент заполнения колонки, характеризующий степень плотности упаковки насадки в колонке; Dg коэффициент диффузии хроматографируемого вещества в газовой фазе; коэффициент извилистости пути потока газа-носителя; Dl коэффициент диффузии хроматографируемого вещества в неподвижной жидкой фазе; df эффективная толщина слоя неподвижной жидкой фазы на поверхности твердого носителя; k коэффициент емкости колонки. В общем виде уравнение Ван-Деемтера можно представить в следующей форме: 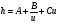 . (41) . (41)Каждое из слагаемых уравнения (41) количественно представляет вклад различных параметров процесса разделения, приводящих к изменению профиля зоны исследуемого соединения в хроматографической колонке. Первый член уравнения А отражает вклад вихревой диффузии и не зависит от скорости потока газа-носителя. Поэтому с уменьшением размера частиц твердого носителя dp , при одной и той же величине степени упаковки насадки в колонке, высота, эквивалентная теоретической тарелке, уменьшается, эффективность колонки возрастает. Графически вклад этого слагаемого изображается прямой, параллельной оси абсцисс, а величина отсекаемого на оси ординат отрезка определяется величиной диаметра частиц носителя неподвижной жидкой фазы. Второй член уравнения 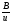 отражает влияние процесса диффузии исследуемого соединения в газовой фазе на эффективность колонки. Коэффициент извилистости показывает влияние геометрического фактора насадки колонки. Чем меньше различаются между собой частицы сорбента по размеру и форме гранул, тем менее извилисты траектории, по которым должны двигаться молекулы разделяемых веществ в потоке газа-носителя. отражает влияние процесса диффузии исследуемого соединения в газовой фазе на эффективность колонки. Коэффициент извилистости показывает влияние геометрического фактора насадки колонки. Чем меньше различаются между собой частицы сорбента по размеру и форме гранул, тем менее извилисты траектории, по которым должны двигаться молекулы разделяемых веществ в потоке газа-носителя.Далее, высота, эквивалентная теоретической тарелке, возрастает пропорционально увеличению коэффициента диффузии вещества в газовой фазе Dg. Возможные пути управления величиной коэффициента диффузии – использование влияния температуры процесса разделения и природы газа-носителя. График вклада этого слагаемого изображается гиперболой. Из третьего члена, 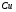 , характеризующего влияние процессов диффузии в неподвижной жидкой фазе, следует, что высота, эквивалентная теоретической тарелке, пропорциональна квадрату толщины жидкой пленки df. Эффективность колонки повышается, если содержание неподвижной жидкой фазы на носителе снижается. , характеризующего влияние процессов диффузии в неподвижной жидкой фазе, следует, что высота, эквивалентная теоретической тарелке, пропорциональна квадрату толщины жидкой пленки df. Эффективность колонки повышается, если содержание неподвижной жидкой фазы на носителе снижается.Для более толстого слоя неподвижной жидкой фазы время, необходимое для диффузии хроматографируемого вещества через пленку неподвижной жидкой фазы и обратно, возрастает и приводит к расширению зоны и снижению эффективности колонки. Коэффициент емкости колонки k обычно превышает единицу для большинства летучих соединений. Следовательно, значение 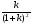 уменьшается с увеличением k. уменьшается с увеличением k. График вклада этого, третьего, слагаемого представляет собой прямую, выходящую из начала координат. Результирующая, с учётом вклада всех трёх слагаемых, изображается кривой (рис. 17). umin u A A A CU CU CU B/U h Рис. 17. Зависимость высоты, эквивалентной теоретической тарелке, от скорости потока газа-носителя Приведенная графическая зависимость позволяет, с одной стороны, установить численное значение оптимальной скорости газа-носителя и, с другой стороны, оценить величины вкладов каждого из процессов, описываемых слагаемыми уравнения Ван-Деемтера в величину высоты, эквивалентной теоретической тарелке, и, изменяя значение скорости потока газа-носителя, изменять величины этих вкладов. Численное значение оптимальной скорости потока газа-носителя можно также определить из уравнения Ван-Деемтера по соотношению: 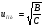 . (42) . (42)Влияние природы газа-носителя на эффективность колонки представлено на рис. 18. u, мл/мин h, см 80 60 40 20 0,4 0,8 1,2 H2 N2 |

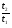 ;
; 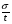 для каждого из разделяемых компонентов.
для каждого из разделяемых компонентов.