Каталитическая функция. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, является белками. Транспортная функция
 Скачать 1.95 Mb. Скачать 1.95 Mb.
|
|
Обмен нуклеиновых кислот. В клетках тканей нуклеиновые кислоты распадаются под влиянием ферментов. Ферменты, расщепляющие полинуклеотидные цепи, называют нуклеазами, или фосфодиэстеразами, так как они ускоряют реакции разрыва межнуклеотидных фосфодиэфирных связей в молекулах нуклеиновых кислот. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы действуют на внутренние межнуклеотидные связи в молекулах ДНК и РНК. Таким образом, при их участии осуществляется деполимеризация нуклеиновых кислот, в основном до олигонуклеотидов. Экзонуклеазы отщепляют нуклеотиды с 3′- или 5'-конца полинуклеотидной цепи и обеспечивают распад нуклеиновых кислот до свободных нуклеотидов. По специфичности действия различают дезоксирибонуклеазы (ДНКазы, расщепляющие ДНК) и рибонуклеазы (РНКазы, гидролизующие РНК). В результате их действия образуются олигонуклеотиды и лишь небольшое количества мононуклеотидов. Рибо- и дезоксирибонуклеозидфосфаты расщепляются до нуклеозидов и фосфорной кислоты под действием фосфатаз (нуклеотидаз). Нуклеозиды могут расщепляться гидролитическим путем с участием фермента нуклеозидазы: Аденозин + Н2О → Аденин + рибоза Пентозы окисляются до CO2 и H2O; фосфорная кислота используется для фосфорилирования органических соединений или выводится из организма. Азотистые основания превращаются в конечные продукты обмена и выделяются с мочой. Продукты гидролиза нуклеиновых кислот поступают в клетки организма, где используются для синтеза нуклеотидов, нуклеиновых кислот, или же для удовлетворения энергетических потребностей клетки и организма. 92. Биосинтез ДНК (репликация): стехиометрия реакций, ДНК-полимераза, матрица. Повреждение и распад ДНК. Источником энергии в реакциях полимеризации мононуклеотидов является энергия, освобождаемая всеми четырьмя типами дезоксирибонуклеозидтрифосфатов, участвующих в синтезе ДНК. Образующийся пирофосфат под действием пирофосфатазы также расщепляется на две молекулы ортофосфата, давая дополнительную энергию для биосинтеза ДНК. Помимо энергии, биогенез ДНК требует наличия специфических ферментов, катализирующих отдельные этапы синтеза, и множества белковых факторов, абсолютно необходимых для регулирования процесса репликации и проявления каталитической активности ферментов. По имеющимся данным, в репликации ДНК, включающей узнавание точки начала процесса, расплетение родительских цепей ДНК в репликационной вилке, инициацию биосинтеза дочерних цепей и дальнейшую их элонгацию и, наконец, окончание (терминация) процесса, участвует более 40 ферментов и белковых факторов, объединенных в единую ДНК репликазную систему, называемую реплисомой. Основным ферментом, катализирующим биосинтез новообразованной ДНК (точнее, стадию элонгации репликации ДНК), является ДНК-полимераза III, представляющая собой мультимерный комплекс собственно ДНК-полимеразы (мол. масса около 900000) и ряда других белков. ДНК-полимераза III катализирует сопряженный синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации. ДНК-полимераза I катализирует отщепление затравочного олигорибонуклеотидного праймера и заполнение образующихся после этого пробелов (ниш) дезоксирибонуклеотидами. Важную функцию соединения двух цепей ДНК или замыкания двух концов одной цепи ДНК в процессе репликации либо репарации ДНК выполняет особый фермент – ДНК-лигаза, катализирующая за счет энергии АТФ образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одной цепи и 5'-фосфатной группой другой цепи ДНК. Функцию раскручивания (расплетения) двойной спирали ДНК в репликационной вилке, происходящего за счет энергии гидролиза АТФ, выполняет специфический rep-белок, названный хеликазой (мол. Масса 300000). Этапы биосинтеза ДНК. Этап I – инициация биосинтеза ДНК – является началом синтеза дочерних нуклеотидных цепей; в инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза – это ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксильной группой у С-3' рибозы. При инициации к цепям ДНК последовательно присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и праймаз. Этап II – элонгация синтеза ДНК – включает два кажущихся одинаковыми, но резко различающихся по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру присоединяются дезоксирибонуклеотиды под действием ДНК-полимеразы III; далее синтез протекает непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении, обратном движению репликационной вилки и начинается фрагментарно. Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации. 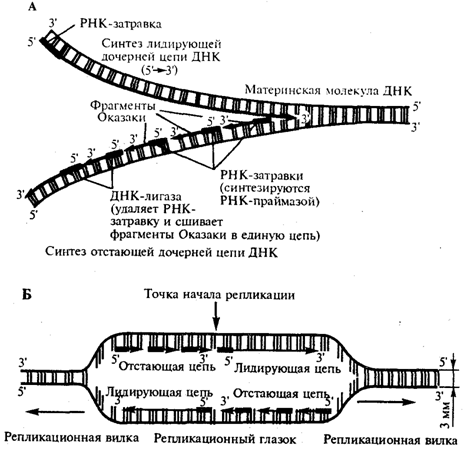 93. Биосинтез РНК (транскрипция): РНК-полимераза, стехиометрия реакции, ДНК как матрица. Регуляция транскрипции. Посттранскрипционная достройка РНК. Молекулярные мутации. Наследственные болезни. Субстратами реакции служат трифосфаты рибонуклеозидов. Реакция идет только в присутствии ДНК, выполняющей роль матрицы. Матрицей служит одна из цепей ДНК, называемая матричной (а также кодирующей, значащей) цепью. Все синтезированные молекулы РНК имеют структуру, комплементарную матрице, т. е. одной из цепей ДНК. Поскольку РНК представляет собой одноцепочечную молекулу (спирализованные участки составляют лишь часть молекулы), стехиомет-рические коэффициенты для всех четырех субстратов различны. Транскрипцию катализируют РНК-полимеразы I, II и III. Первый из этих ферментов участвует в синтезе рибосомных РНК, второй — матричных и третий — транспортных РНК. В процессе транскрипции различают стадии инициации, элонгации и терминации. В результате транскрипции образуются предшественники тРНК, рРНК и мРНК — первичные транскрипты. Затем в ядре и в цитоплазме происходит посттранскрипционная доработка (созревание) этих предшественников, и получаются функционально активные рибонуклеиновые кислоты. Промотор содержит последовательность, обогащенную нуклеотидами Т и А (ТАТА-последовательность), узнаваемую белком ТАТА-фактором. РНК-полимера-за присоединяется к промотору, если ТАТА-последовательность связана с ТАТА-фактором. Матрицей для синтеза РНК служит одна из цепей ДНК; промотор с ТАТА-фактором обеспечивают узнавание РНК-полимеразой транскрибируемой цепи ДНК и первого нуклеотида транскрибируемого гена. Связывание РНК-поли-меразы с промотором и вызванные этим конформационные изменения повышают сродство РНК-полимеразы к факторам инициации. Присоединение этих факторов приводит к локальному расхождению нуклеотидных цепей ДНК; расхождение включает около 10 нуклеотидных пар, т. е. примерно один виток спирали. Элонгация. Наращивание молекулы РНК происходит путем присоединения очередного рибонуклеотида, комплементарного тому дезоксирибонуклеотиду ДНК, который в данный момент находится в области активного центра РНК-полимеразы. В активном центре фермента находится З'-конец растущей цепи РНК, и к нему присоединяется очередной нуклеотид. 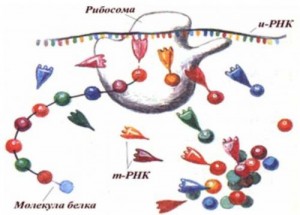 94. Биосинтез белков (трансляция). Стадии биосинтеза белка на рибосоме. Универсальность биологического кода и механизма биосинтеза белков. Посттрансляционные изменения белков. Антибиотики-ингибиторы синтеза белков. Трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой. Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин). Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих. Процесс трансляции разделяют на 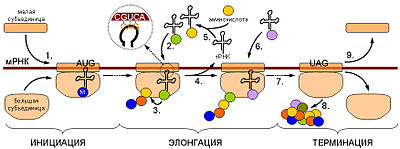
95. Гем, основные этапы биосинтеза. Возможные нарушения обмена порфинов, приводящие к ослаблению синтеза гема. Гемоглобин, его структура. Гетерогенность гемоглобинов (3 типа гемоглобинов у человека). Свойства гемоглобина: кооперативное взаимодействие субъединиц. Виды гемоглобина (P, F, A). Формы гемоглобина: оксигемоглобин, карбгемоглобин, метгемоглобин, карбоксигемоглобин. Функции гемоглобина. Влияние 2,3-дифосфоглицерата эритроцита на процесс оксигенации. Патологии гемоглобина – гемоглобинозы. Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозитсягемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо. Порфобилиноген-синтазаингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованиемуропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп. Образующийся копропорфириноген IIIснова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин , где он связан нековалентно, или в цитохром С, с которым связывается ковалентно. Гемоглобин — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У человека содержится в эритроцитах. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. Виды гемоглобина:  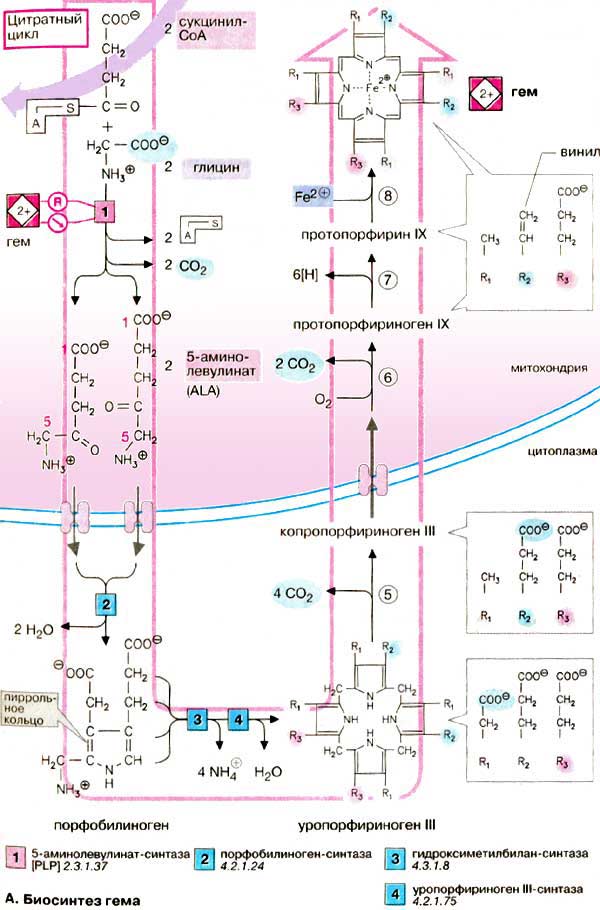
96. Распад гема. Билирубин как продукт распада гема. Метаболизм билирубина. Нарушение его обмена. Желтухи и их биологическая диагностика. Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются (состарившиеся эритроциты фагоцитируются макрофагами, главным образом в селезенке, а также в печени и костном мозге; в микросомальной фракции ретикуло-эндотелиальной системы клеток) и освобождается гемоглобин. В организме человека в течение 1 ч разрушается примерно 100-200 млн эритроцитов. Гем повторно не используется: он распадается с образованием железа и желчных пигментов; железо реутилизируется, а желчные пигменты выводятся из организма. Распад гемоглобина в печени начинается с разрыва a-метиновой связи между I и II кольцами порфиринового кольца, т.е окисляется один из метеновых мостиков тетрапиррольной структуры гемма, углерод метеновой группы превращается в оксид углерода СО. Этот процесс катализируется НАДФ-содержащей оксидазой ЭПР (гем-оксигеназой) с помощью кислорода и НАДФН и приводит к образованию зеленого пигмента вердоглобина (холеглобина). Интенсивный цвет гема и других порфиринов является результатом сопряжения многочисленных двойных связей, которые образуют две резонансно стабилизированные (мезомерные) системы. Основное место образования билирубина − печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метановых связей в протопорфирине). Образовавшийся во всех этих клет ках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь. Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом и только после этого билирубин вступает во взаимодействие с диазореактивом. Так как билирубин нерастворим в воде, плохо растворим в плазме, его транспорт в крови осуществляется в комплексе с альбумином. Повышенный уровень билирубина (>10 мг/л) называется гипербилирубинемией. Билирубин диффундирует из крови в периферические ткани и окрашивает их в желтый цвет. Это особенно легко заметить на белой конъюктиве глаза, в таком случае говорят о желтухе. 97. Физиологическая желтуха новорожденных, ее причины. |
